LINC01215在结直肠癌组织中的表达及其临床意义
谢晨 李智 吕嘉春 魏宜胜 彭铁立
作者单位:511436 广州 1广州医科大学公共卫生学院;510260 广州 2广州医科大学附属第二医院胃肠外科;511518 清远 3广州医科大学附属第六医院消化内科
结直肠癌(colorectal cancer,CRC)是常见的恶性肿瘤,2020年全球新发病例超过190万例,死亡93.5万例,我国结直肠癌死亡率也在逐年上升[1-2]。早发现、早诊断、早治疗是降低CRC死亡率的关键,因此寻找早期筛查的特异性生物标志物具有重要意义。长链非编码RNA(long non-coding RNAs,lncRNA)是不具备蛋白编码功能且长度大于200 nt的DNA转录本,在细胞周期、表观遗传、转录激活等多种重要的调控过程中发挥重要作用,还可通过调节信号传导途径改变肿瘤浸润淋巴细胞表达或免疫微环境,从而影响肿瘤发生发展[3-5]。LINC01215是新近发现的一种lncRNA,在乳腺癌、上皮性卵巢癌中发现其异常表达,且与肿瘤发生发展密切相关[6-7]。但目前LINC01215与CRC的关系鲜见报道。本课题组通过小样本预实验检测76对CRC及其癌旁组织的lncRNAs表达,其中发现LINC01215表达显著。基于此,本研究进一步通过TCGA公共数据库大样本数据并结合临床标本分析LINC01215在CRC组织中的表达及其临床价值,以期进一步阐明LINC01215在CRC中作用。
1 资料与方法
1.1 数据来源
从 TCGA 数据库(https://portal.gdc.cancer.gov/)中下载CRC患者的LINC01215表达数据及临床信息。纳入患者均有完整的RNA表达数据和临床参数信息。最终共纳入530例CRC组织和43例癌旁正常组织。
1.2 临床资料
收集2009年3月至2012年1月在广州医科大学附属第二医院诊治的CRC患者的癌组织及癌旁正常组织(距癌灶5 cm),用磷酸盐缓冲液(PBS)冲洗后立即放入液氮罐中保存。纳入标准:⑴所有患者均为首次治疗,CRC切除术前均未行放疗、化疗等抗肿瘤治疗;⑵组织病理学确诊为CRC。排除标准:⑴合并心、肝、肾等重要脏器疾病;⑵合并其他恶性肿瘤;⑶合并感染性疾病。最终共纳入137例CRC患者,其中≤60岁占48.91%(67/137),男性占54.74%(75/137);结肠癌占40.15%(55/137),直肠癌占59.85%(82/137);低分化占86.86%(119/137),高分化占13.14%(18/137);临床Ⅰ和Ⅱ期患者占50.36%(69/137);T1和T2分期患者占15.33%(21/137);有淋巴结转移患者占52.55%(72/137);有远处转移患者占90.51%(124/137)。收集患者性别、年龄、肿瘤位置、分化程度、TNM分期(AJCC第8版)等临床资料。本研究经广州医科大学伦理委员会审查批准(伦理审查号为KY01-2019-02-10),患者知情同意。
1.3 RT-qPCR检测LINC01215在CRC组织和癌旁正常组织中的表达
使用Trizol试剂(Invitrogen Carlsbad,美国)提取CRC组织和癌旁正常组织中的总RNA,测定RNA含量后,使用逆转录试剂盒PrimeScript®RT reagent Kit(TaKaRa,日本)逆转录成cDNA,并按SYBR®Green分析法进行PCR扩增。PCR反应程序:预变性95℃30 s;95℃ 5 s、60 ℃ 30 s,40个循环。根据 LINC01215全长基因序列,利用Primer Premier 5.0设计特异性的引物。LINC01215上游引物为TGTGCTTGGAACGTGTAGTG,下游引物为AGCAAGCAGAGGATCAAAGC。β-actin上游引物为GGCGGCACCACCATGTACCCT,下游引物为AGGGGCCGGACTCGTCATACT。每个样品设置3个复孔。以β-actin为内参,采用2-△△Ct法计算LINC01215的相对表达量。
1.4 LINC01215相关潜在靶基因的预测及富集分析
通过MEM在线工具(https://biit.cs.ut.ee/mem/index.cgi)获取LINC01215潜在靶基因,选用A-AFFY-44基因矩阵,删除未知基因和含糊不清的基因,根据相关系数从大到小排序,输出前200个靶基因。应用DAVID6.7在线生物信息学工具(https://david.ncifcrf.gov/)对LINC01215靶基因进行GO注释、KEGG信号通路分析,初步探讨LINC01215在CRC中的潜在作用机制。
1.5 单样本基因集富集分析LINC01215表达与CRC免疫浸润水平的关系
利用gsva R语言包通过单样本基因集富集分析(ssGSEA)计算TCGA数据库中CRC样本的免疫细胞浸润评分;采用Spearman分析LINC01215表达与28种免疫细胞浸润评分的相关性。
1.6 药物敏感性分析
从 cellminer网 站(https://discover.nci.nih.gov/cellminer/)下载LINC01215表达和NCI-60药物敏感性数据,选取美国FDA批准的药物和临床试验药物进行分析[8]。通过Spearman分析NCI-60药物z分数与LINC01215表达的相关性,z分数越高,说明LINC01215表达对相应的药物越敏感;根据相关系数进行排序,选取前4种药物。
1.7 统计学方法
采用SPSS 19.0统计学软件进行数据分析。非正态分布数据中连续变量以中位数(P25,P75)形式表示,采用Mann-Whitney U检验法分析LINC01215在CRC组织及正常组织中的表达差异。根据LINC01215表达水平中位数将患者分为高表达组和低表达组,采用χ2检验分析LINC01215表达量与临床特征之间的关系;采用Kaplan-Meier曲线分析两组患者的生存情况,组间差异采用log-rank检验。采用单因素Cox回归分析影响CRC患者总生存期(overall survival,OS)的相关因素,将差异有统计学意义的因素纳入多因素Cox回归模型,分析LINC01215与CRC预后的关联。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 LINC01215在CRC组织和癌旁正常组织中的表达
从TCGA数据库中下载CRC患者的LINC01215表达数据并分析其在癌组织和癌旁正常组织中的表达,结果显示,LINC01215在CRC组织中的表达水平显著低于癌旁正常组织(P<0.001),见图1A;采用RT-qPCR对137例CRC患者的临床组织标本进行检测,结果亦显示,LINC01215在CRC组织中的表达水平低于癌旁正常组织(P=0.001),见图1B。

图1 LINC01215在CRC组织和癌旁正常组织中的表达Fig.1 Expression of LINC01215 in CRC tissues and adjacent normal tissues
2.2 LINC01215表达水平与CRC患者临床特征的关系
在TCGA数据中,LINC01215表达水平与CRC患者年龄、性别、TNM分期等无关(均P>0.05),见表1。临床样本验证显示,LINC01215表达水平与患者组织分化程度相关(P=0.037),但与年龄、性别、TNM分期等无关(均P>0.05),见表2。
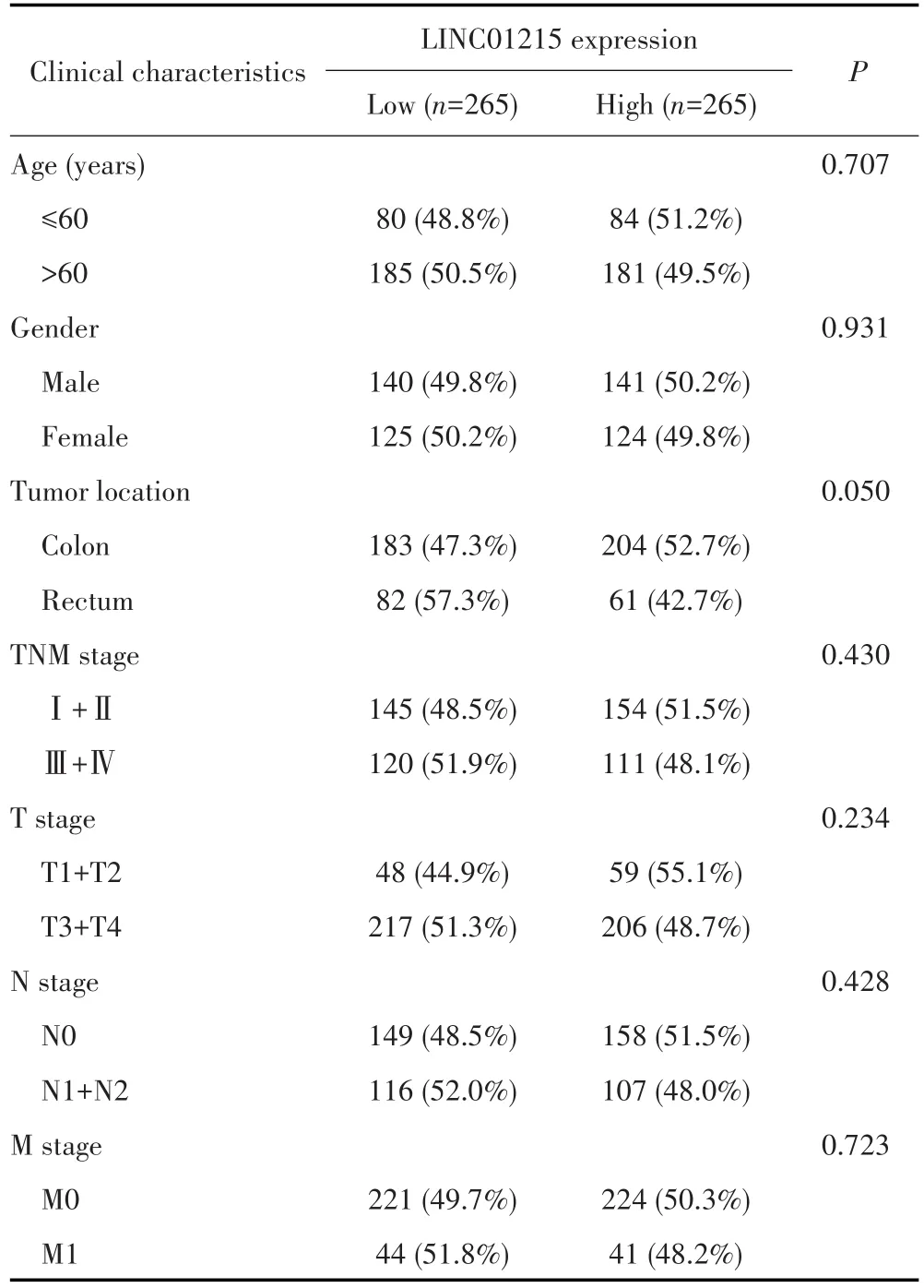
表1 TCGA数据库中LINC01215表达与CRC患者临床特征的关系Tab.1 The relationship between LINC01215 expression and clinical characteristics of CRC patients in TCGA

表2 LINC01215表达水平与CRC患者临床特征的关系Tab.2 The relationship between LINC01215 expression and the clinical characteristics of CRC patients
2.3 LINC01215表达与CRC患者预后的关系
基于TCGA数据库的Kaplan-Meier分析结果显示,LINC01215高表达组的中位OS明显高于LINC01215低表达组[96个月(95%CI:80~113个月)vs 82个月(95%CI:70~95个月),P=0.002],见图2。单因素Cox回归分析显示,LINC01215表达水平、年龄、临床分期和TNM分期与预后相关(均P<0.05)。将LINC01215表达水平、年龄、临床各分期和TNM分期纳入多因素Cox回归模型,结果显示LINC01215低表达是CRC预后不良的危险因素(HR=1.69,95%CI:1.13~2.51,P=0.010),见表3。

图2 基于TCGA数据库分析LINC01215与CRC患者OS的关系Fig.2 The relationship between LINC01215 and OS in CRC patients based on TCGA database

表3 影响CRC患者预后的Cox回归分析Tab.3 The results of Cox analysis affecting the prognosis of patients with CRC
2.4 LINC01215靶基因的富集分析
通过MEM在线工具获取LINC01215的潜在靶基因,并进行GO注释和KEGG分析。GO注释结果显示,LINC01215靶基因在生物过程中主要富集于信号转导、细胞表面受体信号通路等,在细胞组成中主要富集于质膜、细胞质等,在分子功能中主要富集于蛋白质结合等;KEGG分析结果提示,LINC01215的靶基因在CRC中主要富集在免疫或免疫相关途径,如T细胞受体等信号通路,见图3。
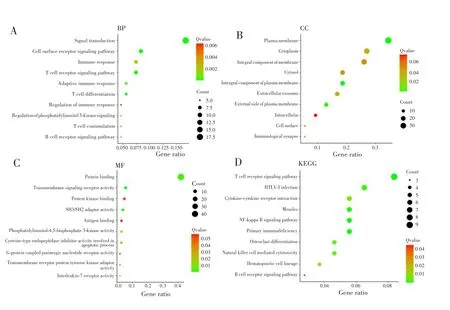
图3 LINC01215潜在基因靶点的GO注释和KEGG分析Fig.3 GO categories and KEGG pathways of potential gene targets of LINC01215
2.5 LINC01215表达与CRC免疫浸润水平的关系
基于富集分析结果,利用ssGSEA方法评估TCGA数据库CRC组织标本中免疫细胞的浸润水平,并分析其与LINC01215表达的相关性,结果显示,LINC01215表达与CD56dim NK细胞的浸润水平呈负相关(r=-0.165,P<0.001),与B细胞、CD4+T细胞、CD8+T细胞等免疫细胞的浸润水平呈正相关。见图4。
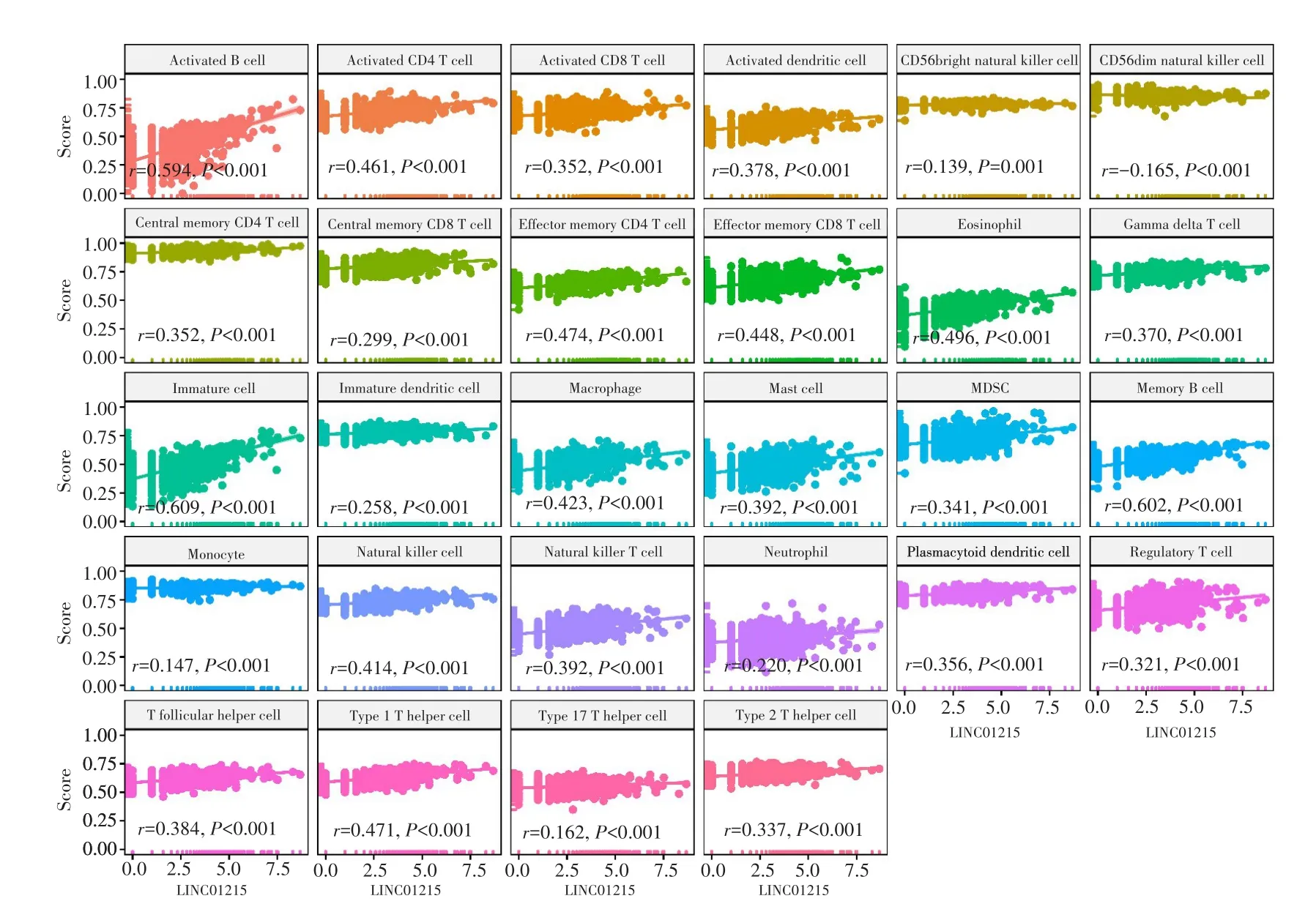
图4 TCGA数据的ssGSEA评分结果Fig.4 Result of ssGSEA scoring of TCGA database
2.6 药物敏感性预测
Spearman分析结果显示,LINC01215表达与Chelerythrine、Sapacitabine、Fenretinide、Hydroxyurea这4种药物的敏感性呈正相关(均P<0.05),见图5。
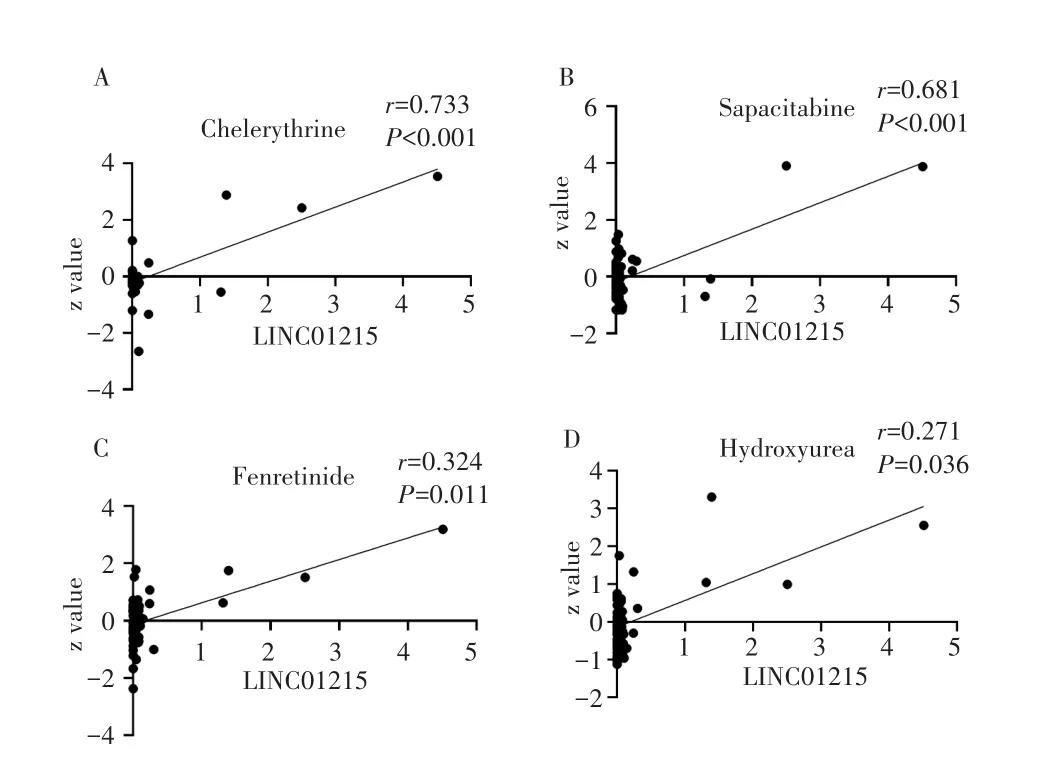
图5 LINC01215与药物的敏感性预测Fig.5 Prediction of susceptibility between LINC01215 and drugs
3 讨论
越来越多的证据表明,lncRNA表达失调与肿瘤的发生、进展和预后不良有关,在癌症的诊断、靶向治疗及预后评估等方面均具有潜在的应用价值[9]。LINC01215是位于3号染色体3q13.12区的lncRNA,长度为2 609 bp,其上下游基因为CD47和ITF57。目前已有研究表明LINC01215表达异常与恶性肿瘤发生发展密切相关,如LINC01215低表达预示乳腺癌预后不良[6];在上皮性卵巢癌中沉默LINC01215可促进RUNX3的表达,从而抑制癌细胞增殖、迁移和侵袭及淋巴结转移[7]。本研究通过TCGA数据库分析发现,LINC01215在CRC组织中的表达低于癌旁正常组织,临床样本检测结果也进一步证实LINC01215在CRC组织中低表达,且其表达水平与CRC病理分化程度有关。基于TCGA数据库的生存分析还发现,LINC01215高表达患者的中位OS明显优于LINC01215低表达者,多因素Cox回归分析也显示,LINC01215低表达为CRC预后不良的独立危险因素。以上研究结果说明LINC01215在CRC中低表达,且可能参与促进CRC的发生发展。
肿瘤进展不仅受癌细胞固有的遗传变化和环境因素影响,人体内环境的变化也会影响肿瘤的发生发展[3]。为了进一步探索LINC01215在CRC中的作用机制,本研究对LINC01215靶基因进行富集分析,结果发现LINC01215在CRC中主要通过参与T细胞受体信号通路发挥作用,ssGSEA结果也表明LINC01215表达与CD56dim NK细胞的渗透水平呈负相关,与T细胞等呈正相关,提示LINC01215与免疫淋巴细胞的渗透和免疫微环境的改变有关。已有研究表明,CD56dim NK细胞在CRC中能通过减少颗粒酶和穿孔素释放等方式,导致肿瘤细胞免疫逃逸[10]。T细胞等能通过释放不同的细胞因子诱导肿瘤细胞凋亡,并抑制肿瘤细胞生长[11]。此外,还有研究表明,LINC01215与CD40LG和RASGRP1共表达,且参与了T细胞受体信号传导途径[12]。CD40可通过刺激肿瘤血管中的白细胞黏附并增强T淋巴细胞和NK细胞向肿瘤迁移,从而抑制肿瘤的形成[13]。而RasGRP1是结肠上皮中的肿瘤抑制基因之一,也是EGFR信号通路的标志物[14]。由此推测LINC01215可能通过T细胞受体信号通路等信号传导途径调节CRC微环境中的免疫渗透,从而导致肿瘤免疫逃逸并诱导细胞死亡,进而促进CRC发生发展。同时,本研究通过药物敏感性分析筛选出了Chelerythrine、Sapacitabine、Hydroxyurea、Fenretinide等4种药物与LINC01215表达相关。既往研究[15-20]已证实这些药物均具有抗肿瘤效应,其中Hydroxyurea能有效抑制肿瘤细胞的增殖和中性粒细胞的分化,并刺激效应T细胞反应,可作为辅助治疗药物应用于CRC临床治疗;而Chelerythrine作为蛋白激酶C抑制剂也可通过磷脂酶C蛋白激酶C通路对T淋巴细胞功能和细胞因子进行调节。提示Chelerythrine、Hydroxyurea可能参与T细胞受体信号通路发挥细胞免疫效应,因此靶向LINC01215以及T细胞受体信号通路可能在CRC药物开发中具有一定潜力。
综上所述,LINC01215在CRC组织中低表达且与预后不良相关,可能是CRC预后预测指标及潜在的治疗靶点。生物信息学分析结果初步显示LINC01215可能通过T细胞受体等信号通路而在CRC中发挥作用。但本研究纳入的临床样本量较小,今后还需扩大样本量并开展更加系统的体内外实验,进一步深入探索LINC01215在CRC中的作用及其作用机制。

