一种新型纤维素基吸附剂的制备及其对漆酶的固定化性能研究
吕静思鲁 鹏肖兴晓彭传博李 娜,,平清伟,
(1.大连工业大学轻工与化学工程学院,辽宁大连,116034;2.广西大学轻工与食品工程学院,广西清洁化制浆造纸与污染控制重点实验室,广西南宁,530004)
漆酶[1]作为一种含有4个铜离子的多酚类单电子氧化酶,可作用的底物非常广泛[2]。漆酶具有特征性吸收光谱,在有氧条件下,可通过铜离子在氧化反应中协同传递电子的作用氧化酚类和芳香类化合物,从而实现废水中木质素[3]及氯代酚[4]、多氯联酚[5]、二氯苯胺[6]等多种酚类化合物的降解。氧化酚类和芳香类化合物由于具有长期残留性及毒性,已经被列为持久性有机污染物(POPs)的范畴。游离漆酶具有价格昂贵且不可重复利用的缺点,限制了其在废水处理领域的应用[7]。而相比于游离漆酶,虽然固定化漆酶活性有一定的损失,但能够提高酶的稳定性和重复使用性[8],是很有前途的一种漆酶使用方法。因此,开发绿色的、固定漆酶的吸附剂,并提高固定化漆酶活性,对促进漆酶在废水处理的工业化应用具有重要意义[9-10]。
纤维素是由多个D-吡喃葡萄糖酐(AGU)以β-(1-4)苷键连接而成的线形聚合物,是自然界中广泛存在的可再生天然聚合物之一,以纤维素作为漆酶的载体具有价格便宜、可生物降解的特点[11]。此外纤维素的多孔结构以及其含有的大量羟基(可通过氧化反应、接枝共聚反应等[12]改性手段在羟基位置上引入各种基团),使其在作为酶的载体时具备高吸附性优势[13],且以纤维素为原料制备球形载体固定漆酶,还具有便于后续分离以实现多次循环利用的环境友好价值[14-15]。
本课题利用绿色材料纤维素,通过再生并改性的方法制备了一种新型吸附剂,并用于固定漆酶。此外,探索了固定化条件对漆酶固定化率和固定化漆酶活性以及相关性质的影响。研究对拓展纤维素的应用领域及促进漆酶在废水处理的工业化应用进展方面具有一定的实用价值。
1 实验
1.1 实验材料
滤纸(新星,杭州特种纸业有限公司),尿素、氢氧化钠(NaOH)、盐酸(HCl)、磷酸氢二钠、醋酸和磷酸均购于天津科密欧化学试剂有限公司,硝酸铈铵、丙烯酰胺(AM)购于上海麦克林生化有限公司,柠檬酸购于国药化学试剂有限公司,牛血清蛋白(BSA)购于上海天朗科技有限公司,双酚A购于上海阿拉丁生化科技有限公司,纳米碳酸钙(CaCO3)、漆酶和2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)(ABTS)均购于Sigma(中国)Chemical。
1.2 实验方法
1.2.1 改性纤维素小球的制备
在-10℃的条件下,将2 g滤纸溶解于NaOH(7 wt%)/尿素(12 wt%)水溶液中,配制成4%的纤维素溶液[16]。然后加入0.4 g纳米碳酸钙,混合均匀。用一次性注射器将混合物滴入1 mol/L盐酸溶液中,制备成球形纤维素吸附剂。吸附剂中的CaCO3与HCl反应产生CO2并逸出,使吸附剂内部形成多孔结构。随后滤出纤维素小球,在蒸馏水中浸泡12 h,除去反应过程中产生的CaCl2,再将其转移至浓度为10%~20%的乙醇溶液中浸泡6 h,之后冷冻干燥备用。
在三颈烧瓶中加入质量比为6∶5的AM和纤维素小球及浓度为0.06%的硝酸铈铵(CAN)引发剂,通入氮气,60℃下反应6 h[17-18]。反应后,利用乙酸/乙二醇混合液抽提产物,以去除残留药品及反应中产生的聚丙烯酰胺。在此步骤中,丙烯酰胺与纤维素小球上的羟基接枝,形成带有酰胺基团的3个碳的支链结构。之后将接枝后的小球在碱性条件下水解,酰胺基被水解为羧基;反应过程如图1所示。
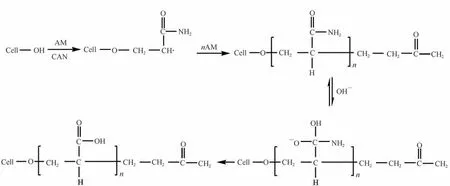
图1 改性纤维素小球的制备Fig.1 Preparation of modified cellulose microspheres
1.2.2 漆酶活性的测定
采用ABTS法[19]测定游离漆酶和固定化漆酶的酶活。分别将0.5 mL游离漆酶、固定化漆酶加入含有0.2 mL ABTS溶液和2.3 mL(游离漆酶)/2.8 mL(固定化漆酶)磷酸盐缓冲溶液(pH值=5.0)的混合溶液中,在420 nm处测定混合溶液的吸光度,每30 s记录1次数据。游离漆酶酶活和固定化漆酶酶活的计算分别如式(1)和式(2)所示。

式中,∆A为t时间内混合溶液在420 nm处吸光度的增加值;V总为混合溶液总体积,mL;V酶为反应体系中加入的游离漆酶的体积,mL;ε(L/(mol·cm))=36.000,是420 nm处氧化态ABTS的摩尔吸光系数[20];M表示每份纤维素小球负载漆酶的质量,g。
1.2.3 漆酶的固定化
漆酶的固定化过程如图2所示。在一定条件(见图2)下,将纤维素小球置于漆酶溶液中并进行磁力搅拌。固定化后,用pH值=5.0的0.1 mol/L磷酸盐缓冲溶液洗涤3次,得到的纤维素-漆酶小球(即固定化漆酶)用于后续实验。

图2 漆酶的固定化Fig.2 Immobilization of laccase
1.2.4 漆酶负载量的测定
利用考马斯亮蓝法测定纤维素小球上漆酶的负载量[21]。利用UH5300型紫外分光光度计(日本日立株式会社),在特征波长为595 nm的条件下测量漆酶与考马斯亮蓝结合物的吸光度,根据BSA做出的标准曲线计算漆酶浓度,漆酶负载量的计算如式(3)所示。

漆酶固定化率的计算如式(4)所示。

式中,Q为漆酶负载量,表示每克纤维素小球负载漆酶的量,mg/g;C1为固定化前溶液中漆酶浓度,g/L;C2为固定化后溶液中漆酶浓度,g/L;V为溶液的总体积,mL;W表示固定化体系中纤维素小球的质量,mg。
1.2.5 漆酶动力学常数
米氏常数Km是酶极为重要的动力学参数,表示酶促反应达到最大速度(Vmax)一半时底物的浓度(S)。反应速度和底物浓度之间的关系用Michaelis-Menten公式表示(见式(5))。

式中,以漆酶与底物反应初速度的倒数1/V为y轴(计算时以1/A表示1/V),底物浓度的倒数1/S为x轴作Lineweaver-Burk双倒数曲线图,计算出游离漆酶和固定化漆酶的Km值。
1.2.6 元素分析
元素分析法是依据杜马定氮法测定氮元素含量的方法,具有操作简便、样品用量少、准确度比凯式定氮法高的优点[22]。利用元素分析法测定接枝后纤维素小球吸附剂的氮元素含量,由此确定接枝丙烯酰胺的最佳条件。称取2~3 mg改性纤维素小球,用锡舟包好并压实,放入元素分析仪(ario MICRO cube V,德国Elementar公司)进行测试,每个样品平行测2组。
1.2.7 红外光谱分析与羧基含量的测定
利用傅里叶变换红外光谱仪(FT-IR,Frontier型,美国PerkinElmer公司)对改性纤维素小球进行红外光谱分析,通过分析改性前后纤维素小球官能团的变化来检测改性是否成功。提前在120℃烘箱中烘干样品和溴化钾24 h以上,按照样品∶溴化钾=1∶100的质量比制样,压片后快速放入红外分析仪中进行检测。
利用酸碱滴定法测定纤维素小球改性前后增加的羧基含量。称取相同质量改性前后的纤维素小球,分别在30℃的条件下与过量的0.5 mol/L NaOH溶液反应0.5 h,然后用0.5 mol/L的HCl溶液滴定剩余碱液到终点[23];平行检测3次取平均值。羧基含量(X,mmol/g)计算如式(7)所示。

式中,C为HCl的浓度,mol/L;V0为未改性纤维素小球消耗的HCl溶液体积,mL;V为改性纤维素小球消耗的HCl溶液体积,mL;W为纤维素小球的质量,g。
1.2.8 X射线衍射分析
利用X射线在晶体物质中的衍射效应,对改性前后纤维素小球的晶体变化进行分析。取少量干燥样品铺满模具,放置于X射线衍射仪(XRD,XRD-6100,日本株式会社岛津制作所)中开始测试。通过测定衍射角位置和谱线的积分强度对化合物进行定性及定量分析。衍射X射线满足如下布拉格方程。

式中,λ为X射线的波长;θ是衍射角;d是结晶面间隔;n是整数。
1.2.9 比表面积与扫描电子显微镜分析
称取0.1~0.12 g干燥样品置于BET测试管中,利用BET比表面分析仪(ASAP-2020,麦克默瑞提克(上海)仪器有限公司)进行测试。利用测试得到的数据对纤维素小球的孔径和比表面积进行分析。
将改性前后的干燥纤维素小球固定在扫描电子显微镜样品台,在其表面喷满金箔,抽真空完成后利用扫描电子显微镜(SEM,S-3400N,日本日立公司)对样品表面进行扫描。
2 结果与讨论
2.1 纤维素小球的改性
2.1.1 最佳改性条件
通过4因素3水平正交实验确定纤维素小球的最佳改性条件,以改性后纤维素小球的氮元素含量为指标进一步确定最佳改性条件,实验结果如表1所示。由表1可知,第9组的氮元素含量最高,第1组的氮元素含量最低,说明升高温度可以促进改性反应。对比极差Rj发现,实验条件的影响顺序是:温度>单体配比>时间>引发剂浓度。由实验结果确定的最佳改性条件为:时间6 h、温度50℃、单体配比8∶5(质量比)、引发剂浓度0.08%。
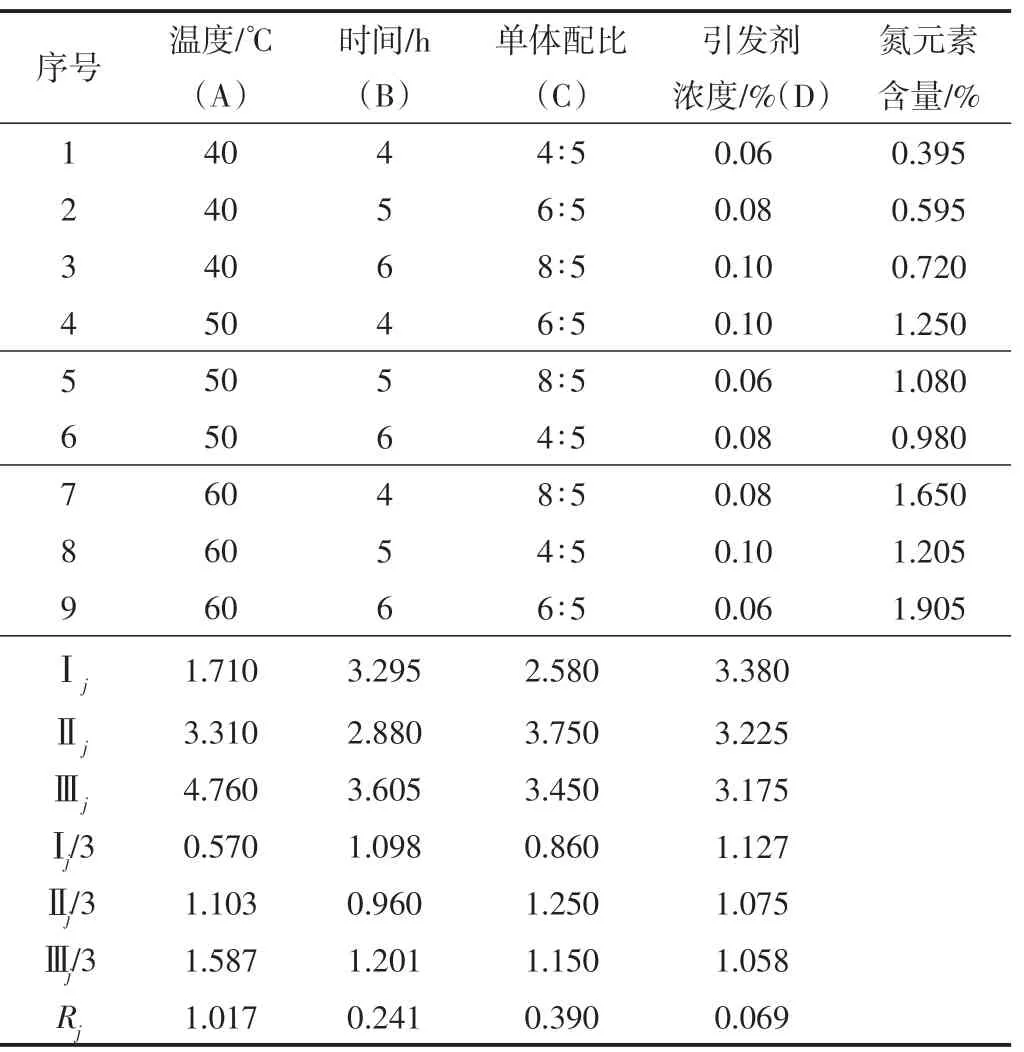
表1 正交实验结果表Table 1 Orthogonal experimental results
2.1.2 FT-IR光谱分析
图3是改性前后纤维素小球的FT-IR谱图。由图3可知,纤维素分子骨架结构未发生明显的改变,基本保持了纤维素的结构。在1589和1418 cm-1处的吸收峰是典型的酰胺基特征吸收峰,1634 cm-1处的吸收峰是—C==C的振动吸收峰,1685 cm-1附近的吸收峰是羧基与酰胺基—C==O的特征吸收峰。2900 cm-1附近的吸收峰为—CH2的振动吸收峰。通过对FT-IR谱图的分析可知,改性后产物是纤维素和丙烯酰胺的接枝共聚物和部分水解物[24]。由图3可知,3000~3500 cm-1范围内—OH的特征峰在改性后峰型变宽且强度减弱,可能是由于接枝支链上的羧基负离子与纤维素分子链上的氢原子形成氢键,说明接枝反应发生在纤维素的羟基上[25]。
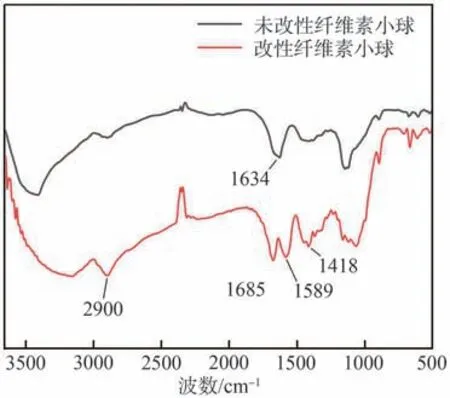
图3 改性前后纤维素小球的FT-IR谱图Fig.3 FT-IR spectra of cellulose microspheres before and after modification
根据式(7)计算得到改性纤维素小球增加的羧基含量为2.25 mmol/g,结合FT-IR谱图可以证明改性成功。
2.1.3 XRD分析
通过对比改性前后纤维素小球的XRD谱图(见图4)可知,在2θ=12.36°和20.36°处的衍射峰分别是纤维素无定形区和结晶区的特征衍射峰。改性纤维素小球的吸收峰强度较大,说明改性纤维素小球的结晶区和无定形区都有所减少;原有结构被破坏导致改性纤维素小球的结晶度降低。以X射线结晶度指数表示样品的结晶度,其计算如式(9)所示。

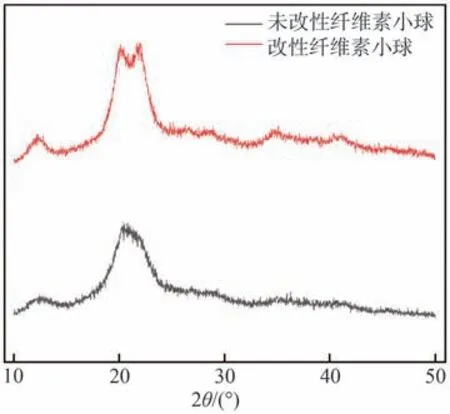
图4 改性前后纤维素小球的XRD谱图Fig.4 XRD spectra of cellulose microspheres before and after modification
式中,I20.36°是2θ=20.36°衍射峰的强度(结晶区),I12.36°是2θ=12.36°衍射峰的强度(非结晶区)。计算得到改性纤维素小球的结晶度指数为0.74,未改性纤维素小球的结晶度指数为0.81,说明改性过程中纤维素的结晶区发生了破坏,可能是由于在结晶区成功接枝了丙烯酰胺链所致[26]。
2.1.4 BET数据分析
根据BET比表面积测试法,测得改性前后纤维素小球的比表面积及孔径,结果如表2所示。国际纯粹与应用化学联合会(IUPAC)将孔径在2~50 nm范围内的多孔材料定义为介孔材料,孔径小于2 nm的定义为微孔材料。微孔材料的吸附性能稳定,而介孔材料达到吸附平衡的时间短[27]。由表2可知,接枝改性前后纤维素小球的比表面积变化较小;但孔径变化较大,改性纤维素小球的孔径处于介孔范围内且接近微孔,说明接枝改性可提高纤维素小球的吸附性能,进而提高纤维素小球对漆酶的负载率。

表2 纤维素小球BET测试结果Table 2 BET test results of cellulose microspheres
2.1.5 SEM分析
图5是改性前后纤维素小球的SEM图。从图5可以看出,改性前后纤维素小球的表面形貌发生明显变化。未改性纤维素小球表面呈鳞片形的孔状结构,而改性纤维素小球孔隙表面有微小柱状结构;对比未改性纤维素小球,改性纤维素小球的空心结构和通道增多。制备纤维素小球过程中添加了纳米碳酸钙,其在HCl溶液中反应生成CO2,促进了纤维素小球中空心结构和通道的形成。结合BET数据可知,改性纤维素小球更有利于吸附漆酶。

图5 改性前后纤维素小球的SEM图Fig.5 SEM images of cellulose microspheres before(a)and after(b)modification
2.2 漆酶的固定化
2.2.1 固定化时间
探究固定化时间(0.5、1、2、3、4、5 h)对漆酶固定化率的影响,结果如图6所示。从图6可以看出,0.5~3 h内,漆酶的固定化率迅速提高,3~5 h内,漆酶固定化率的增速变缓。在固定化初期,纤维素小球结构中的固定化位点较多,因此漆酶迅速“占据”纤维素小球中的空隙和通道,固定化率迅速提高;而随着时间的进一步延长(3~5 h),纤维素小球的大部分固定化位点被“占据”,漆酶的固定化率提高趋势趋于平缓。综上,确定最佳固定化时间为3 h[28]。
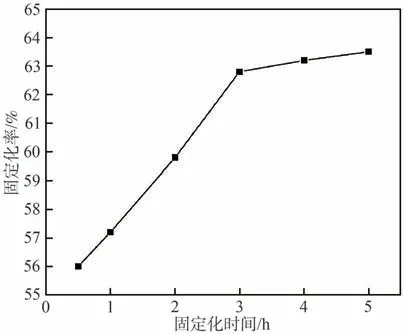
图6 固定化时间对漆酶固定化率的影响Fig.6 Effect of time on the immobilization rate of laccase
2.2.2 固定化pH值
为确定固定化漆酶的最佳pH值,配制5种不同pH值(4.0、4.5、5.0、5.5、6.0)的磷酸盐缓冲溶液[28],在最佳固定化时间3 h的条件下负载漆酶,以酶活最高者为100%作为基准以确定各pH值条件下漆酶相对酶活的变化趋势。在固定化过程中,磷酸盐缓冲溶液的pH值影响纤维素小球与酶的结合程度,且漆酶与纤维素小球间存在静电作用,纤维素小球所带电荷和漆酶所带电荷受溶液酸碱性的影响。此外,漆酶的蛋白质在一定pH值范围内会失活,因此固定化漆酶(与纤维素小球作用后)在不同pH值下的酶活不同。由图7可知,当磷酸盐缓冲液的pH值=5.0时,固定化漆酶的相对酶活最高[29]。
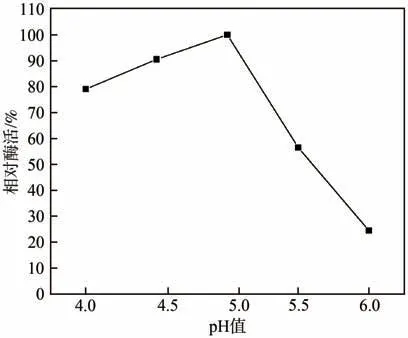
图7 pH值对固定化漆酶相对酶活的影响Fig.7 Effect of pH value on relative enzyme activity of the immobilized laccase
2.2.3 初始酶浓度
控制固定化条件为pH值=5.0、固定化时间3 h,配制5种不同初始浓度(1、5、10、15、20 g/L)的酶溶液进行漆酶固定化,根据固定化率确定最佳初始酶浓度,结果如图8所示。由图8可知,固定化率随着初始酶浓度的增加快速提高,当初始酶浓度>10 g/L,漆酶的固定化率增速变缓,说明高初始酶浓度对漆酶与纤维素小球的反应有促进作用,因为初始酶浓度较高时,漆酶可覆盖纤维素小球的整个表面,甚至可能会诱导多层吸附[30]。
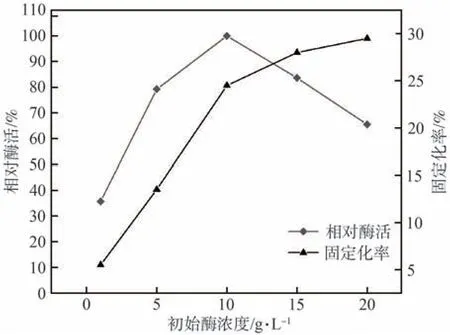
图8 初始酶浓度对漆酶固定化的影响Fig.8 Effect of initial laccase concentration on the immobilization of laccase
此外,固定化漆酶的相对酶活随初始酶浓度的增加而提高,在10 g/L时达到最大值,但随着初始酶浓度的进一步增加而急剧下降。在初始酶浓度为10 g/L时,固定化漆酶分子可能覆盖了整个纤维素小球表面。但随着溶液中酶浓度的进一步增加,富余的漆酶被负载在其他漆酶上,形成多层吸附。在这种情况下,虽然纤维素小球上负载的漆酶较多,但第一层的活性位点被第二层所覆盖,导致漆酶相对酶活降低[31]。综上,最佳初始酶浓度为10 g/L。
2.3 热稳定性
酶分子三级结构的改变是引起漆酶变性的原因之一,利用纤维素小球吸附漆酶此种固定化方法可增强漆酶分子的刚性,从而提高其热稳定性。在不同温度下分别对固定化漆酶和游离漆酶保温2 h,以最高酶活者为100%作为基准以计算其他温度下的相对酶活,结果如图9所示。由图9可知,游离漆酶和固定化漆酶的最适温度分别是40℃和50℃,在最适温度下,二者的相对酶活均为100%;游离漆酶的相对酶活在温度>40℃时急剧下降,而固定化漆酶的相对酶活在温度>50℃时的下降速度则相对较缓慢;70℃时,游离漆酶和固定化漆酶的相对酶活分别为38%和55%。因此可知,固定化漆酶的热稳定性远优于游离漆酶,固定化作用使漆酶分子刚性增强,结构不易被破坏,因而热稳定性更好[32]。

图9 游离漆酶和固定化漆酶的热稳定性Fig.9 Thermal stabilities of free and immobilized laccase
2.4 固定化漆酶可重复使用性
纤维素基吸附剂是一种新型的漆酶固定化载体,从节约成本考虑,固定化漆酶与游离漆酶相比具有可重复使用的优点。因此对最佳固定化条件下(固定化时间3 h、pH值=5.0、初始酶浓度10 g/L)得到的固定化漆酶进行了循环使用性能的研究,通过测定每次循环使用后固定化漆酶的相对酶活以评价其可重复使用性,结果如图10所示。由图10可知,循环使用固定化漆酶6次,其相对酶活迅速降低,在第7次使用固定化漆酶后,其相对酶活下降趋势变缓并在第9次使用后趋于稳定,完成10次循环使用后,固定化漆酶的相对酶活仍可保持在初始酶活的60%左右。因此可知,固定化漆酶具备一定的可重复使用性能,可被重复利用,具有绿色可再生资源的优点及广阔的发展前景[33]。

图10 固定化漆酶的可重复使用性Fig.10 Reusability of immobilized laccase
2.5 漆酶动力学常数
将底物ABTS配制成不同浓度的溶液,并分别添加游离漆酶和固定化漆酶与底物反应,测定其吸光度值。以吸光度值的倒数1/A代替反应速度的倒数1/V,与底物ABTS浓度的倒数1/S进行线性拟合,即可代入式(6)计算二者的Km值,结果如图11所示。由图11可知,游离漆酶的Km值为0.42 mmol/L,固定化漆酶的Km值为0.50 mmol/L,表明固定化漆酶与底物反应的亲和作用低于游离漆酶。这是因为,游离漆酶能够与底物充分接触,而被固定化的漆酶分布在纤维素小球表面及内部,需要一定时间才能与底物充分反应[34]。此外,固定化漆酶自由度变小,因此,其与底物反应亲和力下降[35]。
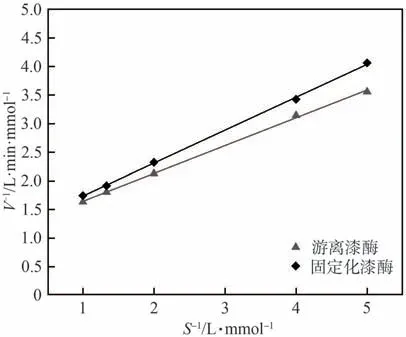
图11 漆酶的Lineweaver-Burk双倒数曲线图Fig.11 Lineweaver-Burk plots of free and immobilized laccase
2.6 改性前后纤维素小球对固定化漆酶酶活的影响
对改性前后的纤维素小球固定化漆酶的酶活进行了比较研究,结果如表3所示。由表3可知,未改性纤维素小球固定化漆酶的酶活为27.28 U/g,改性纤维素小球固定化漆酶的酶活为41.50 U/g,较前者提高了52%。改性纤维素小球固定漆酶时,漆酶固定于纤维素支链结构末端,而未改性纤维素小球固定漆酶时,漆酶只能固定在纤维素表面;相比之下,在支链结构末端的漆酶自由度相对较大,因此其酶活较高。因此,笔者认为对纤维素进行改性时,接入长链对增加固定化漆酶的自由度、提高漆酶酶活具有积极作用。

表3 改性前后纤维素小球固定化漆酶酶活Table 3 Enzyme activity of laccase immobilized by original and modified celloluse microsphere
3 结论
本研究以可再生的天然聚合物——纤维素为原料,通过接枝改性成功制备了一种多孔的新型纤维素基吸附剂(纤维素小球),并将其用于漆酶的固定化。该吸附剂在提高固定化漆酶酶活方面表现出良好性能,固定化漆酶表现出优良的重复使用性能和热稳定性。纤维素小球作为绿色基质材料,可以作为固定化漆酶的合适载体,具有良好的发展前景。后续工作中将进一步研究固定化漆酶对造纸漂白废水中的难处理酚类化合物(如氯代酚、多氯联酚等)的降解效果。

