基于荧光探针的单细胞一氧化氮分析研究进展
姚惠文, 郭小峰, 王 红*
(1.武汉大学化学与分子科学学院,湖北武汉 430072; 2.湖北中医药大学药学院,湖北武汉 430065)
1 引言
细胞是参与有机体生命活动的基本单元,看似相同的细胞会由于内部基因、蛋白质、代谢物等生物物质的表达不同而呈现出生物化学异质性[1,2]。细胞异质性与身体的异常变化密切相关,如癌症、心血管疾病、神经退行性病变等[3,4]。单细胞分析能揭示细胞之间在组成、代谢、结构、功能等方面的差异,对疾病的早期诊断和生理病理过程的机制探究具有重要意义[5]。作为生物体内重要的气体信号分子,NO广泛参与生物体的神经传递、免疫应答、血管舒张等各种生理病理活动[6,7]。因此,建立高效、灵敏的单细胞NO分析方法对探究NO的生理作用机制十分重要。
单细胞内NO含量很低,通常在fmol~zmol数量级,且NO反应活性高、半衰期短,进一步增加了单细胞NO分析的难度。目前,荧光成像[8,9]、毛细管电泳[10 - 12]、微流控芯片电泳[13]、电化学[14,15]等方法已用于单细胞NO分析。其中,基于荧光探针的荧光分析法具有灵敏度高、选择性好、操作方便等优点,NO荧光探针与荧光显微镜结合,可以实现单细胞内NO的可视化观察,提供NO的时空分布信息;与毛细管电泳或微流控芯片电泳结合,可以实现单细胞内痕量NO的定量检测。本文重点介绍NO荧光探针设计开发的最新进展及其在单细胞NO分析中的应用研究。
2 荧光成像法
荧光成像法具有可视化强、空间分辨率高、操作简便等优点,易于实现NO的原位实时观察。与荧光显微镜相结合用于细胞NO成像分析的荧光探针比较多,目前是NO分析研究的热点,主要包括邻苯二胺类荧光探针[16,17]、芳香仲胺类荧光探针[18]、金属配合物类荧光探针[19 - 21]和其它类荧光探针[22 - 24]。在此,我们主要对近5年来开发的用于NO成像的小分子荧光探针进行综述。
2.1 邻苯二胺类荧光探针
邻苯二胺具有强的供电子能力,与荧光团连接时,由于光诱导电子转移效应(PET)使荧光团的荧光猝灭。当邻苯二胺与NO在有氧条件下反应生成三氮唑后,PET过程受阻,荧光团的荧光恢复,如图1所示。邻苯二胺类荧光探针能够快速捕获NO,对NO具有高度选择性和灵敏度。

图1 邻苯二胺类NO荧光探针的识别机理及代表性探针的结构[25 - 29]Fig.1 Sensing mechanism of o -phenylenediamine-based fluorescent probe 1 and the structure of representative examples[25 - 29]
2016年,我们课题组[25]将具有细胞膜定位性的长链烷基和水溶性的磺酸根基团同时引入BODIPY荧光团,设计并合成了以邻苯二胺为识别基团的两亲性NO荧光探针1,该探针聚集在细胞膜外表面,实现了细胞释放到胞外NO的成像分析。同年,Liu课题组[26]以邻苯二胺为识别基团合成了远红外激发(820 nm)、近红外发射(650 nm)的双光子NO荧光探针2,该探针与NO反应迅速,灵敏度高,在细胞和组织(170 μm深度)成像中均有良好的分辨率。2017年,Tang等[27]设计并合成了一系列以罗丹明为母体,以邻苯二胺为识别基团的近红外荧光探针3和4,发现以硅原子取代罗丹明中的氧原子,可以使荧光发射从610 nm红移至710 nm,并可以定位检测细胞线粒体中内源及外源性NO。同年,Guo课题组[28]也报道了以硅-罗丹明脱氧内酰胺为母体以邻苯二胺为识别基团的近红外荧光探针5,与NO反应快速,反应后其荧光增强6 300倍,检出限达0.12 nmol/L,可用于各种细胞及小鼠模型的NO分析。2020年,Zhou等[29]以哒嗪酮为母体,以邻苯二胺为识别基团,合成了NO荧光探针6,细胞中的荧光共定位成像显示该探针主要分布在细胞溶酶体中,已用于心肌纤维化模型动物的组织及活体中NO的成像分析。
2.2 芳香仲胺类荧光探针
NO的亚硝胺检测机理主要是通过对芳香仲胺的硝化形成稳定的亚硝化化合物。通常,这类探针由于PET的作用,荧光较弱,与NO反应后,PET过程受阻,荧光恢复,如图2所示。
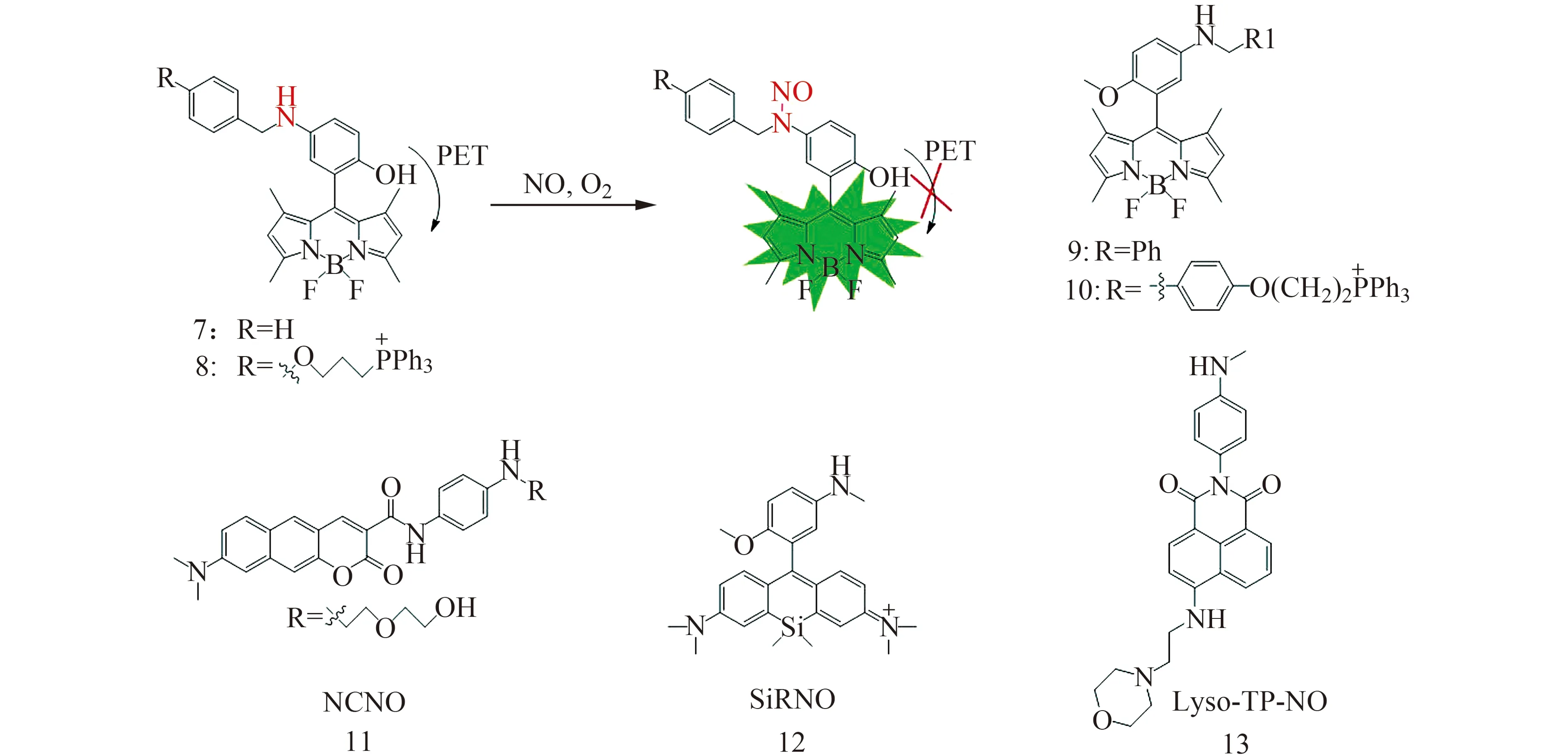
图2 芳香仲胺类NO荧光探针的识别机理及代表性探针的结构[30 - 34]Fig.2 Sensing mechanism of N -nitrosation of aromatic secondary amine-based fluorescent probe 7 and the structure of representative examples[30 - 34]
2016年,Guo课题组[30]利用芳香仲胺与NO在有氧条件下发生N亚硝化作用,以BODIPY为荧光团合成了探针7和8,探针对NO响应快速,灵敏度高,不受活性氧(ROS)、抗坏血酸(AA)、脱氢抗坏血酸(DHA)、丙酮醛(MGO)的干扰。不带定位基团的探针7能用于细胞内NO的成像,带线粒体定位基团TPP的探针8能用于细胞线粒体中NO的成像观察。2019年,该课题组[31]又报道了基于芳香仲胺与NO作用的另外两个探针9和10,比原有探针具有更高的灵敏度,还可区分M1巨噬细胞和M2巨噬细胞,在NO调控的肿瘤免疫疗法和抗肿瘤药物的筛选中具有较大的应用前景。
2017年,Liu课题组先后以苯并香豆素衍生物和硅-罗丹明衍生物为荧光团,结合芳香仲胺识别基团设计并合成了近红外双光子NO荧光探针11[32]和12[33],实现了细胞和动物组织中NO的原位实时成像。2020年,该课题组[34]将溶酶体定位基团引入以萘二甲酰亚胺为荧光团、以N-甲基苯胺为识别基团的探针结构中,合成了双光子溶酶体定位的NO荧光探针13,用于炎症引发的细胞内源性NO的成像分析。
2.3 金属配合物类荧光探针
基于金属配合物的NO荧光探针通常将荧光团作为配体与顺磁性金属离子配位,引起荧光团荧光猝灭,与NO反应后,金属离子被释放或还原,荧光恢复。Juarez等[35]报道了基于BODIPY的Cu(Ⅱ)二吡啶配合物14,在空气中与NO反应,不受NO2、CO2、H2S、SO2等气体分子的干扰。探针与NO反应后,荧光量子产率从0.071增至0.570,细胞毒性很小,已用于RAW 264.7细胞中NO的成像分析(如图3所示)。

图3 基于BODIPY的铜-联吡啶配合物14的识别机理[35]Fig.3 Sensing mechanism of BODIPY-containing Cu(Ⅱ)-bipyridine complex 14[35]
2.4 其它类荧光探针
2018年,Chen等[36]利用NO与单取代联苯作用生成二唑衍生物的识别机理设计并合成了比率型NO荧光探针15,对NO具有高选择性,不受活性氮氧化合物及生物组分的干扰,成功用于巨噬细胞中内源和外源性NO的成像,如图4所示。
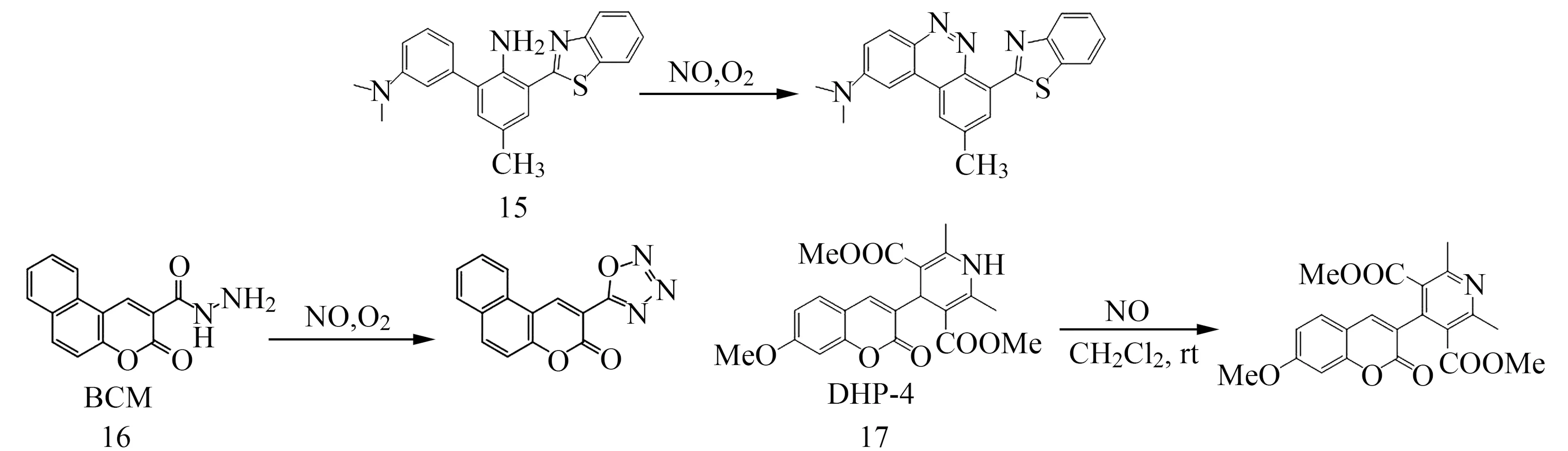
图4 其它类NO荧光探针的识别机理[36 - 38]Fig.4 Sensing mechanism of other fluorescent probes with NO[36 - 38]
2020年,Maiti等[37]报道了以苯并香豆素为荧光团、以酰基酰肼为识别基团的NO荧光探针16,与NO作用后生成恶三唑,使荧光增强123倍,检测限为16 nmol/L,该探针具有良好的生物相容性和透膜性,适用于细胞NO的成像分析。2020年,Ma等[38]利用汉斯酯与NO作用生成相应吡啶衍生物的识别机理构建了基于二氢吡啶-香豆素的NO荧光探针17,该探针在pH=3~10范围对NO具有高选择性、高灵敏度的响应,细胞毒性小,已用于RAW264.7细胞内源性NO的成像分析。
3 毛细管电泳法
毛细管电泳(Capillary Electrophoresis,CE)是一种以毛细管为分离通道,以高压直流电场为驱动力的分离技术,具有分离效率更高、分析速度更快、进样量少(nL级)等特点,与激光诱导荧光(Laser Induced Fluorescence,LIF)检测相结合,可以达到极高的检测灵敏度。由于毛细管内径(10~100 μm)与细胞尺寸较为匹配,成为单细胞中NO定量分析的主要方法。目前,与CE-LIF结合用于单细胞NO检测的荧光探针主要是二氨基荧光素类和二氨基BODIPY类小分子荧光探针,如图5所示。

图5 与CE-LIF结合用于单细胞NO分析的荧光探针的结构Fig.5 The structure of fluorescent probes used for single-cell NO analysis coupled with CE-LIF
2006年,Sweedler课题组[10]以DAF-2为NO衍生试剂,利用抗坏血酸氧化酶(AO)将AA氧化为DHA,再经CE-LIF实现DAF-2T与DAF-2-DHAs的分离检测,从而避免AA和DHA对NO检测的干扰,该方法简单、有效,不仅能用于组织匀浆中NO的检测,还可用于单个神经元细胞中NO的测定。2008年,Yang等[39]以DAMBO -PH为荧光探针来捕获NO,通过CE-LIF实现了单细胞内NO的高效灵敏分析。探针与NO的衍生产物DAMBO -PH-T在pH=3~13范围内,荧光强度基本不受影响,经CE-LIF分析检测,在3 min内实现分离,检测限为42 amol,已用于单个椎实螺神经细胞、PC12细胞、ECV-304细胞和MDCK细胞中NO的检测。
2015年,我们课题组[40]合成了水溶性NO荧光探针TMDSDAB,与NO反应后,荧光增强540倍。以TMDSDAB为柱上衍生试剂,建立了基于CE-LIF的单细胞NO分析方法,检测限达2.2 amol,并成功测定了同一个单细胞释放到胞外的NO及胞内残留的NO。最近,我们课题组[41]利用双标记策略,将脂溶性NO荧光探针DAMBO和两亲性NO荧光探针DSDMHDAB结合,建立了单细胞内外NO释放的同时分析方法,细胞内外NO的检测限分别为2.4 amol和8.1 amol,并通过在线衍生的方式实现了单个鼠源巨噬细胞内外NO的同时测定。
4 微流控芯片电泳法
微流控芯片电泳(Microchip Electrophoresis,MCE)是近年来基于微流控芯片系统发展起来的分离分析技术。以微流控芯片替代传统的毛细管作为分离通道,可进一步降低样品消耗量、提高分析速度,同时微流控芯片系统可根据实验需求集成多种不同的操作单元,便于细胞的操纵,易于实现单细胞的自动化及高通量分析检测[42 - 44]。目前,与MCE-LIF结合用于单细胞NO检测的荧光探针主要是二氨基荧光素类荧光探针,如图6所示。

图6 与MCE-LIF结合用于单细胞NO分析的荧光探针的结构Fig.6 The structure of fluorescent probes used for single-cell NO analysis coupled with MCE-LIF

5 总结与展望
近年来,随着荧光探针的快速发展,单细胞NO分析取得了巨大的进步。荧光探针与激光共聚焦荧光显微镜结合可以实现单细胞乃至亚细胞水平NO的原位、实时可视化观察,与CE-LIF或MCE-LIF结合可以实现单细胞NO的定量检测。但是,目前新型NO荧光探针的开发主要集中在NO成像分析领域,而用于单细胞NO定量检测的荧光探针还局限于二氨基荧光素类和二氨基BODIPY类荧光探针,无法实现亚细胞水平NO的定量分析。未来,进一步提高探针的灵敏度、响应速度、亚细胞区域的定位能力、使激发/发射波长向远红外区域红移等分析性能仍然是新型NO荧光探针的研究方向,基于新型荧光探针的单细胞及亚细胞水平NO定性定量分析方法的建立将为NO生理病理作用机制的深入研究提供有力的工具。

