抗坏血酸包裹的铜纳米簇作为荧光探针定量测定维生素B12
李一鸣, 张国梅*, 郑永豪, 双少敏*
(1.山西大学化学化工学院,山西太原 030006; 2.电子科技大学,四川成都 611731)
维生素B12(VB12)[1,2]也称钴胺素,它是一种众所周知的微量营养素,由一个Co原子和一个四吡咯环组成,在各种生物催化过程中扮演辅酶的角色。此外,VB12在细胞代谢和维持神经系统中具有重要的生物学作用。VB12水平的降低会导致贫血、代谢异常、认知能力下降等,而摄入过量的VB12也会导致一些副作用,如哮喘、荨麻疹、湿疹和肾衰竭。因此,建立一种有效测定VB12的方法在实际临床诊断中至关重要。目前检测VB12的方法有很多,如高效液相色谱法[3]、微生物法、电化学法[4]、原子吸收光谱法、化学发光法[5]等。这些方法存在仪器设备成本高、测量耗时、样品制备复杂需预处理等问题。因此寻找一种简单、快速检测VB12的方法是十分必要的。近年来,荧光检测法因其样品制备简单、合成快、操作方便、灵敏度高、选择性强、测量快速等优点,而受到广泛关注。Wang等人[6]通过水热法合成亮蓝色荧光碳量子点(CDs),CDs具有良好的生物相容性和低毒性,可用于检测VB12。Fei等人[1]合成聚乙烯亚胺保护的银纳米簇(PEI@AgNCs),基于内滤效应,AgNCs的荧光可被VB12猝灭。
金属纳米团簇(MNCs)[7]作为一种新型荧光纳米材料,因其优异的光稳定性、强的光致发光、良好的生物相容性以及独特的量子尺寸效应而备受关注。到目前为止,一些稳定剂如DNA、蛋白质、聚合物等已被应用于合成CuNCs,但这些稳定剂成本高。此外,目前报道的大多数CuNCs是用有害的有机溶剂或强还原剂合成的。因此,探索合成水溶性好、绿色、稳定性高的CuNCs是十分必要的。近年来,有许多研究小组对抗坏血酸(AA)保护的CuNCs进行了研究。Zhang等人[8]以AA为保护剂和还原剂,制备出淡黄色荧光的CuNCs,用于检测苦味酸。基于以上事实,我们以AA作为保护剂和还原剂,通过“一锅法”绿色简便合成水溶性好、稳定性高的AA@CuNCs,此过程不需要额外的稳定剂、有机溶剂和强还原剂。更重要的是,本实验合成的荧光探针可以有效检测VB12,为VB12的快速检测提供了平台。
1 实验部分
1.1 仪器与试剂
UV-2910紫外-可见分光光度计(岛津公司,日本);F-4500荧光分光光度计(日立公司,日本);Bruker红外光谱仪(布鲁克中国科技公司);X射线光电子能谱仪(XPS,Kratos公司,英国);JEM-2100透射电子显微镜(电子株式会社,日本);BS124S电子分析天平(赛多利斯科学仪器有限公司,德国)。
抗坏血酸(AA,99%)购买于天津光复科技有限公司,CuSO4(99%)购买于北京化工厂,NaOH(96%)购买于天津化工厂,VB12(99%)购买于麦克林生化科技(中国)有限公司。实验用水为Milli-Q纯净水。
1.2 实验方法
1.2.1 AA@CuNCs的合成AA@CuNCs的合成和检测示意图如图1所示。

图1 AA@CuNCs的合成及VB12传感图。Fig.1 Schematic of synthesis of AA@CuNCs and sensing of VB12
将1.5 mL AA溶液(0.5 mol/L)与0.75 mL CuSO4溶液(10 mmol/L)混合,于室温下搅拌10 min,向混合溶液中加入560 μL的NaOH(1 mol/L)溶液,反应5 min。将混合物在80 ℃下搅拌5 h,溶液颜色变为黄色,将得到的溶液离心10 min,获得的AA@CuNCs放在4 ℃冰箱中储存,备用。
1.2.2 VB12的荧光光谱及选择性测定在荧光比色皿中加入100 μL AA@CuNCs溶液,600 μL磷酸盐缓冲溶液(PBS),300 μL纯水,再加入不同浓度的VB12溶液,混匀。设置激发波长为401 nm,扫描荧光光谱并记录数据。为证明AA@CuNCs对VB12的高选择性,在上述相同检测条件下,向AA@CuNCs中分别加入10 μmol/L的VB12和其他物质,测定这些物质对AA@CuNCs荧光强度的影响。
1.2.3 实际样品中VB12的检测购买20片市售VB12片,除去糖衣后,把药片研磨成粉末。称取1.4952 g粉末溶解于纯水中,用0.22 μm滤膜过滤,滤液用纯水稀释至50 mL,于4 ℃下保存。取5 mL新鲜的人体尿液,用0.22 μm滤膜过滤后,用纯水稀释至50 mL。根据工作曲线计算实际样品中VB12的浓度和回收率。
1.2.4 细胞成像将Hela细胞置于培养基中培养24 h。向培养基中加入AA@CuNCs,孵育1 h,吸出培养液后,用PBS(pH=4)洗涤3次,再向其中加入1 mL PBS(pH=7.4)。最后,在401 nm激发下观察显微镜内细胞成像情况。
2 结果与讨论
2.1 AA@CuNCs的表征
采用荧光光谱、紫外光谱、红外光谱、X射线光电子能谱(XPS)、透射电镜(TEM)等手段对制备的AA@CuNCs进行表征分析。图2(A)所示为AA@CuNCs的TEM图,从图中可看出:CuNCs呈球形,有良好的分散性且颗粒大小均匀,粒径约为1.6 nm。图2(B)所示为高分辨透射电镜(HRTEM)下AA@CuNCs的纳米晶格结构图,条纹间距为0.215 nm,这符合Cu(111)晶面[9]。
图2(C)所示为AA@CuNCs在不同激发波长下的荧光发射光谱图,随着激发波长增大,发射峰的位置出现红移现象,这说明CuNCs具有激发波长依赖性。图2(D)所示为AA@CuNCs的荧光光谱、紫外光谱图,当激发为401 nm时,AA@CuNCs在484 nm处产生最大发射强度。AA@CuNCs在可见光下呈淡黄色,在紫外灯(365 nm)照射下,溶液呈青色。与纯AA相比,AA@CuNCs在340 nm处有一个小的吸收峰,这更进一步证明AA@CuNCs的成功制备。以硫酸奎宁(λem=370 nm,量子产率为0.5426)作为参比,计算得AA@CuNCs的量子产率为2.31%。
图2(E)所示为AA和AA@CuNCs的红外光谱图,在AA的曲线中,1 754 cm-1的强吸收是由于五元内酯环体系中羰基的伸缩振动引起的,1 674 cm-1的强吸收是由烯醇型C=C双键的伸缩振动引起的,1 320 cm-1处的强吸收是由烯醇羟基-OH的弯曲振动引起的,1 277 cm-1处的吸收属于C-O-C伸缩振动,在1 046~1 801 cm-1区域的吸收归因于支链结构上的C-O-H的弯曲振动,在1 027 cm-1处的吸收与内酯环的变形有关。在AA@CuNCs曲线中,C=C双键在1 674 cm-1处的强吸收消失,1 320 cm-1处烯醇羟基-OH 的强弯曲振动带消失,共轭五元内酯环的吸收峰出现在1 650 cm-1处,五元内酯环体系中羰基的伸缩振动从1 754 cm-1移至1 733 cm-1,且吸收峰强度明显减弱,说明AA被氧化了,同时表明还原后的Cu与内酯环进行配位,进一步证实了Cu与O配位的结合。AA@CuNCs的XPS全谱图表明其中主要含有C、O、Cu等元素。图2F所示为CuNCs的铜(Cu 2p)谱图,CuNCs分别在932.1 eV和952.5 eV处各有一个峰,这对应Cu 2p3/2和Cu 2p1/2的结合能,这一现象说明荧光AA@CuNCs中存在Cu(Ⅰ)和Cu(0)。在942 eV左右没有出现卫星峰,这也表明AA@CuNCs中没有Cu(Ⅱ)存在,这个结果与以前的报道[10]一致。
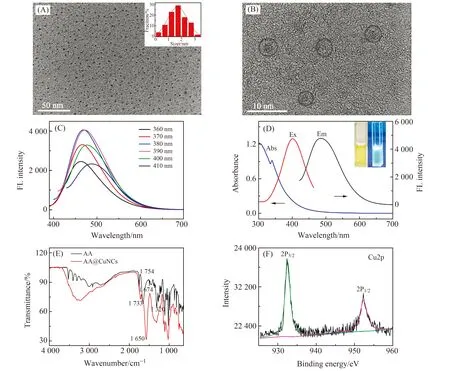
图2 (A)AA@CuNCs的TEM图;(B)AA@CuNCs的HRTEM图;(C)不同激发波长下AA@CuNCs的发射光谱图;(D)AA@CuNCs的紫外和荧光光谱图(内插图:日光下和紫外灯照射下的图片);(E)AA和AA@CuNCs的红外光谱图;(F) AA@CuNCs中Cu 2p的XPS谱图Fig.2 (A)TEM image of AA@CuNCs;(B)HRTEM image of AA@CuNCs;(C)Emission spectra of AA@CuNCs at different exicitation;(D)Absorption and fluorescence spectra of AA@CuNCs(Inset:photo of AA@CuNCs at daylight and UV light);(E)Infrared spectra of AA and AA@CuNCs;(F)Cu 2p XPS spectrum of AA@CuNCs
2.2 VB12检测条件优化
对VB12检测条件进行了优化。如图3(A)所示,一定量的VB12溶液(10 mmol/L)加入到AA@CuNCs中,AA@CuNCs的荧光强度明显降低,表明AA@CuNCs可用于检测VB12。图3(B)所示为不同pH缓冲溶液对AA@CuNCs荧光强度的影响,pH值在2.0~12.0范围内,荧光强度变化范围小,可忽略不计。因考虑到生理环境值及该探针在实际中的应用,选择pH=7.4作为最佳pH值。图3(C)是响应时间对AA@CuNCs检测VB12的影响,2 min后CuNCs的荧光强度基本保持稳定,故选择2 min作为最佳响应时间。图3(D)探究的是离子强度对AA@CuNCs的荧光强度影响,当加入不同浓度的NaCl(0~0.5 mmol/L)时,AA@CuNCs的荧光强度基本维持不变,表明离子强度对AA@CuNCs的影响不大。
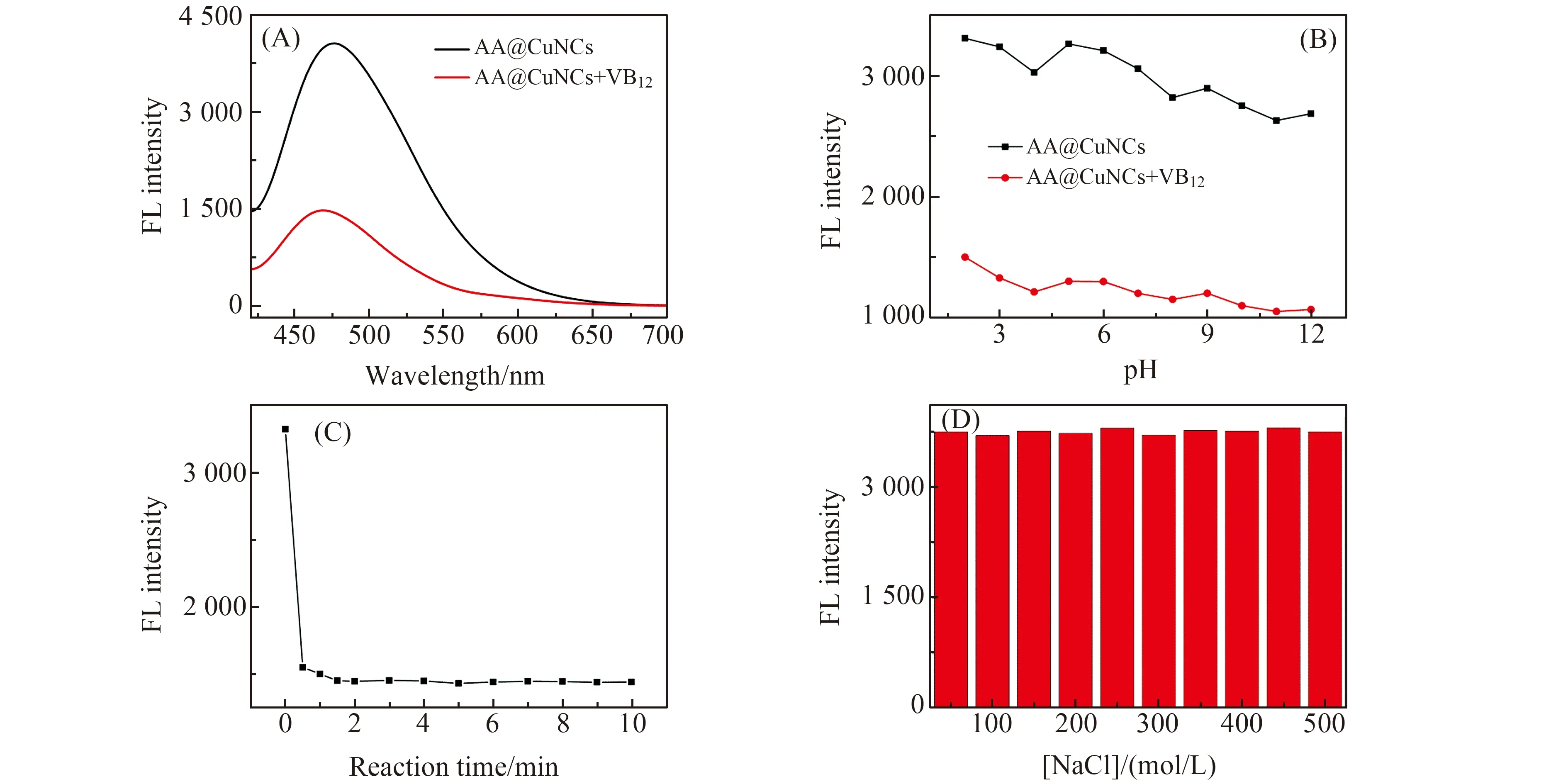
图3 VB12检测条件的优化:(A) 猝灭剂VB12;(B) pH值;(C) 反应时间;(D) 离子强度。Fig.3 Optimization of conditions for detection of VB12:(A) Quenching by VB12;(B) pH value;(C)Incubation time;(D) Ionic strength.
2.3 AA@CuNCs对VB12的灵敏度及选择性实验
在最优实验条件下,使用荧光滴定实验对VB12进行测定。如图4(A)所示,随着VB12的浓度从0 μmol/L增加到120 μmol/L,AA@CuNCs的荧光强度逐渐降低。图4(B)、(C)所示为AA@CuNCs的F0/F(F0和F分别代表不存在和存在VB12时AA@CuNCs的荧光强度)与VB12浓度的线性关系图。VB12浓度在10~60 μmol/L和100~120 μmol/L范围内与AA@CuNCs相对荧光强度F0/F呈较好的线性关系,线性相关系数R2均为0.9990,根据3σ/k计算得出检出限为0.07 μmol/L(σ为空白多次测量的标准偏差,k为工作曲线斜率)。
在相同实验条件下,探究AA@CuNCs对VB12的选择性。向AA@CuNCs中分别加入10 μmol/L的VB12和其他物质,如:VB1、VB3、VB6、VB9、VC、组氨酸(His)、半胱氨酸(Cys)、高半胱氨酸(Hcy)、缬氨酸(Val),测定这些物质对AA@CuNCs荧光强度的影响。由于VB1、VB3、VB6、VB9等物质同属维生素B族,但结构有差异,导致选择性不同。如图4(D)所示,在相同实验条件下,仅加入不同小分子物质本身,AA@CuNCs的荧光强度几乎没有发生变化;当分别都加入VB12时,荧光强度均有明显猝灭,表明AA@CuNCs对VB12有良好的选择性,且其他物质的干扰较小。
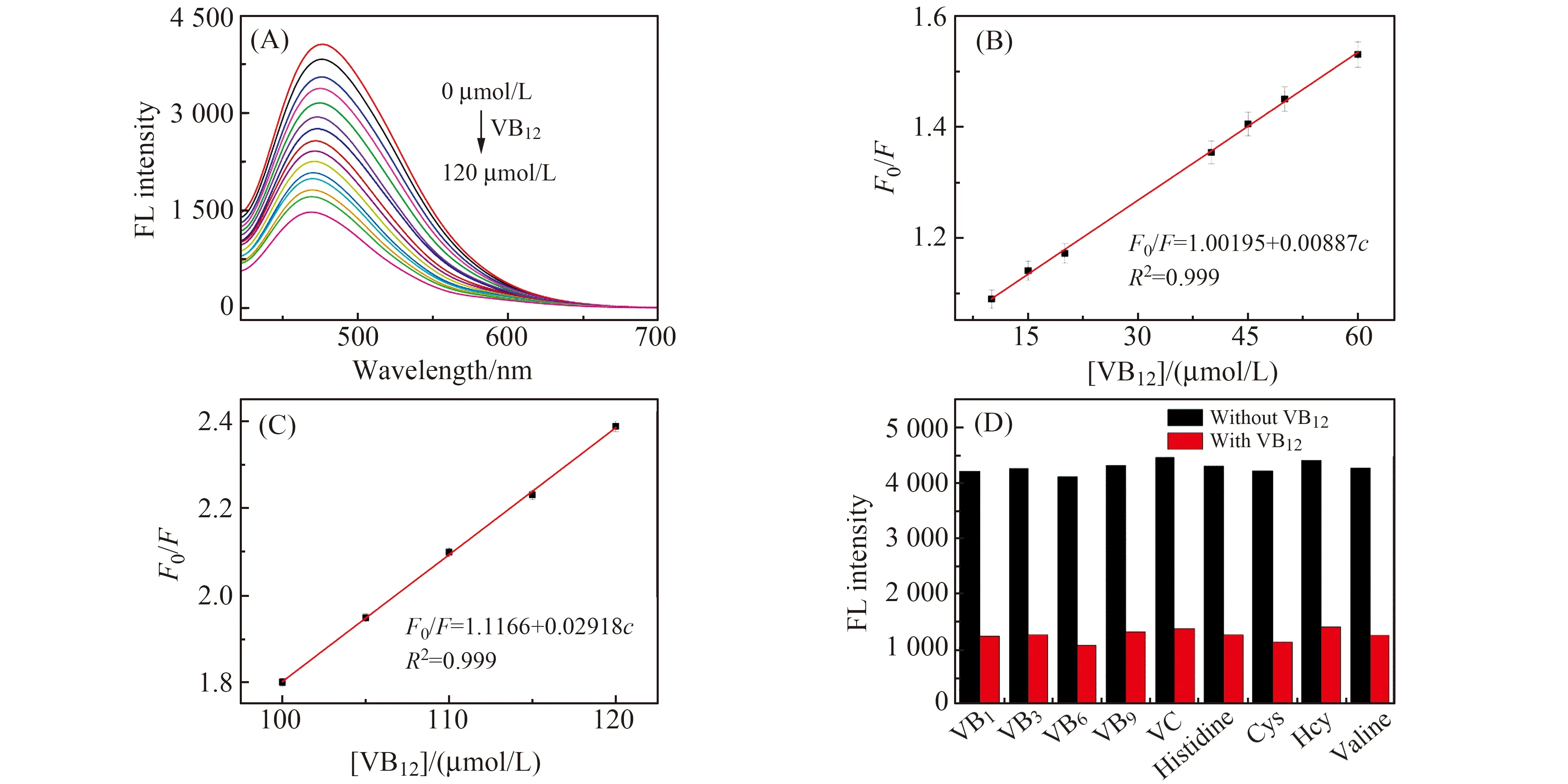
图4 (A) 不同浓度的VB12对AA@CuNCs的荧光强度的影响;(B)-(C) VB12的浓度与AA@CuNCs相对荧光强度(F0/F)之间的线性关系;(D)AA @CuNCs对不同小分子物质的选择性Fig.4 (A) Fluorescence response of AA@CuNCs in the presence of different concentrations of VB12;(B)-(C)Linear plots between different concentrations of VB12 and fluorescence intensity(F0/F) of AA@CuNCs;(D)Selectivity of different small molecules for AA@CuNCs detection
与其他检测VB12的方法相比,该方法对VB12的检测具有较宽的线性范围,如表1所示。

表1 AA@CuNCs与其它测定VB12方法的比较Table 1 Comparison between AA@CuNCs and other methods for the determination of VB12
2.4 VB12诱导AA@CuNCs的猝灭机理
为探究VB12诱导AA@CuNCs的荧光猝灭机理,运用紫外吸收光谱、荧光光谱、荧光寿命分析等技术手段对其进行研究。图5(A)所示为VB12的紫外可见吸收光谱图和AA@CuNCs的荧光光谱图。由图可知,VB12的吸收光谱与AA@CuNCs的荧光光谱在一定程度上有较大的重叠,这表明荧光猝灭机理可能为内滤效应(IFE)。为进一步探究猝灭类型,在VB12存在下,测定了AA@CuNCs的荧光寿命。如图5(B)所示,当加入VB12后,CuNCs的荧光寿命基本不变,证明VB12与AA@CuNCs的猝灭类型属于静态猝灭[13,14]。

图5 (A) VB12的紫外-可见吸收光谱图和AA@CuNCs的荧光光谱图;(B)AA@CuNCs和AA@CuNCs-VB12体系的荧光寿命图Fig.5 (A) UV-Vis absorption spectra of VB12 and fluorescence spectra of AA@CuNCs;(B)Fluorescence decay lifetime of AA@CuNCs and AA@CuNCs-VB12
2.5 实际样品中VB12的检测
为了评估AA@CuNCs在实际样品中检测VB12的可行性和准确度,分别测定了VB12药片、尿液中的VB12含量。实验采用标准加入法,实验结果如表2所示,回收率为99.03%~101.75%,相对标准偏差(RSD)小于3.0%,表明AA@CuNCs可以准确可靠地检测实际样品中VB12的含量。

表2 检测实际样品中维生素B12的测定(n=3)Table 2 Determination of VB12 in actual sample(n=3)
2.6 细胞成像实验
为探索AA@CuNCs在细胞成像中的应用,以Hela细胞为模型,进行细胞成像实验。图6所示为激光共聚焦扫描显微荧光成像图。图6(A-C)为含0.5 mg/mL AA@CuNCs溶液的Hela细胞的共聚焦图像;图6(D-F)为AA@CuNCs溶液加入VB12后的共聚焦图像。从图中可看出Hela细胞状态良好,呈青色荧光,对比可得:加入VB12后标记的Hela细胞的荧光强度减弱,说明AA@CuNCs有良好的生物相容性,可用于生物荧光成像并监测VB12。
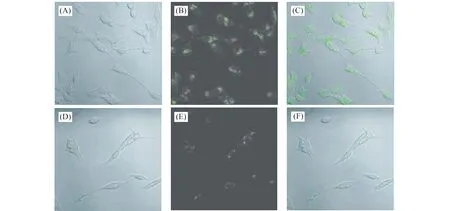
图6 (A)-(C) AA@CuNCs在hela细胞中的荧光共聚焦成像;(D)-(F)AA@CuNCs中加入VB12后共聚焦成像Fig.6 Confocal bright field(A and D),fluorescence(B and E),and overlap images(C and F) of hela cells incubated with AA@CuNCs(A-C) and in the presence of VB12(D-F)
3 结论
以抗坏血酸作为稳定剂和还原剂,通过“一锅法”在碱性条件下合成了荧光AA@CuNCs,此过程不需要额外的稳定剂、有机溶剂和强还原剂。结果表明,VB12加入后,该荧光探针的荧光强度显著降低,VB12浓度在10~60 μmol/L与100~120 μmol/L范围内与AA@CuNCs的相对荧光强度(F0/F)呈较好的线性关系,且检出限低。此方法可用于实际样中VB12的检测。此外,制备的AA@CuNCs在Hela细胞内实现了荧光共聚焦成像。

