温经活血方对气虚血瘀型糖尿病周围神经病变的疗效及微循环的影响
李爱琴,金星,任鑫,黄宗卫
(开封市中心医院,河南 开封 475000)
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)为2 型糖尿病(type 2 diabetes,T2DM)最常见的慢性并发症之一,本病以四肢麻木、刺痛等肢体感觉异常为主要临床表现,是T2DM 患者致残的主要原因,可对患者的生活质量造成严重的影响[1]。根据DPN 患者的临床症状,本病当属“消渴”“血痹”“脉痹”的范畴,《临证指南医案》对于本病病机已有论述,认为本病“经年宿病,病必在络;久痛必入络,气血不行;络脉瘀闭,不通则痛”。研究发现,应用中医药辨证治疗DPN,能提高临床治疗效果[2-3]。笔者自拟温经活血方应用于气虚血瘀型DPN 患者的治疗中,并观察其对微循环的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取开封市中心医院2019年10月—2021年12月收治的120 例符合纳入标准的气虚血瘀型DPN 患者。依据随机数字表将患者随机分为对照组和观察组,每组各60 例。对照组中男38 例,女22 例;年龄(50.98±5.22)岁;T2DM 病程(6.90±3.26)年;DPN 病程(7.23±3.85)个月;空腹血糖(6.23±0.64)mmol/L;餐后2 h血糖(10.34 ± 0.97)mmol/L;糖化血红蛋白(7.12 ±0.92)%;体质量指数(24.58 ± 1.29)kg/m2。观察组中男34 例,女26 例;年龄(50.41 ± 5.59)岁;T2DM 病程(6.36 ± 2.17)年;DPN 病程(6.30 ± 2.78)个月;空腹血糖(6.17 ± 0.84)mmol/L;餐后2 h 血糖(10.65 ±0.93)mmol/L;糖化血红蛋白(7.24±0.76)%;体质量指数(24.88±1.10)kg/m2。两组患者基础资料比较,差异无统计学意义(P>0.05),具有可比性。本研究方案经开封市中心医院伦理委员会审核并批准,批准号:2019ks003-01。
1.2 诊断标准
1.2.1 中医诊断标准
符合《糖尿病周围神经病变中医临床诊疗指南(2016 版)》[4]中DPN 气虚血瘀证的诊断标准。肢体无力麻木如有蚁行,肢末时痛,多呈刺痛,下肢为主,入夜痛甚,神疲倦怠,气短懒言,动辄汗出,腹泻或便秘;舌质淡暗,或有瘀点,苔薄白,脉细涩。
1.2.2 西医诊断标准
符合《中国2 型糖尿病防治指南(2020年版)》[5]中DPN 的诊断标准。明确的糖尿病病史;诊断糖尿病时或之后出现的神经病变;双侧远端对称性肢体疼痛、麻木、感觉异常。
1.3 纳入标准
①符合中、西医诊断标准;②年龄18 ~60岁;③签署知情同意书。
1.4 排除标准
①诊断为1型糖尿病者;②合并2型糖尿病急性并发症者;③存在除周围神经病变外其他2 型糖尿病慢性并发症者;④神经病变为其他病因引起者,如严重动静脉血管性病变、维生素B12 缺乏、感染、药物引起的神经毒性作用以及肾功能不全引起的神经损伤;⑤存在心脑血管疾病及肺部疾病者;⑥存在免疫系统疾病或恶性肿瘤者;⑦近3 个月已接受营养周围神经药物治疗者;⑧对治疗药物存在过敏者。
1.5 治疗方法
所有患者入组后均给予基础治疗。糖尿病饮食,指导患者适当运动,并给予阿卡波糖片、二甲双胍片口服及胰岛素皮下注射以降糖治疗,治疗过程中监测血糖,并根据血糖水平及时调整降糖药物治疗方案。
1.5.1 对照组
给予甲钴胺片(中国卫材药业有限公司,国药准字H20030812)口服,每次0.5 g,每日3 次口服。治疗时间为12周。
1.5.2 观察组
在对照组基础上给予自拟温经活血方口服。组方:黄芪30 g,白芍、熟地黄各15 g,桂枝、当归、桃仁、红花、川芎、生姜各10 g,大枣6 g。随症加减:上肢麻木重者加桑枝15 g,僵蚕6 g;下肢麻木重者加怀牛膝15 g,僵蚕6 g;四肢疼痛重者加延胡索10 g,地龙、全蝎各6 g;肢体灼热者加麦冬10 g,知母6 g;心烦失眠重者加酸枣仁20 g,麦冬10 g。每日1剂,水煎300 mL,每次150 mL,分早晚两次温服。治疗时间为12周。
1.6 观察指标
1.6.1 中医症状量化积分和TCSS评分
分别于治疗前和治疗4、8、12 周后,应用中医症状量化积分量表及多伦多临床评分系统(toronto clinical scoring system,TCSS)对患者的临床症状进行评价,分析治疗过程中的中医症状量化积分及TCSS 评分变化情况。中医症状量化积分量表参考《中药新药临床研究指导原则(试行)》制定,观察两组患者口渴喜饮、多食易饥、小便频多、肢体麻木、肢体疼痛、心烦失眠及手足心热的临床症状,严重计3 分,中等计2 分,轻微计1 分,无症状计0 分。TCSS 评分量表包括症状评分、反射评分及感觉检测评分3 项,总分0 ~19 分,分数越高表示神经损伤越严重。
1.6.2 神经传导速度
分别于患者治疗前和治疗4、8、12 周后,应用迈康M-800C肌电图仪对正中神经、腓总神经、腓肠神经的运动及感觉神经传导速度进行检测,分析两组治疗过程中各条神经运动神经传导速度(motor nerve conduction velocity,MCV)和感觉神经传导速度(sensory nerve conduction velocity,SCV)变化情况并进行评价。
1.6.3 微循环及氧化应激因子水平
分别于患者治疗前和治疗4、8、12 周后,应用迈瑞DC-8EXP彩超诊断仪对足背动脉内径及足背动脉流速进行检查,分析两组患者治疗过程中足背动脉内径及足背动脉流速变化情况。同时抽取空腹静脉血,应用放射免疫法对血浆内皮素-1(endothelin-1,ET-1)、血清血栓素A2水平进行测定,应用酶联免疫吸附法对血清丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)及总抗氧化能力(total antioxidant capacity,T-AOC)进行测定,分析两组治疗过程中ET-1、血栓素A2、SOD、MDA及T-AOC水平变化情况。
1.6.4 不良反应
对比两组患者治疗过程中不良反应发生的情况。
1.7 临床疗效判定标准
参考《中医内科病证诊断疗效标准》[6]制定。痊愈:症状、体征消失,中医症状量化积分减少≥90%;显效:症状、体征明显好转,70% ≤中医症状量化积分减少<90%;有效:症状、体征好转,30%≤中医症状量化积分减少<70%;无效:症状无改善,中医症状量化积分减少<30%。
1.8 统计学分析
应用SPSS 21.0 软件进行数据分析。以均数±标准差(±s)表示计量数据,采用t检验进行组间差异分析,以重复测量方差分析行组内变化分析;以[例(%)]表示计数数据,采用卡方检验行组间差异分析。P<0.05表示差异具有统计学意义。
2 结果
2.1 两组患者不同时间点中医症状量化积分和TCSS评分比较
治疗过程中,两组患者中医症状量化积分及TCSS评分均呈降低趋势,差异具有统计学意义(P<0.05)。治疗8周及12周后,观察组中医症状量化积分及TCSS评分低于对照组,差异具有统计学意义(P<0.05)。见表1。
表1 两组患者不同时间点中医症状量化积分和TCSS评分比较(±s,分)
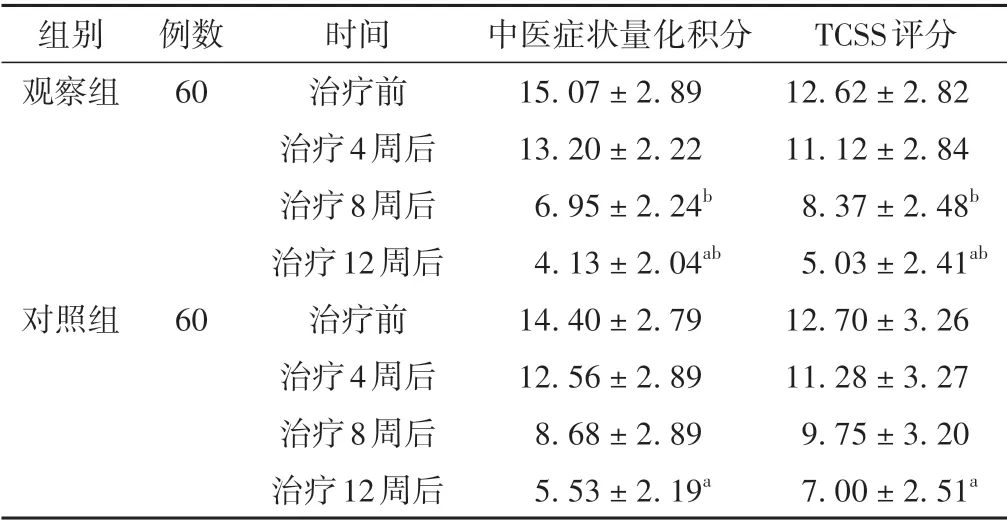
表1 两组患者不同时间点中医症状量化积分和TCSS评分比较(±s,分)
注:与本组治疗前比较,aP <0.05;与对照组同时间点比较,bP <0.05。
TCSS评分12.62±2.82 11.12±2.84 8.37±2.48b 5.03±2.41ab 12.70±3.26 11.28±3.27 9.75±3.20 7.00±2.51a组别观察组例数60对照组60时间治疗前治疗4周后治疗8周后治疗12周后治疗前治疗4周后治疗8周后治疗12周后中医症状量化积分15.07±2.89 13.20±2.22 6.95±2.24b 4.13±2.04ab 14.40±2.79 12.56±2.89 8.68±2.89 5.53±2.19a
2.2 两组患者不同时间点运动神经传导速度比较
治疗过程中,两组患者正中神经、腓总神经、腓肠神经MCV 水平均呈增快趋势,差异具有统计学意义(P<0.05)。治疗8 周及12 周后,观察组正中神经、腓总神经、腓肠神经MCV 水平高于对照组,差异具有统计学意义(P<0.05)。见表2。
表2 两组患者不同时间点MCV比较(±s,m/s)
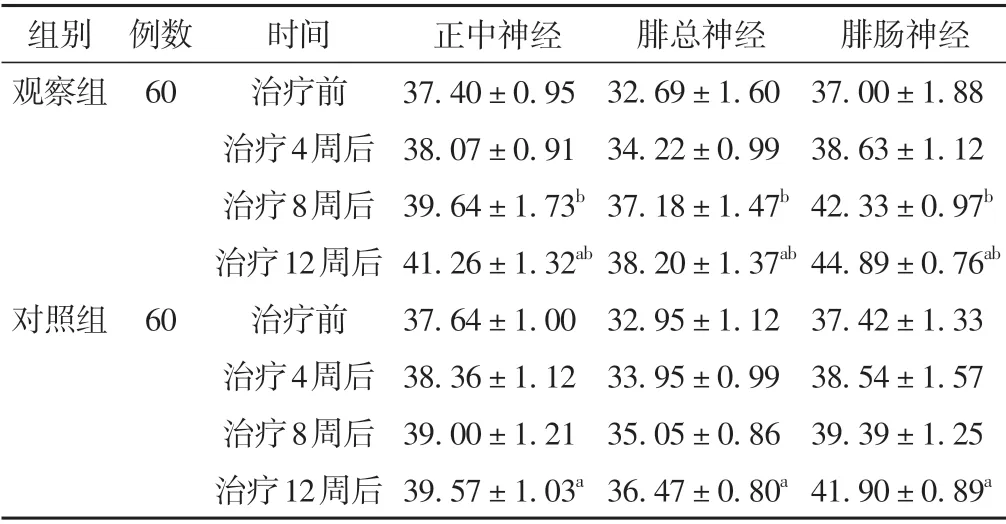
表2 两组患者不同时间点MCV比较(±s,m/s)
注:与本组治疗前比较,aP <0.05;与对照组同时间点比较,bP <0.05。
腓肠神经37.00±1.88 38.63±1.12 42.33±0.97b 44.89±0.76ab 37.42±1.33 38.54±1.57 39.39±1.25 41.90±0.89a组别观察组例数60对照组60时间治疗前治疗4周后治疗8周后治疗12周后治疗前治疗4周后治疗8周后治疗12周后正中神经37.40±0.95 38.07±0.91 39.64±1.73b 41.26±1.32ab 37.64±1.00 38.36±1.12 39.00±1.21 39.57±1.03a腓总神经32.69±1.60 34.22±0.99 37.18±1.47b 38.20±1.37ab 32.95±1.12 33.95±0.99 35.05±0.86 36.47±0.80a
2.3 两组患者不同时间点感觉神经传导速度比较
治疗过程中,两组患者正中神经、腓总神经、腓肠神经SCV 水平均呈增快趋势,差异具有统计学意义(P<0.05)。治疗8 周及12 周后,观察组正中神经、腓总神经、腓肠神经SCV 水平高于对照组,差异具有统计学意义(P<0.05)。见表3。
表3 两组患者不同时间点SCV比较(±s,m/s)
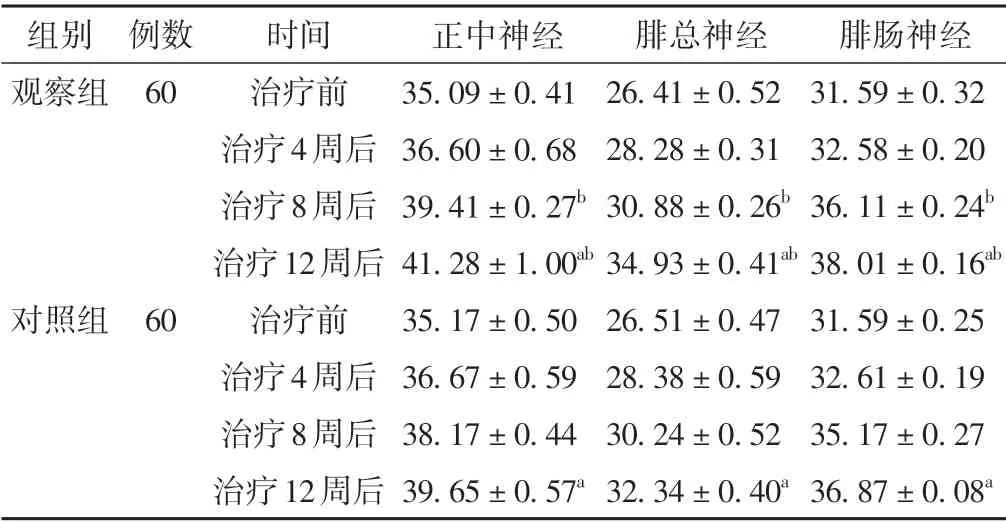
表3 两组患者不同时间点SCV比较(±s,m/s)
注:与本组治疗前比较,aP <0.05;与对照组同时间点比较,bP <0.05。
腓肠神经31.59±0.32 32.58±0.20 36.11±0.24b 38.01±0.16ab 31.59±0.25 32.61±0.19 35.17±0.27 36.87±0.08a组别观察组例数60对照组60时间治疗前治疗4周后治疗8周后治疗12周后治疗前治疗4周后治疗8周后治疗12周后正中神经35.09±0.41 36.60±0.68 39.41±0.27b 41.28±1.00ab 35.17±0.50 36.67±0.59 38.17±0.44 39.65±0.57a腓总神经26.41±0.52 28.28±0.31 30.88±0.26b 34.93±0.41ab 26.51±0.47 28.38±0.59 30.24±0.52 32.34±0.40a
2.4 两组患者不同时间点微循环指标比较
治疗过程中,两组患者足背动脉内径及足背动脉流速均呈升高趋势,ET-1 及血栓素A2 水平均呈降低趋势,差异具有统计学意义(P<0.05)。治疗8 周及12周后,观察组足背动脉内径及足背动脉流速高于对照组,ET-1 及血栓素A2 水平低于对照组,差异具有统计学意义(P<0.05)。见表4。
表4 两组患者不同时间点微循环指标比较(±s)
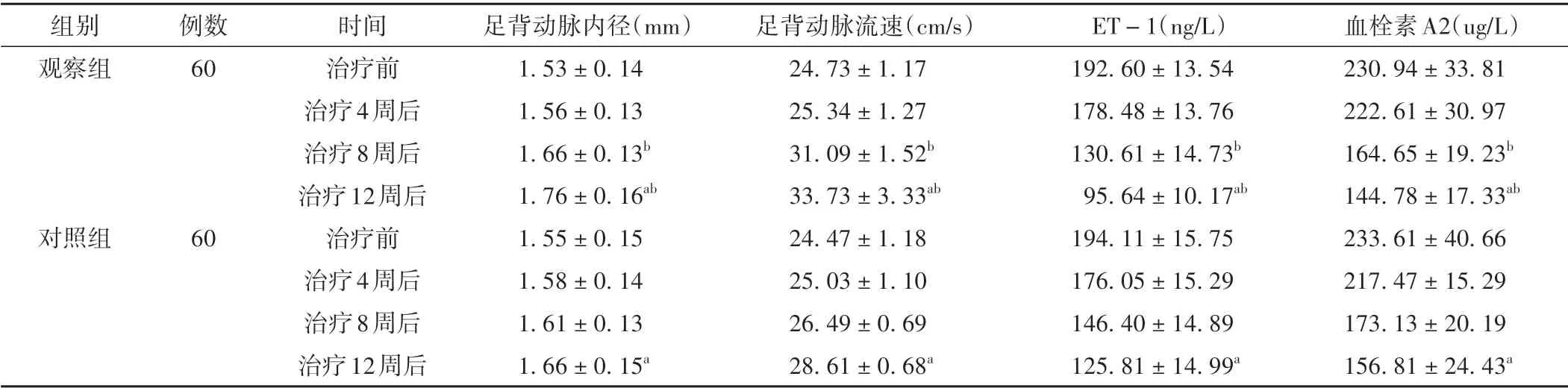
表4 两组患者不同时间点微循环指标比较(±s)
注:与本组治疗前比较,aP <0.05;与对照组同时间点比较,bP <0.05。
组别观察组血栓素A2(ug/L)230.94±33.81 222.61±30.97 164.65±19.23b 144.78±17.33ab 233.61±40.66 217.47±15.29 173.13±20.19 156.81±24.43a例数60对照组60时间治疗前治疗4周后治疗8周后治疗12周后治疗前治疗4周后治疗8周后治疗12周后足背动脉内径(mm)1.53±0.14 1.56±0.13 1.66±0.13b 1.76±0.16ab 1.55±0.15 1.58±0.14 1.61±0.13 1.66±0.15a足背动脉流速(cm/s)24.73±1.17 25.34±1.27 31.09±1.52b 33.73±3.33ab 24.47±1.18 25.03±1.10 26.49±0.69 28.61±0.68a ET-1(ng/L)192.60±13.54 178.48±13.76 130.61±14.73b 95.64±10.17ab 194.11±15.75 176.05±15.29 146.40±14.89 125.81±14.99a
2.5 两组患者不同时间点氧化应激指标比较
治疗过程中,两组患者SOD 及T-AOC 水平均呈升高趋势,MOD 水平均呈降低趋势,差异具有统计学意义(P<0.05)。在完成8 周及12 周治疗后,观察组SOD 及T-AOC 水平高于对照组,MOD 水平低于对照组,差异具有统计学意义(P<0.05)。见表5。
表5 两组患者不同时间点氧化应激指标比较(±s)
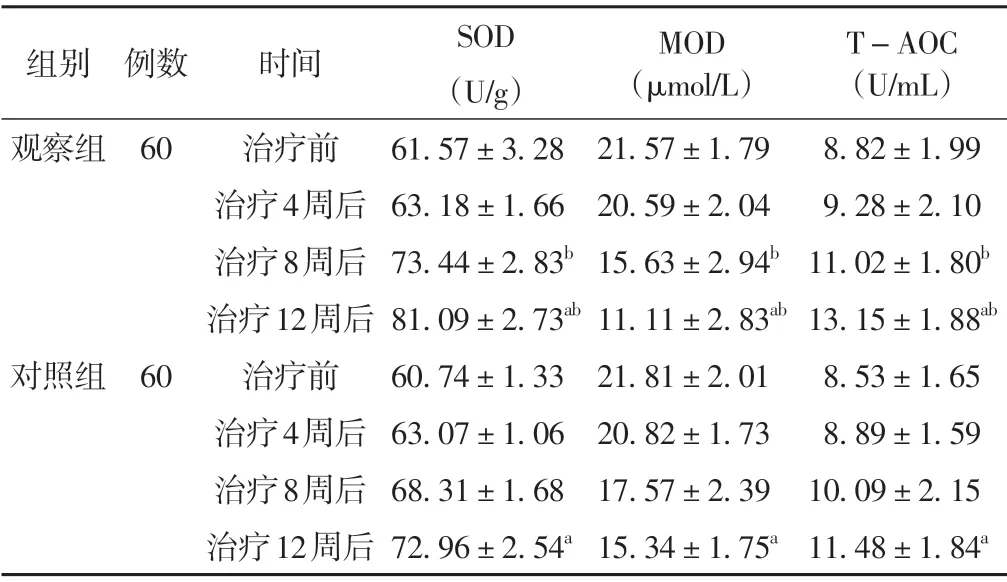
表5 两组患者不同时间点氧化应激指标比较(±s)
注:与本组治疗前比较,aP <0.05;与对照组同时间点比较,bP <0.05。
SOD(U/g)61.57±3.28 63.18±1.66 73.44±2.83b 81.09±2.73ab 60.74±1.33 63.07±1.06 68.31±1.68 72.96±2.54a T-AOC(U/mL)8.82±1.99 9.28±2.10 11.02±1.80b 13.15±1.88ab 8.53±1.65 8.89±1.59 10.09±2.15 11.48±1.84a组别观察组例数60对照组60时间治疗前治疗4周后治疗8周后治疗12周后治疗前治疗4周后治疗8周后治疗12周后MOD(μmol/L)21.57±1.79 20.59±2.04 15.63±2.94b 11.11±2.83ab 21.81±2.01 20.82±1.73 17.57±2.39 15.34±1.75a
2.6 两组患者临床疗效比较
治疗后,观察组临床痊愈7 例,显效24 例,有效26例,无效3例;对照组临床痊愈0 例,显效18例,有效32 例,无效10 例;观察组治疗总有效率高于对照组(P<0.05)。见表6。
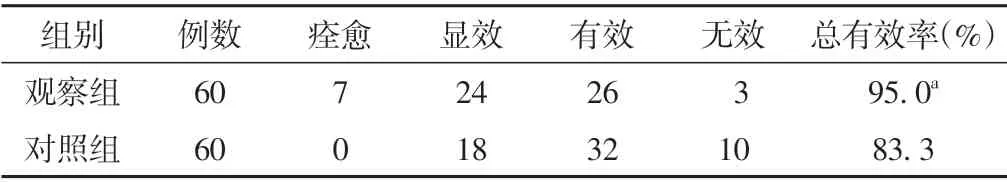
表6 两组患者临床疗效比较
2.7 两组患者不良反应比较
观察组治疗期间出现恶心5 例,腹泻3 例,失眠2 例;对照组治疗期间出现恶心4 例,腹泻4 例,失眠1 例;两组不良反应发生率比较差异无统计学意义(P>0.05)。见表7。
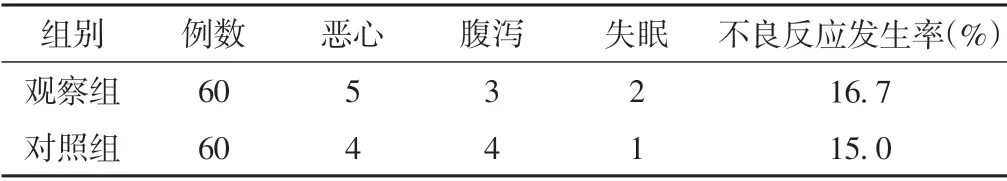
表7 两组患者不良反应发生情况比较
3 讨论
DPN 是以糖代谢紊乱为病理基础的周围神经疾病,长期的糖代谢紊乱可诱发机体出现维生素缺乏、代谢障碍及微循环障碍,导致周围神经变性、神经节段脱髓鞘、甚至轴索变性,最终导致DPN 的发生[7]。西医治疗可在一定程度上改善DPN 患者的临床症状,但因DPN 的发病机制复杂,其治疗效果存在一定的局限性[8]。
根据DPN 患者的临床表现,可归为“消渴”“痹症”等范畴,《备急千金要方》云:“消渴之人……心烦热,两脚酸”,认为本病的发生与“气血不荣四末”有关。DPN的病机主要为气阴两虚、血行不畅、血瘀内生、闭阻络脉,以致四末失养,不荣则痛,故发为肢体痒、麻、凉、痛等症,本病当属本虚标实之证,以气血两虚为本,以血瘀内停为标,故治疗中常以益气养阴、活血通络为基本治疗原则。研究发现,中医药治疗方案可有效改善DPN患者的临床症状与预后[9-10]。
本研究结果显示,治疗过程中,接受不同治疗方案的两组患者中医症状量化积分、TCSS 评分、ET-1、血栓素A2 及MOD 均呈降低趋势,正中神经、腓总神经、腓肠神经MCV 及SCV 均呈增快趋势,足背动脉内径、足背动脉流速、SOD 及T-AOC 均呈升高趋势;且治疗8 周及12 周后,观察组中医症状量化积分、TCSS 评分、ET-1、血栓素A2及MOD低于对照组,正中神经、腓总神经、腓肠神经MCV 及SCV 快于对照组,足背动脉内径、足背动脉流速、SOD 及T-AOC 均高于对照组。可见,在甲钴胺片治疗的基础上,联合自拟温经活血方可有效改善DPN 患者的病情、改善外周微循环障碍。SOD、T-AOC 及MOD 均为临床评估氧化应激程度的重要指标[11-12],故自拟温经活血方治疗DPN 的作用机制可能与调节氧化应激所诱发的炎症反应相关。
温经活血方是黄芪桂枝五物汤与桃花四物汤的合方,其中以黄芪为君,以达益气、健脾、补中、固表之效;臣以当归、熟地黄、桂枝、白芍,当归、熟地黄可益气养血,助黄芪达补中益气之功,桂枝可温经通脉,白芍可养阴生津、和络止痛,桂枝与白芍合用,具调和营卫之能,善疗血痹;同时以生姜、桃仁、红花、川芎为佐,生姜可佐助桂枝温经,桃仁、红花、川芎可活血通络,与生姜合用,可佐助桂枝温经活血通络之效;最后以大枣为使,既具有补益气血之效,又善调和诸药。全方诸药合用,可达益气养血、温阳助卫、活血通络之效。药理学研究发现,黄芪不仅有清除氧自由基的作用,同时还具有着增强免疫力的功能[13];当归与黄芪配伍,其药物有效成分则可通过调节炎性反应及低氧诱导通路等多种途径,达到改善血管低氧状态的作用[14];桂枝中所含有的桂皮醛等成分,具有着抗炎及调节免疫的双重作用[15];而桃仁所含有的杏仁苷、红花所含有的红花黄色素均具有着改善血流动力学及微循环障碍的作用[16-17];同时川芎与黄芪,川芎与芍药均可有效改善患者的炎性反应及外周循环状态[18-20]。
综上所述,温经活血方联合甲钴胺片不仅可提高DPN 患者的治疗效果,同时对患者的微循环障碍有着显著的改善作用。但因本研究的随访时间较短,尚无法对患者的远期预后进行评价,今后可延长随访时间,进一步评价本疗法的远期疗效。

