基于神经细胞外基质探讨健脾补土方抗大鼠脑缺血再灌注神经细胞失巢凋亡机制
刘祎,刘旺华,3✉,李花,彭智远
(1. 湖南中医药大学中医学国内一流建设学科,湖南 长沙 410208;2. 湖南中医药大学中医诊断学湖南省重点实验室,湖南 长沙 410208;3. 湖南中医药大学中医心肺病证辨证与药膳食疗重点研究室,湖南 长沙 410208)
脑卒中是人类心脑血管疾病中最严重的疾病之一,其防治是全球性的难题,通过医学干预恢复缺血、缺氧后脑组织血液再充氧是其主要治疗方式。中国全部卒中事件中缺血性卒中约占所有脑卒中患者的85%[1]。脑缺血再灌注损伤(cerebral ischemia-reperfusion injury,CIRI)是一种较严重的病理损伤过程,涉及炎症反应、氧化应激反应、神经细胞自噬与凋亡等病理机制,是缺血性脑卒中损伤加重的主要原因之一[2]。凋亡存在于各类疾病病理过程中,细胞凋亡是主动的程序性死亡,当脑缺血再灌注损伤后,神经细胞凋亡是神经细胞死亡的主要途径之一[3]。细胞外基质(extra cellular matrix,ECM)如纤连蛋白(fibronectin,FN)和层粘连蛋白(laminin,LN)等,是细胞和组织内环境稳态的主要调节者,对细胞外平衡的维持较为重要,ECM 环境中基质成分及细胞黏附受体相互结合,为细胞、组织和器官,甚至整个机体提供支撑作用[4]。当细胞脱离ECM环境,或ECM 受到损伤,细胞会经历一种特殊类型的程序性死亡,称为失巢凋亡[5]。神经ECM 作为中枢神经系统的重要组成部分,在生理情况下,ECM 的产生和降解能够维持机体的动态平衡,为神经细胞提供支持环境;脑缺血发生时,平衡状态被打破,神经细胞失去支撑,从而导致神经细胞凋亡[6]。因此,神经ECM 是神经元生存的细胞外环境和载体,起到承载、营养、保护并促进神经元突触生长的作用,且有利于促进干细胞向神经细胞转化。神经ECM 对神经元的作用与中医学“脾属土,土主承载”功能相似[6]。基于此,本研究拟从“脾”论治,探讨以四君子汤为基本方的健脾补土方对脑缺血再灌注后神经ECM 的保护作用及抗神经细胞失巢凋亡中的作用机制。
1 实验材料
1.1 实验动物
SPF级雄性SD大鼠120只,体质量(250±10)g,购于湖南斯莱克景达有限公司,湖南中医药大学东塘SPF级实验室饲养,温度(23±2)℃,相对湿度(45±10)%,适应性喂养5~7 d后,对体质量达(290±10)g的大鼠予以造模。本实验已获得湖南中医药大学动物实验伦理委员会批准,动物试验许可证号:SYXK(湘)2013-0005,动物合格证号:43004700018445。
1.2 药物及制备
健脾补土方组成:人参片15 g,白术12 g,茯苓10 g,黄芪15 g,山药12 g,薏苡仁12 g 和炙甘草6 g,所需中药饮片均购于湖南中医药大学第一附属医院,经湖南中医药大学黄小平教授鉴定,符合2015 版《中华人民共和国药典》的规定。所有药材用纯水浸泡30 min,首次煎煮用6 倍量水,煎煮40 min,过滤药液,然后加4 倍量水再次煎煮40 min 后过滤药液,两次煎煮滤液混合浓缩成生药含量为1 g/mL 的药液,4 ℃保存备用。
依达拉奉注射液(吉林博大公司,批号:80-140603,规格:10 mL/15 mg)。
1.3 主要试剂及仪器
兔抗大鼠β-actin(批号:600008-1);兔抗大鼠层粘连蛋白(LN)抗体(批号:A90082Ra01);兔抗大鼠纤连蛋白(FN)抗体(批号:A90037Hu01);兔抗大鼠B 细胞淋巴瘤-2(Bcl-2)抗体(批号:YD8891);兔抗大鼠Bcl-2 相关X 蛋白(Bax)抗体(批号:3351);HRP标记山羊抗兔IgG(批号:E030120);以上抗体均购于美国Proteintech公司。TUNEL试剂盒(上海鲁汶生物,批号:S7100);MCAO 栓线(北京西浓有限公司,批号:A4263450)。
AlphaEaseFC 灰度分析软件(Adobe);TGL-16c型离心机(上海安亭);TYXH-Ⅱ涡旋混合器(天悦电子);V300扫描仪(EPSON)。
2 方法
2.1 模型制备
应用改良线栓法[7]制备大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)大鼠模型。腹腔注射10%水合氯醛(3.5 mL/kg)麻醉大鼠后,仰卧位固定,于颈正中切口,将左侧颈总动脉、颈内动脉、颈外动脉钝性分离。夹闭颈总和颈内动脉,结扎颈外动脉并于其远心端剪一切口,将栓线缓慢向颈内动脉推入,到达大脑中动脉19~20 mm,回缩约2 mm 后固定栓线。缺血2 h后缓慢拔出栓线。假手术组只钝性分离血管,不做其他处理。
2.2 分组及给药
120 只大鼠随机分成6 个组,分别为假手术组、模型组、依达拉奉组以及健脾补土方低、中、高剂量组。剔除喂养期间意外死亡及造模后死亡大鼠,每组剩余16 只,各组大鼠造模成功24 h 后给药。依达拉奉等效剂量为3.2 mg/kg;健脾补土方给药剂量按成人与大鼠等效剂量[8]换算,低剂量为3.69 g/kg,中剂量为7.38 g/kg,高剂量为14.76 g/kg;假手术组和模型组大鼠给予等体积生理盐水。各组于每日同一时间给药,每日1次,共给药7 d。
2.3 动物取材
给药7 d后,10%水合氯醛麻醉大鼠,予心脏灌注,迅速断头取脑,将缺血侧脑组织于4%多聚甲醛中固定24 h 以上,石蜡包埋组织,作厚度为6 μm 的冠状切片,用于TUNEL 检测和免疫组织化学染色;分离缺血侧脑组织海马区放入冻存管,置于液氮速冻,用于Western blot和RT-PCR检测。
2.4 指标检测
2.4.1 神经功能缺损评分
采用Zea-Longa 5 级4 分法[7]对造模24 h 后的大鼠进行神经功能缺损评分。术后评分在1~3 分者为造模成功,可纳入为研究对象,0 分和4 分者剔除。分数越高,提示神经功能损伤症状越严重。
2.4.2 免疫组织化学染色法检测FN、LN的表达
将切片进行烤片→脱蜡→滴加3% H2O2→0.01%柠檬酸钠缓冲液微波修复→滴加兔抗大鼠FN(1∶100)、兔抗大鼠LN(1∶100),4 ℃孵育过夜。次日滴加增强液孵育20 min→37 ℃孵育二抗,30 min→DAB 染色→苏木素复染→盐酸乙醇分化→脱水→透明→封片。采用光学显微镜拍照(× 400),以光密度值(integral optical density,IOD)进行表示。
2.4.3 TUNEL法检测神经细胞凋亡指数(AI)参照TUNEL 试剂盒说明书,于光镜下观察切片,计数凋亡细胞。凋亡细胞的阳性细胞计数用AI 表示,随机取每张切片的5 个高倍视野,结果取平均值。
AI(%)=阳性细胞数/全部细胞数×100%
2.4.4 Western blot检测Bcl-2、Bax的表达取各组大鼠海马组织置于冰上操作,加入RIPA裂解液和蛋白酶抑制剂,充分研磨,静置裂解20 min,4 ℃12 000 r/min 离心15 min,取上清液进行BCA 定量。将处理后的蛋白样品与Loading buffer按比例混匀,变性条件:95 ℃,10 min。取样品总蛋白上样量50 μg,SDS 聚丙烯酰胺凝胶电泳→转膜→封闭→兔抗大鼠Bcl-2(1∶2 000)、兔抗大鼠Bax(1∶6 000)4 ℃孵育过夜。二抗(1∶10 000,HRP 标记)室温孵育1 h,ECL 显影,用BIO-RAD Gel Doc™XR + 成像系统观察拍照,Image J软件分析条带灰度值。
2.4.5 RT-PCR检测Caspase-3 mRNA取各组大鼠海马组织,Trizol 法提取总RNA,酶标仪测定RNA 浓度,参照试剂盒说明书进行逆转录,继而行PCR 扩增反应。反应条件:预变性95 ℃,10 min,循环条件:95 ℃,15 s→60 ℃,60 s(43 次循环),计算2-△△CT值。 引物序列为Caspase-3 上游:5' -GAAAGCCGAAACTCTTCATCAT-3' ,下游:5' -ATGCCATATCATCGTCAGTTCC-3',长度93 bp;βactin 上游:5'-TGCTATGTTGCCCTAGACTTCG-3',下游:5' -GTTGGCATAGAGGTCTTTACGG-3' ,长度240 bp。均由谷歌生物公司合成。
2.5 统计学方法
采用SPSS 26.0 对数据进行分析,计量资料采用均数± 标准差(xˉ±s)表示。组间比较采用单因素方差分析,符合方差齐性用LSD 法,不符合方差齐性采用Dunnet's T3 法检验,P<0.05 代表差异有统计学意义。
3 结果
3.1 各组大鼠Zea-Longa神经功能缺损评分比较
与假手术组相比,模型组大鼠Zea-Longa 评分明显升高(P<0.01);与模型组相比,依达拉奉组和健脾补土方各剂量组Zea-Longa 评分均降低(P<0.01,P<0.05)。见表1。
表1 各组大鼠神经功能缺损评分比较(±s,分)
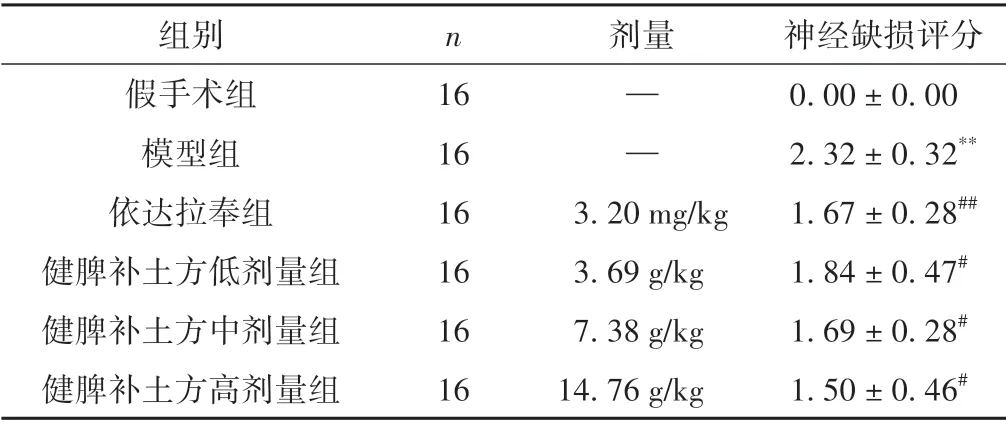
表1 各组大鼠神经功能缺损评分比较(±s,分)
注:与假手术组相比,**P <0.01;与模型组相比,#P <0.05,##P <0.01。
神经缺损评分0.00±0.00 2.32±0.32**1.67±0.28##1.84±0.47#1.69±0.28#1.50±0.46#组别假手术组模型组依达拉奉组健脾补土方低剂量组健脾补土方中剂量组健脾补土方高剂量组n 剂量16 16 16 16 16 16——3.20 mg/kg 3.69 g/kg 7.38 g/kg 14.76 g/kg
3.2 各组大鼠缺血侧脑皮质区神经细胞AI比较
与假手术组相比,模型组神经细胞AI 明显升高(P<0.01);与模型组相比,依达拉奉组及健脾补土方各剂量组神经细胞AI 明显降低(P<0.05)。见图1、表2。
表2 各组大鼠神经细胞凋亡指数比较(±s,%)
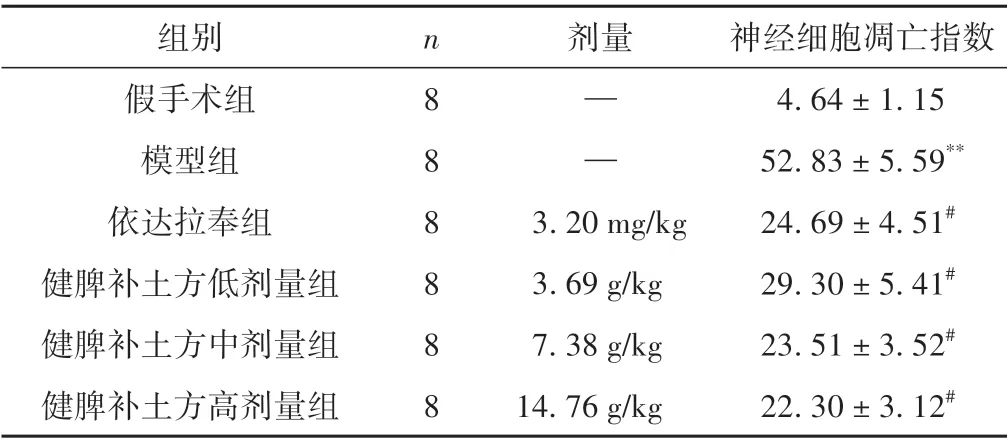
表2 各组大鼠神经细胞凋亡指数比较(±s,%)
注:与假手术组相比,**P <0.01;与模型组相比,#P <0.05。
组别假手术组模型组依达拉奉组健脾补土方低剂量组健脾补土方中剂量组健脾补土方高剂量组神经细胞凋亡指数4.64±1.15 52.83±5.59**24.69±4.51#29.30±5.41#23.51±3.52#22.30±3.12#n888888剂量——3.20 mg/kg 3.69 g/kg 7.38 g/kg 14.76 g/kg
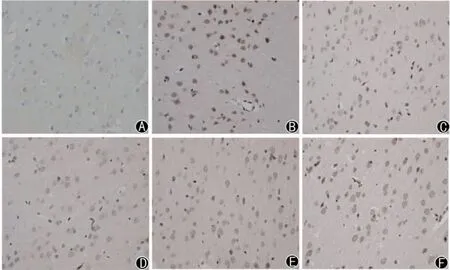
图1 各组大鼠神经细胞凋亡指数比较(TUNEL法,×400)
3.3 各组大鼠缺血侧脑组织海马区FN、LN 表达比较
与假手术组相比,模型组FN、LN 表达明显下调(P<0.01);与模型组比较,依达拉奉组和健脾补土方各剂量组FN、LN 表达明显上调(P<0.05,P<0.01)。见表3、图2、图3。
表3 各组大鼠FN、LN蛋白表达比较(±s)
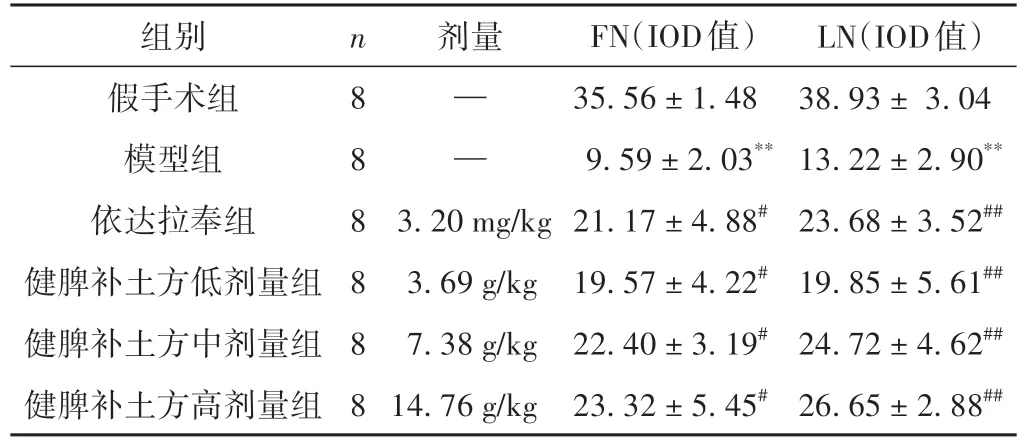
表3 各组大鼠FN、LN蛋白表达比较(±s)
注:与假手术组相比,**P <0.01;与模型组相比,#P <0.05,##P <0.01。
剂量——组别假手术组模型组依达拉奉组8健脾补土方低剂量组健脾补土方中剂量组健脾补土方高剂量组LN(IOD值)38.93± 3.04 13.22±2.90**23.68±3.52##19.85±5.61##24.72±4.62##26.65±2.88##n88888 3.20 mg/kg 3.69 g/kg 7.38 g/kg 14.76 g/kg FN(IOD值)35.56±1.48 9.59±2.03**21.17±4.88#19.57±4.22#22.40±3.19#23.32±5.45#

图2 各组大鼠FN蛋白表达比较(免疫组化法,×400)
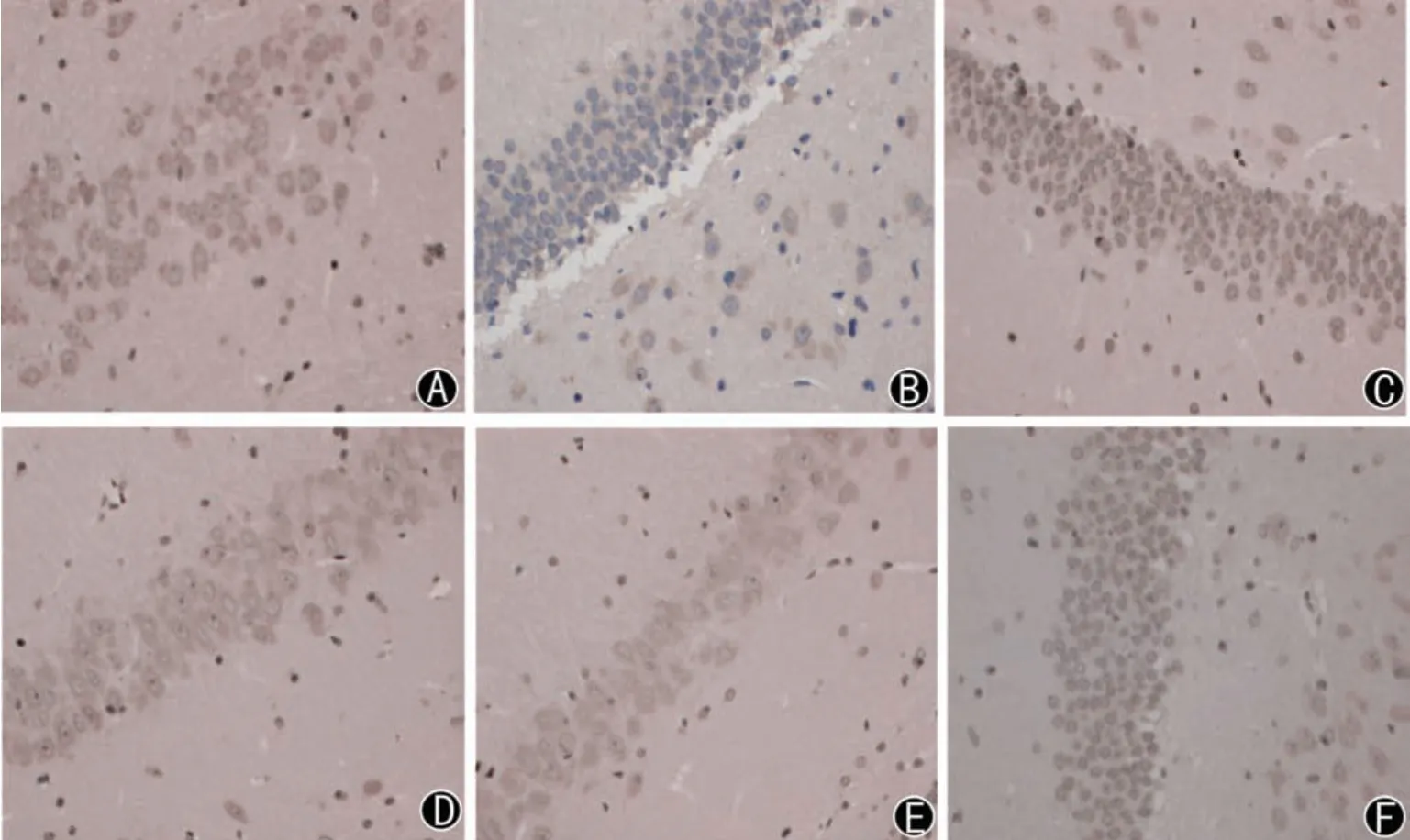
图3 各组大鼠LN蛋白表达比较(免疫组化法,×400)
3.4 各组大鼠缺血侧脑组织海马区Bcl-2、Bax 蛋白表达比较
与假手术组相比,模型组Bal-2 蛋白表达显著下调(P<0.01),模型组Bax 蛋白表达明显上调(P<0.01),Bcl-2/Bax比值显著降低(P<0.01);与模型组相比,依达拉奉组和健脾补土方各剂量组Bal-2 蛋白表达显著增加(P<0.05),Bax 蛋白表达明显下调(P<0.05),Bcl-2/Bax 比值显著升高(P<0.01)。见图4、表4。
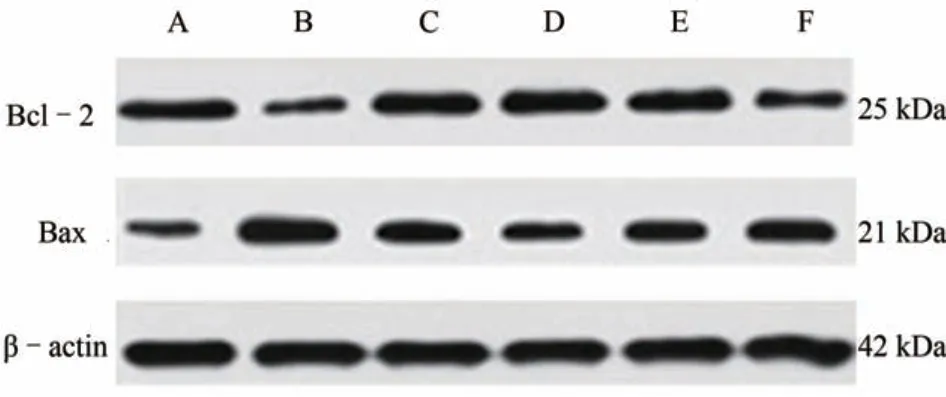
图4 各组大鼠Bcl-2、Bax蛋白表达比较
表4 各组大鼠Bcl-2、Bax蛋白表达比较(±s)
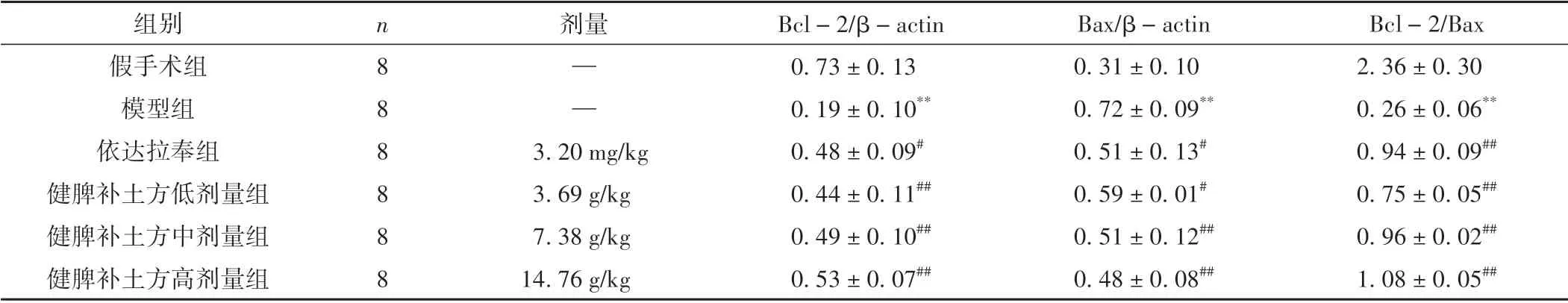
表4 各组大鼠Bcl-2、Bax蛋白表达比较(±s)
注:与假手术组相比,**P <0.01;与模型组相比,#P <0.05,##P <0.01。
组别假手术组模型组依达拉奉组健脾补土方低剂量组健脾补土方中剂量组健脾补土方高剂量组Bcl-2/Bax 2.36±0.30 0.26±0.06**0.94±0.09##0.75±0.05##0.96±0.02##1.08±0.05##n888888剂量——3.20 mg/kg 3.69 g/kg 7.38 g/kg 14.76 g/kg Bcl-2/β-actin 0.73±0.13 0.19±0.10**0.48±0.09#0.44±0.11##0.49±0.10##0.53±0.07##Bax/β-actin 0.31±0.10 0.72±0.09**0.51±0.13#0.59±0.01#0.51±0.12##0.48±0.08##
3.5 各组大鼠缺血侧脑组织海马区Caspase-3 mRNA比较
与假手术组相比,模型组Caspase-3 mRNA 水平显著升高(P<0.01);与模型组比较,依达拉奉组和健脾补土方各剂量组Caspase-3 mRNA的表达水平明显降低(P<0.05)。见表5。
表5 各组大鼠Caspase-3 mRNA表达比较(±s)
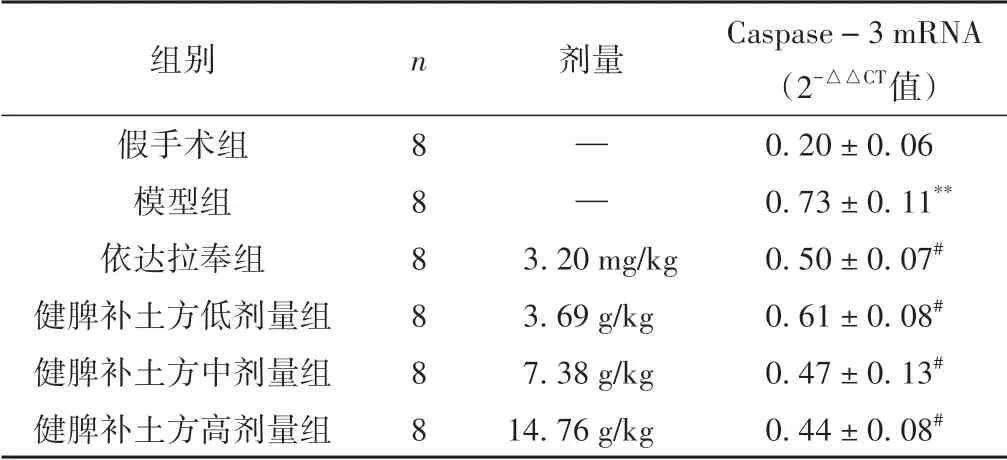
表5 各组大鼠Caspase-3 mRNA表达比较(±s)
注:与假手术组相比,**P <0.01;与模型组相比,#P <0.05。
组别假手术组模型组依达拉奉组健脾补土方低剂量组健脾补土方中剂量组健脾补土方高剂量组Caspase-3 mRNA(2-△△CT值)0.20±0.06 0.73±0.11**0.50±0.07#0.61±0.08#0.47±0.13#0.44±0.08#n888888剂量——3.20 mg/kg 3.69 g/kg 7.38 g/kg 14.76 g/kg
4 讨论
缺血性卒中是一个复杂的级联反应,易破坏血脑屏障,造成严重的脑损伤并引起神经细胞凋亡[9],CIRI是缺血性脑卒中后血流恢复灌注,脑内代谢失偿,进而导致缺血性脑卒中后神经细胞加重损伤的主要原因之一。故深入研究脑缺血再灌注的病理机制,寻找促进神经元保护和脑功能恢复作用的药物对治疗缺血性脑卒中具有重要意义。
脑缺血再灌注损伤后,ECM 降解,黏附分子损伤,神经细胞脱离ECM,不能维持机体动态平衡从而发生神经细胞失巢凋亡。FN 和LN 是组成ECM 中非胶原糖蛋白的重要部分,在各种神经元中介导细胞黏附,介导轴突沿机制桥生长,使神经纤维定向生长,并能保持血脑屏障的完整性[6,10]。Caspase-3 是目前公认的凋亡关键蛋白酶和细胞凋亡过程中的终末执行酶,是细胞凋亡的最终共同途径[11]。Bcl-2是在细胞凋亡的早期环节通过控制信号转导途径来抑制细胞凋亡。Bax可增强线粒体通透性,释放线粒体中的凋亡相关分子Apaf-1 激活Caspase,促进细胞凋亡[12]。LI 等[13]发现舒血宁注射液可通过调节Bcl-2/Bax 比值,阻断Caspase-3的激活,抑制海马神经元凋亡,可有效改善缺血性中风后的脑损伤。研究发现神经ECM 相关分子与凋亡蛋白关系密切。韦德英等[14]研究发现,FN 可提高Bcl-2/Bax 的比值,减少Caspase-3 的表达水平。葛风等[15]研究发现,通过Caspase-3 基因可显著促进LN-18人神经胶质瘤细胞凋亡。
根据取类比象法,脾属土,“土主承载”,神经ECM为神经细胞提供力学支持和物质强度[5],介导神经细胞之间的黏附作用,保持神经系统结构的完整性,故本研究采用健脾补土方,以四君子汤为基础,添加山药、薏苡仁和黄芪[16],显著增加健脾补土益气功效,这是本方通过调节神经ECM抗脑缺血再灌注损神经细胞凋亡作用的物质基础。通过前期研究发现,四君子汤可显著上调脑缺血再灌注后p-ERK1/2 和p-Akt 的蛋白含量,增加Bax的表达,加强神经细胞与ECM的黏附程度,抑制凋亡[17];加味四君子汤可通过稳定神经ECM 纤维蛋白-5(Fibulin-5)的表达,显著促进ECM与细胞之间的黏附作用,从而有效保护神经细胞[18];健脾补土方可抑制基质金属蛋白酶-9(MMP-9)和基质金属蛋白酶-2(MMP-2)的表达,减少LN 降解[19-20];下调组织型纤溶酶原激活物(t-PA)的可抑制纤溶系统活性,促进人Ⅳ型胶原(Col Ⅳ)、整合素相关激酶(ILK)、整合素β3和局部黏着斑激酶(FAK)的蛋白表达,减少ECM降解,从而改善脑缺血再灌注后的神经细胞损伤[16,21]。
本研究发现,当脑缺血再灌注后,大鼠神经功能受损,神经ECM降解,继而发生失巢凋亡。健脾补土方的干预可显著改善脑缺血再灌注后的神经功能缺损,降低神经细胞凋亡指数,上调神经ECM中FN、LN的表达,增强神经细胞间的黏附作用,增加Bcl-2的表达,增强神经细胞对损伤因子的抵抗性,从而降低促凋亡蛋白Bax的表达,下调Caspase-3 mRNA的表达,抑制凋亡。
综上,健脾补土方可通过调节神经ECM,减少FN、LN 的丢失,增加ECM 的黏附,抑制神经细胞的凋亡,从而保护神经细胞,减轻CIRI 模型大鼠的神经功能缺损情况,对抗脑缺血损伤。

