DC-CIK逆转卵巢癌耐药细胞SKOV3/DDP多药耐药的研究
蔡朝辉 杨丽 陶丽丽 韩伟 王伟杰 陈梅
1唐山工人医院妇产科 河北唐山 063000;2唐山市疾病预防控制中心
卵巢癌是全球范围内女性癌症死亡的第五大原因,是病死率最高的妇科肿瘤[1-2]。卵巢癌发病较为隐匿,约75%患者就诊时已经发展为晚期[3],肿瘤细胞减灭术配合以铂类药物为主的化疗是目前常规治疗方案,绝大多数患者化疗效果良好,但复发率较高,可达60%;且50%出现耐药[4]。肿瘤细胞的多药耐药性(multidrug resistance,MDR)是影响卵巢癌化疗效果的主要因素;因此,寻找逆转耐药的方法以提高化疗疗效已成为研究热点及难点。利用免疫机制逆转肿瘤耐药发展迅速,免疫治疗能够提高患者的免疫功能,杀死或抑制肿瘤细胞,不良反应小,已逐渐成为继手术、化疗、放疗后的第四种恶性肿瘤的治疗方法[5]。其中过继性细胞免疫疗法(adoptive cellular immunotherapy,ACI)是生物疗法的重要组成部分,细胞因子诱导的杀伤细胞(cytokine-induced killer,CIK)是该疗法中新型效应T细胞,树突状细胞(dendritic cell,DC)是目前已知的功能最强的抗原提呈细胞。DC-CIK过继免疫治疗方法在肺癌、胃癌、卵巢癌等肿瘤的综合治疗中,提高了患者的免疫功能,延长其生存时间,取得了良好的治疗效果[6]。本实验以健康人外周血来源的DC-CIK为效应细胞,研究其对卵巢癌耐药细胞株SKOV3/DDP的逆转耐药作用及对耐药基因MDR1的影响。
1 材料与方法
1.1材料
1.1.1细胞来源 人卵巢癌细胞株SKOV3及其耐药株SKOV3/DDP由唐山市工人医院唐山市临床分子诊断与治疗重点实验室惠赠。
1.1.2主要试剂 RP1640培养基、磷酸盐缓冲液PBS(BI),青霉素链霉素混合液,0.25%胰蛋白酶-EDTA(北京博奥拓达公司),GT-551培养基(天津百若克医药生物技术公司),胎牛血清(PAN-Biotech);人淋巴细胞分离液(天津灏洋生物制品科技有限责任公司);IFN-γ(γ干扰素)、IL-4(白细胞介素-4)、GM-CSF(重组人粒细胞巨噬细胞集落刺激因子)、TNF-α(炎症因子-α)、IL-2(白细胞介素-2)、IL-1α(白细胞介素-1α)、CD3单抗(PeproTech公司);Trizol(ambion公司),顺铂(Sigma),CCK试剂盒(北京庄盟国际生物基因科技有限公司);Takra Real-timeRT-PCR反转录试剂盒(大连宝生物有限公司);PCR引物由invitrogen公司合成。
1.1.3主要仪器 CO2培养箱(Panasonic公司),流式细胞仪(Becton Dickinson公司),PCR仪(Applied Biosystems公司),通用酶标仪(Biotek公司),低温高速离心机(Thermo公司),倒置显微镜(Nikon公司)。
1.2方法
1.2.1SKOV3及SKOV3/DDP细胞培养 将SKOV3及SKOV3/DDP复苏,用含10%胎牛血清和青霉素链霉素各100U/mL的RP1640培养基重悬,置于5%CO2,37℃培养箱中培养,细胞长满瓶底70%~80%时进行1:2或1:3传代。
1.2.2效应细胞DC和CIK的诱导与培养1.2.2.1采集外周血单核细胞(PBMC) 采集健康人外周血,肝素抗凝,加入外周血淋巴细胞分离液(Ficoll),采用梯度密度离心法获得PBMC,洗涤离心后用无血清培养基GT-551重悬PBMC,调整细胞密度为4×106/mL,孵箱培养2h。
1.2.2.2CIK的诱导与培养 收集非贴壁细胞,调整细胞浓度为1~2×106/mL,即时加入IFN-γ(50ng/mL),24h后加入CD3单抗(50ng/mL)、IL-2(30ng/mL)以及IL-1α(100U/mL),之后每2~3d补加含有IL-2(30ng/mL)的GT-551培养基,培养至第8d。
1.2.2.3DC的诱导与培养 贴壁细胞中加入含GM-CSF(100ng/mL)和IL-4(20ng/mL)的GT-551培养基,隔日补加含等量细胞因子的新鲜培养基,第6天加TNF-α(20ng/mL)刺激细胞成熟,第8d收获成熟DC。
1.2.2.4DC与CIK共培养 取分别培养8d的DC和CIK,计数后将CIK分成2组,一组加入DC(CIK:DC=5:1)混合培养,另一组单独培养,2~3d补加含IL-2的新鲜培养基,培养至第14d。
1.2.3细胞免疫表型检测方法 采用流式细胞技术检测培养至第8d的DC表面抗原CD83+、CD86+,及培养至第14d的CIK细胞表面抗原CD3+、CD3+CD56+,以判断细胞是否成熟。
1.2.4CCK法检测SKOV3/DDP经DC-CIK作用后对顺铂敏感性的变化
1.2.4.1效应细胞对靶细胞的杀伤作用 取对数生长期细胞SKOV3/DDP,调整细胞浓度为5×104/mL,每孔100μL铺于96孔板,贴壁后加入效应细胞CIK、DC-CIK,使效靶比分别为2.5:1、5:1、10:1、20:1、40:1,同时设置对照孔(单独靶细胞和单独效应细胞),设置4个复孔,置于培养箱培养24h后,每孔加20μL CCK-8,继续培养5h,终止培养,用酶标仪检测450nm处A值,利用公式IR=[1-(A效/靶-A效)/(A靶-A调零)]×100%计算杀伤率,并用线性回归计算IC10。
1.2.4.2检测靶细胞对顺铂敏感性的变化 取对数生长期细胞SKOV3/DDP,贴壁后分成3组,一组不加效应细胞,一组加CIK,一组加DC-CIK,效靶比为5:1(通过上述实验,计算出DC-CIK的IC10为5.75:1,对靶细胞基本无杀伤作用,故以5:1作为无毒剂量逆转耐药),分别记作SKOV3/DDP组、SKOV3/DDP+CIK组、SKOV3/DDP+DC-CIK组。每组加顺铂干预,浓度分别为1μg/mL、2μg/mL、4μg/mL、8μg/mL、16μg/mL、32μg/mL,置于培养箱中培养24h,每孔加20uL CCK试剂,继续培养5h,终止培养,用酶标仪检测450nm处A值,根据公式IR=[1-(A效/靶+顺铂-A效+顺铂)/(A靶-A调零)]×100%,计算各组细胞的抑制率,利用线性回归计算IC50(半抑制浓度),计算逆转倍数(RF)=耐药株IC50(不加效应细胞)/耐药株IC50(加效应细胞)。
1.2.5实时荧光定量RT-PCR检测MDR1基因表达
1.2.5.1实验分组及处理 4组分别为SKOV3组、SKOV3/DDP组、SKOV3/DDP+CIK组、SKOV3/DDP+DC-CIK组(效靶比均为5:1)。
1.2.5.2提取各组细胞总RNA 终止培养,冰上操作,弃旧培养液,PBS轻轻洗涤细胞2次,每孔细胞加1mL Trizol裂解,匀浆移至1.5mL无酶EP管,静置5min,待核酸和蛋白充分解离,每管加200μL氯仿,剧烈震荡15s,静置2~3min,4℃,12000r/min离心10min,吸取无色水相,加入等体积预冷的异丙醇,轻轻摇匀,静置10min。4℃,12000r/min离心10min,弃上清,加1mL 75%乙醇。4℃,10000r/min离心5min。弃上清,干燥RNA,加入DEPC水溶解RNA,-80℃保存。
1.2.5.3一步法RT-PCR 目的基因MDR1上游引物:5’-GAGCCTACTTGGTGGCACAT-3’,下游引物:5-CTTCCCGTGCTGTAGCTGTCA-3’,内参基因ACTB上游引物:5’-ATGATGATATCGCGCCGCGCTC-3’,下游引物:5’-TCGATGGGGTACTTCAGGGT-3’。PCR仪设定体系为20μL,对照组和实验组分别依照以下条件加样:2×one step SYBR RT-PCR Buffer Ⅲ10μL,Takra Ex Taq?倹uHS 0.4μL,Rox Reference Dye Ⅱ0.4μL,目的或内参基因上、下游引物各0.4μL,Total RNA2μL,RNase Free dH2O 6μL。设3个复孔,按照42℃、30min,95℃、3min,95℃、15s,共40个循环。60℃、1min进行PCR扩增,获取Ct值,设置溶解参数:95℃、15s,60℃、60min,95℃、15s,作溶解曲线以判定是否为特异性扩增。重复3次,根据2-△△Ct法统计数据,△Ct=Ct目的-Ct内参,△△Ct=△Ct实验-△Ct对照,对照组2-△△Ct为1,若实验组2-△△Ct>1提示MDR1表达量上升。
1.3统计学处理 应用SPSS 21.0软件进行统计学分析,两样本比较采用t检验,多样本比较采用方差分析,以P<0.05有统计学差异。
2 结 果
2.1DC及CIK细胞的形态 DC细胞:开始时细胞贴壁,呈圆形,第2~3d体积开始变大,部分细胞不规则,部分细胞悬浮,第3~6d悬浮细胞增多,部分细胞聚集成簇,第7~8d大部分细胞悬浮,呈现毛刺状不规则的典型DC细胞形态,见图1。CIK细胞:开始时细胞单个分布,体积较小,呈圆形,第3d开始明显增殖,细胞出现集落,第6~7d细胞体积开始增大,随培养时间的延长,集落增多,单个细胞也增多,细胞体积增大明显,见图2。DC与CIK共培养后细胞呈集落样生长。

图1 DC细胞(倒置显微镜,200×)

图2 CIK细胞(倒置显微镜,200×)
2.2DC及CIK的免疫表型 分别取培养第8d的DC细胞和第14d的CIK细胞,用流式细胞技术检测出(91.70±3.09)%的DC表面表达CD86+,见图3A,(55.66±5.13)%DC表达成熟的DC特异性表面标志CD83+,见图3B,CIK细胞表面CD3+CD56+达(56.63±6.21)%,见图3C,提示大部分DC及CIK已成熟。

图3 流式细胞技术检测细胞的免疫表型结果
2.3CIK细胞及DC-CIK细胞对SKOV3/DDP增殖的抑制作用 效应细胞分别以效靶比为2.5:1、5:1、10:1、20:1,40:1的浓度作用于SKOV3/DDP细胞,24h后,采用CCK法检测CIK细胞及DC-CIK细胞对SKOV3/DDP细胞的杀伤作用,结果显示随着效靶比的增加,CIK细胞及DC-CIK细胞对SKOV3/DDP的杀伤力逐渐增强,两组在2.5:1、5:1时抑制率与对照组相比,差异无统计学意义(P>0.05),在10:1、20:1、40:1时抑制率与对照组相比,差异有统计学意义(P<0.05);且在同一效靶比下,同源的DC-CIK细胞比CIK细胞的杀伤作用大,差异有统计学意义(P<0.05),结果见表1。通过线性回归计算出SKOV3/DDP对CIK和DC-CIK的IC10分别为7.68:1和5.75:1,故选择无毒剂量5:1作为逆转耐药剂量。

表1 不同效靶比下CIK细胞及DC-CIK细胞对SKOV3/DDP的抑制率(%)
2.4经效应细胞干预后的SKOV3/DDP细胞对顺铂敏感性的变化 无毒剂量的CIK细胞和DC-CIK细胞作用于SKOV3/DDP细胞后,设置顺铂浓度分别为1μg/mL、2μg/mL、4μg/mL、8μg/mL、16μg/mL、32μg/mL作用于下列各组细胞:SKOV3/DDP、SKOV3/DDP+CIK、SKOV3/DDP+DC-CIK,顺铂对各组细胞的抑制率结果见表2。顺铂对SKOV3/DDP的抑制作用通过线性回归计算出IC50为22.33μg/mL。SKOV3/DDP经过无毒剂量CIK、DC-CIK预处理后再加入不同浓度的顺铂作用24h,SKOV3/DDP+CIK组和SKOV3/DDP+DC-CIK组的IC50分别降至14.31μg/mL、11.89μg/mL,根据公式计算出逆转倍数分别为1.56倍和1.96倍,结果见图4。

表2 不同浓度顺铂对不同组SKOV3/DDP细胞的抑制率

图4 顺铂对SKOV3/DDP细胞的抑制作用
2.5各组细胞中MDR1 mRNA的表达情况 以敏感株SKOV3细胞的MDR1表达量为参照,SKOV3/DDP组、SKOV3/DDP+CIK组及SKOV3/DDP+DC-CIK组中的MDR1表达量比SKOV3组高,表达量分别为(21.498±3.744)、(11.248±3.806)、(7.554±1.821),差异有统计学意义(F=23.825,P=0.000);后两组MDR1表达量较未经处理的SKOV3/DDP组均下降,且经DC-CIK作用的细胞MDR下降更明显,差异有统计学意义(t=2.316,P=0.047),见图5。
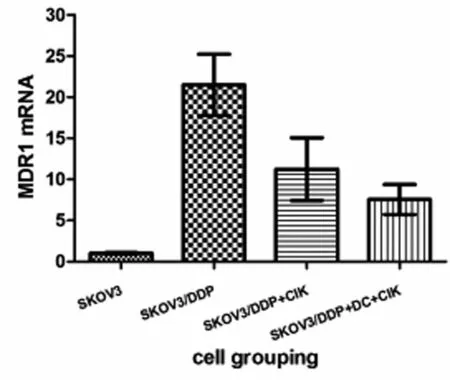
图5 各组细胞中MDR1相对表达含量
3 讨 论
卵巢癌的耐药机理复杂,其中MDR1/P-gp介导的经典耐药机制是卵巢癌耐药的主要机制之一,MDR1是最早发现的多药耐药基因,定位于人常染色体7q21,它编码的蛋白产物P-gp是依赖ATP的跨膜离子转运泵,当化疗药物进入细胞时,P-gp与药物相结合,ATP参与供能,将药物从细胞内排出,降低细胞内的药物浓度从而引起MDR[7-8]。
CIK细胞是以CD3+CD56+为主的异质细胞群,具有NK细胞非MHC限制性和T淋巴细胞广泛的抗肿瘤活性的特点[9]。CIK细胞在人外周血含量极少,但是经过体外添加相应细胞因子培养后,可获得大量扩增[10]。研究证实CIK主要来源于CD4-CD8+T细胞,CD8+T细胞又称为细胞毒性T淋巴细胞(cytotoxic T lymphocyte, CTL),因此有研究者推测CIK的抗肿瘤机制与CTL相似,CIK细胞可能通过黏附分子LFA-1/ICM-1相互结合后,分泌含大量的BLT酯酶的细胞质颗粒,该颗粒在Ca+作用下穿透封闭的靶细胞膜,进行胞吐作用,使肿瘤细胞裂解[11]。另有学者认为CIK杀伤卵巢癌细胞主要通过NKG2D途径释放穿孔素(perfornin))直接穿透封闭的靶细胞进行作用,直接杀伤肿瘤细胞[12]。另一方面,CIK可以通过多种机制诱导细胞凋亡、坏死,其中以Fas/FasL途径为主,CIK高表达FasL从而增强免疫细胞杀伤力,抑制肿瘤免疫逃逸,但某些肿瘤可以通过FasL介导CTL和TIL的凋亡进而逃脱免疫清除,但是对CIK敏感,使得CIK可以对肿瘤细胞进行有效杀伤[13]。此外,CIK可以分泌IFN-γ、TNF-α、IL-2 以及IL-12等,提高其细胞毒性[14]。
DC细胞作为功能最强的抗原提呈细胞,可有效激活效应T细胞,使机体产生肿瘤免疫反应[15]。DC细胞也可凭借肿瘤坏死因子相关凋亡配体TRAIL及TNF家族配体的协同作用直接杀伤肿瘤细胞[13]。本研究的杀伤实验中,CIK组和DC-CIK组对SKOV3/DDP均有明显的杀伤作用,且DC-CIK组对SKOV3/DDP的杀伤活性要高于CIK组。DC-CIK共培养后抗肿瘤作用增强,其机制可能为:DC-CIK共培养可以增加DC细胞表面CD80、CD86、CD40的表达,同时细胞上清IFN-γ、IL-12分泌量明显增多,增加了DC和共刺激分子呈递抗原的特异性[16];DC可以促进CIK的增殖,从而获得多的免疫细胞,且CIK细胞表型CD3+、 CD3+CD4+、CD3+CD8+以及 CD3+CD56+百分比增加,CIK细胞的细胞毒性作用明显提高[17-18]。
除了对非耐药恶性肿瘤细胞的杀伤作用明显外,CIK细胞对多种耐药的实体恶性肿瘤细胞以及血液肿瘤细胞的杀伤作用更强,并有逆转其耐药性的作用。蒋东霞等[19]从耐药基因MDR1与其编码的蛋白P-gp为切入点,发现CIK对P-gp呈高表达的耐药细胞K562/ARD具有特异的细胞毒作用,下调P-gp的表达,有效提高了K562细胞内ARD的浓度,使免疫效应细胞在体外的逆转耐药作用得到显现。张辉等[20]发现CIK可以将耐药细胞SKOV3/DDP阻滞于S期和G2M期,并诱导其凋亡,同时逆转SKOV3/DDP细胞的相关耐药基因MDR1和TopⅡ-β的表达。王亚军等[21]研究发现CIK细胞可以部分逆转SKOV3/DDP细胞对DDP的耐药性,其作用机制可能与ERCC1表达下调有关。
本实验中,我们用人外周血来源的DC细胞和CIK细胞共培养,将效应细胞CIK及DC-CIK分别以效靶比5:1作用于人卵巢癌耐药细胞SKOV3/DDP后,CCK法检测不同浓度顺铂对SKOV3/DDP的杀伤率,相对于无CIK和DC-CIK预处理的SKOV3/DDP组,对顺铂的IC50由22.33μg/mL下降到14.31μg/mL、11.89μg/mL,证实了CIK和DC-CIK能够逆转人卵巢癌耐药细胞SKOV3/DDP的多药耐药性,且DC-CIK作用明显。采用RT-PCR检测结果表明人卵巢癌耐药细胞株SKOV3/DDP的耐药基因MDR1远高于SKOV3,经过CIK和DC-CIK作用后,MDR1基因表达下降,且DC-CIK组下降更明显,说明DC-CIK细胞可能通过下调SKOV3/DDP耐药基因MDR1来逆转其耐药性。

