高同型半胱氨酸血症人群的肠道菌群特征研究
赵梓汝,李业荣,贾海英,王珍,胡峰,孟令军,刘彧
1.中央广播电视总台办公厅医疗保障处,北京 100859;2.中国人民解放军战略支援部队特色医学中心特勤健康管理科
肠道微生物在人体内部形成庞大而复杂的微生态系统,在调控多种肠道内外疾病风险中起着至关重要的作用,尤其对腹腔疾病、代谢综合征、心血管疾病和肥胖等有着较大的影响[1]。目前,国内外对人体内同型半胱氨酸(Hcy)水平与肠道菌群结构和相关益生菌丰度之间联系的研究欠缺,有限的相关研究也主要来自啮齿动物实验。有研究表明,补充益生菌可减轻高Hcy引起的损伤,改善尿毒症者的肠上皮屏障功能[2]。高蛋氨酸饮食会改变小鼠肠道菌群,增加拟杆菌门(Bacteroidetes)和卟啉单胞菌科(Porphyromonadaceae)细菌的相对丰度[3]。通过限制饮食中的蛋氨酸摄入,可以提升小鼠肠道菌群中一些能产生短链脂肪酸(SCFA)的细菌种群丰度,并同时减少一些产生脂多糖(LPS)和促炎的菌群丰度[4]。
本研究采用Illumina Hiseq 2500高通量基因测序平台的16S rRNA测序技术对20例高Hcy组和37例健康对照组的粪便细菌基因组进行分析,探讨Hcy水平与肠道微生物组结构的联系,为深入研究人体内Hcy和肠道菌群分布特征提供参照,并为高Hcy相关疾病的致病因素研究和相关益生菌治疗提供证据。
1 对象与方法
1.1 研究对象 本研究共纳入2019年10月至2020年10月在中国人民解放军战略支援部队特色医学中心体检的57例志愿者,将受试者严格分为高Hcy组和健康对照组,其中20例Hcy水平较高成年人群为高Hcy组,37例为同期在该院体检的Hcy正常的成年健康人群为健康对照组。纳入标准:年龄范围18~63岁,常住地为北京市。排除标准:胃肠道疾病等严重肠道菌群紊乱病史者,6个月内服用过抗生素或益生菌等影响肠道菌群结构的药物者。本研究经过中国人民解放军战略支援部队特色医学中心伦理委员会审查和批准,并得到全部研究对象书面的知情同意。
1.2 检测方法
1.2.1 粪便样本采集及DNA提取 在体检时使用无菌器皿收集57例研究对象的新鲜粪便样品5.0 g,置于无菌冷冻试管中,封口后于1 h内送至中国科学院微生物研究所实验室中,称取2.00 g粪便,余置于-80 ℃超低温冰箱内保存。提取样本总DNA,DNA提取通过Kit KAPA HiFi HotStart DNA Polymerase试剂盒进行,使用VORTEX-5涡旋振荡器结合QMGEN Vonex适配器按照操作手册流程完成核酸纯化(组织样本选择使用组织匀浆仪)。使用Nano Drop查看核酸的纯度和浓度,将DNA样品存放于-80 ℃冰箱中保存备用。
1.2.2 高同型半胱氨酸血症(HHcy)标准 根据HHcy诊疗专家共识[5]:参照成人HHcy共识标准,及共识中我国成人血正常值在13~14 μmol/L之间,将血Hcy≥15 μmol/L者纳入高Hcy组。
1.2.3 16S rRNA基因测序 将检测合格的微生物DNA样本按指定区域进行PCR扩增、文库制备、文库质检、定量,使用设定的TAG序列进行样本区分。采用Illumina Hiseq 2500高通量测序平台对检测合格的文库进行测序。第1次扩增时,使用16S rRNA V3-V4区的通用引物[338F(5′-ACTCCTACGGGAGGCAGCAG-3)和806R (5′-GGACTACHVGGGTWTCTAAT-3′)]进行扩增,纯化后,进行第2次扩增,引入index序列,文库均一化后进行上机测序。根据barcode序列区分样本,提取的数据以标准fastq格式保存。根据PE reads之间的overlap采用Flash软件对数据进行拼接,对原始测序数据进行数据清洗,分析数据只保留高质量(Q值≥25)的碱基比例大于等于90%的reads,否则舍弃。采用QIIME软件中的usearch 8.0软件进行嵌合体序列的检测及过滤。
1.3 生物信息学分析
1.3.1 物种分类与丰度分析 将原始数据拼接、过滤、去嵌合体后,留下有效TAG。根据97%的序列相似性水平,利用QIIME软件包中的Uclust方法进行Operational Taxonomie Units(OTU)聚类分析。
基于Silva参考数据库,对每个样品的OTUs进行物种分类学(Taxonomy)注释,对样本肠道菌群分别进行物种组成和分类分析。
1.3.2 α多样性分析 α多样性是指一个特定区域或生态系统内的多样性。多样性指数是反映样本中微生物丰富度和均匀度的综合指标。本研究根据OTU丰度表,分别检测并计算2组样品中物种数量、菌群丰度Chao指数、多样性指数Shannon指数及Simpson指数,对人群的肠道菌群群落进行α多样性分析。Chao指数越大,表示样本中微生物物种数量越多,Shannon指数越大、Simpson指数越小,表示样本中微生物群落多样性越高。
1.3.3 β多样性分析 β多样性分析是对不同样本的微生物群落构成进行比较分析。根据归一化的OTU丰度表进行PCoA主坐标分析,对肠道菌群丰富度和均匀度进行β多样性分析。
1.3.4 LEfSe差异分析 使用LEfSe(LDA Effect Size)分析来探究高Hcy组和健康对照组肠道菌群之间丰度差异特征,并找到与丰度有统计学差异的类群,同时采用线性判别分析(LDA)来估算不同物种丰度对组间差异效果影响的大小,判定差异的物种。
1.4 统计学方法 使用R软件包进行统计分析,对组间差异进行t检验或wilcoxon rank sum test,P<0.05为差异有统计学意义。
2 结果
2.1 2组人群特征描述 高Hcy组和健康对照组年龄分别为(50.0±8.0)岁和(49.2±6.3)岁,差异无统计学意义(P>0.05)。高Hcy组男性占100%,健康对照组男性占78.4%。在健康体检人群中女性HHcy者较少。
2.2 样品测序数据分析 57份粪便样品肠道菌群16S rRNA测序数据经数据过滤和嵌合体序列检测并去除后,共得到5 499 806条有效序列,总样品平均有效序列为96 487.82条,样本的Q20均在90%以上。选择相似水平为97%的OTU,获得的OTU总数为2 006个,其中2组共有的OUT为994个,高Hcy组有特有的属5个,健康对照组有特有的属13个。
2.3 α多样性分析 所有样本的肠道菌群α多样性分析箱形图见图1。以Hcy-H表示高Hcy组样本,以Hcy-L表示Hcy正常的健康对照组样本。α多样性分析结果显示,高Hcy组样本肠道菌群的微生物物种数量多于健康对照组,但并未显示出明显区别(P=0.20)。其他多样性指数上,仍表现为高Hcy组样本高于健康对照组,但未显示出统计学差异(P>0.05),表示2组间的肠道菌群多样性无明显差异,仅表现为随同型半胱氨酸升高而增加的趋势。
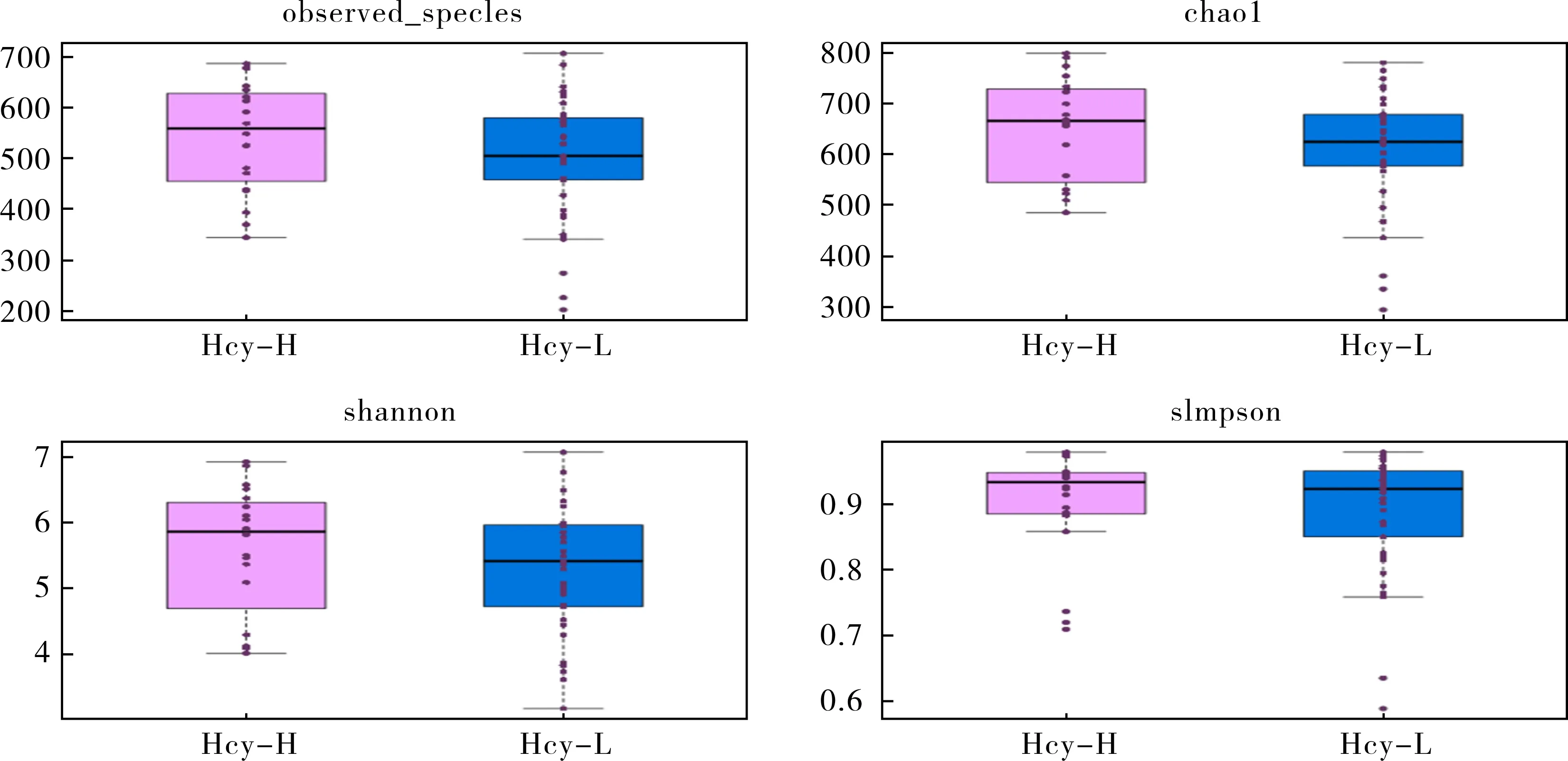
图1 α多样性分析箱形图
2.4 β多样性分析 所有样本的肠道菌群β多样性分析主坐标分析PCoA图,见图2。基于系统发育树未加权的Unifrac距离矩阵主坐标分析,高Hcy组样本之间物种丰度和构成较远,而健康对照组样本之间的关系则更近。高Hcy患者肠道菌群结构与健康对照组人群肠道菌群结构有一定的差异,但差异无统计学意义(P>0.05)。
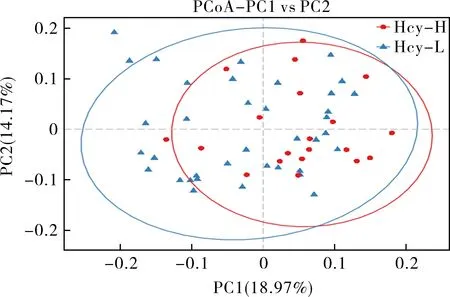
图2 未加权Unifrac主坐标分析的PCoA图
2.5 群落相对丰度 高Hcy组和健康对照组之间粪便菌群组成有一定差异。图3为在门水平的肠道菌群相对丰度柱状图,展示了所占丰度比重前15的物种。数据显示,拟杆菌门(Bacteroidetes)在高Hcy组和健康对照组中都占据最大的比重,分别占全部肠道菌群的46.43%和49.48%,但2组之间差异无统计学意义(W=308,P>0.05)。其次是厚壁菌门(Firmicutes),分别占41.51%和37.65%,2组之间差异也无统计学意义(W=441,P>0.05)。其余细菌按相对丰度比重大小为变形菌门(Proteobacteria),分别占7.39%和6.04%,2组之间差异无统计学意义(W=303,P>0.05)、放线菌门(Actinobacteria),占4.01%和4.27%,2组之间差异无统计学意义(W=268,P>0.05)、梭杆菌门(Fusobacteria),占0.11%和1.40%,2组之间差异有统计学意义(W=498.5,P<0.05)、疣微菌门(Verrucomicrobia),占0.3%和0.98%,2组之间差异无统计学意义(W=255.5,P>0.05)、蓝细菌(Cyanobacteria)占0.05%和0.03%,2组之间差异无统计学意义(W=344,P>0.05)。故在门水平,仅梭杆菌门的丰度在健康对照组肠道菌群中显著高于高Hcy组样本。
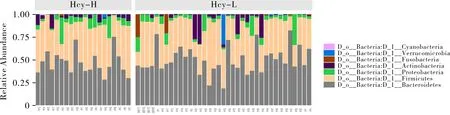
图3 门水平肠道菌群群落结构柱状图
肠道菌群的微生物组成展现出一定的个体差异,尤其在健康对照组中,如拟杆菌门在样本中所占比重最高达81.93%,最低为18.40%,该最大最小值皆出现在健康对照组中。厚壁菌门在样本中所占比重最大值为73.74%,最小值为15.20%,也出现在健康对照组中。
在基于属水平的相对丰度分析显示,属水平上丰度较高的细菌在2组之间有较大差异。占全部肠道菌群比重最大的是拟杆菌属(Bacteroides),在高Hcy组样本中占35.19%,在健康对照组中占29.11%,2组之间差异无统计学意义(W=431,P>0.05)。其后依次是普雷沃氏菌属(Prevotella9)、粪杆菌属(Faecalibacterium)、布劳特氏菌属(Blautia)、双歧杆菌属(Bifidobacterium)、毛螺菌属(Lachnospira),各属2组之间均差异无统计学意义(P>0.05),Fusicatenibacter在高Hcy组中占2.46%,在健康对照组中占1.31%,2组之间差异有统计学意义(W=596,P<0.01),大肠杆菌志贺氏菌(Escherichia-Shigella)在高Hcy组中占2.24%,在健康对照组中占1.16%,2组之间差异有统计学意义(W=515,P<0.05),罗斯氏菌属(Roseburia)在高Hcy组中占1.09%,在健康对照组中占1.86%,2组之间差异有统计学意义(W=538,P<0.01),而直肠真杆菌(Eubacteriumrectalegroup)、另枝菌属(Alistipes)、考拉杆菌属(Phascolarctobacterium)、巨单胞菌属(Megamonas)、狄氏副拟杆菌(Parabacteroides)、巴恩斯氏菌属(Barnesiella)各属2组之间均差异无统计学意义(P>0.05)。故在属层次,Fusicatenibacter、大肠杆菌志贺菌、罗斯氏菌属在高Hcy组样本中的丰度均显著高于健康对照组。其余属并未在2组之间表现出具有统计学意义的平均丰度差异。
2.6 LEfSe差异分析 使用线性判别分析(LDA)和进化分支图来探究LEfSe(LDA Effect Size)差异分析(图4)。结果显示,在OTU水平上,高Hcy组和健康对照组样本的微生物群的优势种群和系统发育分布都存在一定差异。图4左图为针对高Hcy组和健康对照组中具有>2.0的差异丰度的特征计算的LDA值分布柱状图(log10),右图为进化分支图,以不同颜色表示了在2组样本组中起到重要作用的微生物类群。根据设置的LDA值标准,在高Hcy组的肠道菌群中,共有13种有显著差异的细菌展现出较高的影响力,分别为普雷沃氏菌科(Prevotellaceae)、巨单胞菌属(Megamonas)、副萨特氏菌属(Parasutterella)、柯林斯氏菌属(Collinsella)、红椿杆菌纲(Coriobacteriia)、拟普雷沃菌属(Alloprevotella)、球肠菌科(Enterococcaceae)、脱硫弧菌属(Desulfovibrio)和瘤胃球菌(RuminococcusGauvreauiiGroup)。
高Hcy组肠道菌群中最丰富的差异菌群主要为普雷沃氏菌属(Prevotella9)和巨单胞菌属(Megamonas)(LDA值>3)。在健康对照组中,共有11属显著差异的细菌展现出较大的影响,其中最占优势的主要差异细菌类群为艾克曼菌(Akkermansia)和疣微菌属(Verrucomicrobiaceae)(LDA值>3)。
LEfSe分析生成的进化分支图(图4右图),显示了2组样品群落中由门至属的分类级别上,丰度差异最大的细菌类群。
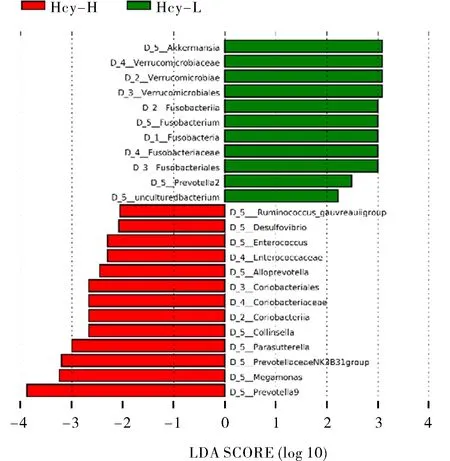
图4 通过LDA分数和LEfSe分析对高Hcy组和健康对照组的肠道菌群进行表征:黄色圈表示无显著差异的物种,红色圈表示高Hcy组样本中起到重要作用的微生物类群,绿色圈表示健康对照组中起到重要作用的微生物类群,圈的直径大小与相对丰度大小成正比
3 讨论
研究证实肠道菌群与人体能量代谢和多种慢性疾病有密切关系。本研究对高Hcy组和健康对照组肠道菌群样本进行16S rRNA测序分析,以检测其核心细菌分布,最终发现高Hcy组的肠道菌群与健康人群相比,有多种细菌在高Hcy组肠道菌群中有着与健康对照组明显不同的丰度。在门层次,放线菌门、梭杆菌门和疣微菌门的丰度在健康对照组肠道菌群中显著高于HHcy样本组。在属层次,Fusicatenibacter、大肠杆菌志贺氏菌、罗斯氏菌属在高Hcy组样本中的丰度均显著高于健康对照组。Fusicatenibacter属于厌氧梭状芽孢杆菌,在食物中与食物的总抗氧化能力(T-AOC)呈正相关[6]。在人体肠道菌群中,FusicatenibacterSaccharivorans作为一类有益菌,以葡萄糖为底物,会产生一些具有抗炎作用的短链脂肪酸(SCFA)作为发酵终产物,如乳酸、乙酸和琥珀酸,且同时能通过诱导结肠黏膜固有层单核细胞(LPMC)产生白细胞介素(IL)-10,最终可在人体中起到预防肠道炎症的作用[7-8]。大肠杆菌志贺氏菌则作为一种有害菌,会产生志贺毒素,有研究显示其丰度与人体中促炎细胞因子IL-1β、NOD样受体热蛋白结构域相关蛋白3和趋化因子配体2的浓度呈正相关[9]。罗斯氏菌属为杆状革兰阳性厌氧菌,有研究显示其在人体肠道中可影响多种代谢途径,且可能与包括肠应激综合征、肥胖症、2型糖尿病、神经系统疾病和过敏等多种疾病相关[10]。高Hcy组肠道菌群中最丰富的差异细菌类群(LDA>3)为普雷沃氏菌属和巨单胞菌属。普雷沃氏菌可刺激肠上皮细胞产生IL-8、IL-6和趋化因子配体20,从而促进肠黏膜辅助性T细胞17免疫反应和嗜中性白细胞募集,促进一些慢性炎症的产生和发展,甚至可能引起更大的全身性疾病[11]。巨单胞菌属相关的研究则较少,有研究发现其未曾在欧美人群样本中作为肠道菌群优势微生物出现,故推测其可能是亚洲人肠道菌群中特有的优势种,对该属细菌在人体内各项生理生化及代谢的研究尚有探究空间[12]。因此,在高Hcy组肠道菌群中,长期高蛋氨酸的饮食可能为Fusicatenibacter、大肠杆菌志贺氏菌、罗斯氏菌属、普雷沃氏菌属和巨单胞菌属提供了更好的生长和繁殖环境。除了Fusicatenibacter可产生抗炎作用的短链脂肪酸和巨单胞菌的特性尚不明确外,其余4种细菌都会通过其代谢产物和分泌物对肠道上皮细胞和黏膜造成一定的破坏,最终促进炎症的形成,甚至造成全身性的慢性疾病,对人体内环境带来负面影响。本研究对于人体内HHcy水平与这些关键生物标志物种类有关联这一事实提供了一定的数据基础和支持。而对于其他优势细菌与Hcy水平及相关疾病之间的联系,还需进一步探究。
本研究有一定的局限性。在本研究中,高Hcy组样本和健康对照组的α多样性并无统计学区别,显示人体Hcy水平并不会对肠道菌群的物种多样性有太大的影响,推测这可能是因为Hcy的主要来源是饮食中较多的蛋氨酸和较少的维生素,食物中的蛋氨酸由D-蛋氨酸和L-蛋氨酸两种形式存在,其中D-蛋氨酸本身对维持肠道菌群稳态、防止肠道损伤有一定作用[13],故肠道菌群在多样性层面上并无明显差异。这与研究对象样本量较少有关,需扩充样本进一步研究。若样本量能进一步增大,α多样性或许能呈现更显著的区别。此外,尽管有严格的纳入和排除标准,样本之间的个体差异依旧比较明显。更大样本量的研究也许能更好地阐明肠道微生物群落结构对不同血清Hcy水平的影响。
4 结论与展望
高Hcy组的肠道菌群与血液中Hcy水平正常的健康对照组人群肠道菌群在组成上存在一定差异,肠道菌群群落结构与高同型半胱氨酸血症的发生和多项Hcy相关疾病的发展可能存在密切联系。目前国内外对于该领域的研究仍相对较少,仅有的文献也多为啮齿动物实验数据所得。本研究提供了高Hcy组与正常水平Hcy健康对照组人体内肠道菌群区别的描述,结果表明,在高Hcy组人群体内,Fusicatenibacter、大肠杆菌志贺氏菌、罗斯氏菌属、普雷沃氏菌属和巨单胞菌属有着比健康对照组明显更高的丰度。该研究结果有助于阐明不同Hcy水平下肠道菌群的组成,为进一步明确肠道菌群对Hcy水平的影响提供了数据支持,也为对Hcy水平相关疾病的控制和采用益生菌治疗手段提供了新思路。

