两种纤维素醚类亲水胶体对冷冻面团中面筋蛋白的影响
韩可阳,刘亚伟,刘 洁
河南工业大学 粮油食品学院,河南 郑州 450001
面筋蛋白是面团的重要组分之一,因其具有较强的持水性、起泡性以及黏弹性,对面团的延展性和持气性起重要作用[1]。冻藏过程中,面筋蛋白中的二硫键减少,从而发生部分解聚,冰晶使面筋蛋白分子结构和性质发生变化,导致冷冻面团的品质发生劣变[2-3]。亲水胶体良好的亲水性和持水性能够减少冷冻面团中的游离水含量,从而减少冰晶对面筋蛋白的破坏[4]。羧甲基纤维素钠(sodium carboxymethyl cellulose, CMC)是一种纤维素醚类亲水胶体,广泛应用在食品、材料、医学等领域[5]。CMC与面筋蛋白相互作用,不仅能够改善冷冻面团的流变学特性,还能抑制冷冻面团中冰晶的形成与生长,减少冰晶对面筋蛋白网络结构的破坏,提高面团的持气能力和稳定性[6-8]。羟丙基甲基纤维素钠(hydroxypropyl methyl cellulose, HPMC)是纤维素经环氧丙烷和氯甲烷通过醚化反应生成的纤维素醚类衍生物[9]。将HPMC、阿拉伯树胶、魔芋葡甘聚糖和苹果果胶添加到面粉中,结果表明HPMC能够更好地改善面筋蛋白的流变学特性和延伸性[10]。目前研究多为将不同多糖基材分别添加到面团中进行效果比较[9-10],而将CMC和HPMC混合复配应用还未见报道。
本课题组之前的研究表明,添加不同复配比例的CMC和HPMC能够减缓冻藏过程中冷冻面团及其馒头的品质劣变,作者将进一步探究不同复配比例的CMC和HPMC对冷冻面团中面筋蛋白结构和特性的影响,为其改善冷冻面团的品质提供理论依据。
1 材料与方法
1.1 材料与试剂
小麦粉:益海嘉里金龙鱼粮油股份有限公司。
酵母:安琪酵母股份有限公司;CMC(食品级):河南万邦实业有限公司;HPMC(食品级):郑州鸿瑞食品有限公司;氯化钠(分析纯)、脲、甘氨酸:天津市科密欧化学试剂有限公司;三羟甲基氨基甲烷:天津市光复精细化工研究所;5,5′-二硫基(2-硝基苯甲酸):北京百奥莱博科技有限公司;8-苯胺-1萘磺酸:北京沃凯生物科技有限公司。
1.2 仪器与设备
AY-120电子分析天平、UV-2700紫外分光光度计:日本岛津公司;MB45卤素水分测定仪:美国OHAUS公司;HR-1流变仪、Q20差示扫描量热仪(DSC):美国TA公司;FD-1A-80冷冻干燥机:北京博愿实验有限公司;Nicolet6700傅里叶红外光谱仪:美国Thermo Scienctific公司;荧光分光光度计:FLUKO公司;Seven Multi pH计:瑞士METTLER-TOLEDO公司;Quanta250扫描电子显微镜:美国FEI公司;磁力搅拌器:德国IKA仪器设备有限公司。
1.3 试验方法
1.3.1 CMC和HPMC不同复配比例面粉的配制
保持面粉与CMC和HPMC的总质量不变,向面粉中添加CMC和HPMC(CMC和HPMC的质量比分别为0.5∶ 0.3、0.5∶ 0.5、0.5∶ 0.7、0.7∶ 0.3、0.7∶ 0.5、0.7∶ 0.7、0.9∶ 0.3、0.9∶ 0.5、0.9∶ 0.7),混合均匀后备用,以未添加CMC和HPMC的面粉为空白对照。
1.3.2 冷冻面团及面筋蛋白的制备
冷冻面团的制备参照GB/T 35991—2018并稍加修改。称500 g面粉置于和面机的面钵中,倒入265 mL蒸馏水,先慢速搅拌6 min至形成面团,然后快速搅拌1 min,使面团表面光滑。将面团分割成100 g/个,压片8次,手工搓圆,然后用保鲜膜包裹置于速冻机中,-30 ℃速冻1 h,然后于-18 ℃冰柜中冻藏0、7、14、21、28 d,得到不同冻藏时间的冷冻面团。
面筋蛋白的制备:(1)取出冻藏相应时间的面团样品,解冻,将面团放在手掌心中,用2%NaCl溶液以50 mL/min洗涤8 min,同时用手不停地揉搓面团,将已经成形的面筋球继续用自来水冲洗、揉捏,直至面筋中的淀粉洗净为止。(2)用手反复挤压面筋球,直到稍感面筋粘手为止(挤压约15次)。(3)将排水后的面筋置于-18 ℃的冰箱中冻藏12 h,然后冷冻干燥24 h。(4)将冷冻干燥后的面筋蛋白研磨,过80目筛。
从添加CMC和HPMC质量比分别为0.5∶ 0.3、0.5∶ 0.5、0.5∶ 0.7、0.7∶ 0.3、0.7∶ 0.5、0.7∶ 0.7、0.9∶ 0.3、0.9∶ 0.5、0.9∶ 0.7的面团中提取面筋蛋白,分别记为CH1、CH2、CH3、CH4、CH5、CH6、CH7、CH8、CH9。从未添加CMC和HPMC的面团中提取面筋蛋白作为对照。
1.3.3 面筋蛋白流变学特性的测定
取1.3.2中排水后的面筋球2 g置于流变仪样品台上,进行如下程序。(1)应变扫描:采用Ф40 mm的不锈钢平板,间距1 000 μm,静置5 min,扫描范围0.1%~100%,频率1 Hz。(2)动态频率扫描:扫描范围0.1~10 Hz,应变值0.5%,所用夹具、间距、静置时间等都与应变扫描试验相同。频率每增加10倍在流变曲线中记录8个数据点。
1.3.4 面筋蛋白热力学特性的测定
通过差示扫描量热仪测定蛋白质的热变性温度(Td)和焓(ΔH)。Td反映蛋白质的热稳定性,ΔH则代表蛋白质中疏水性基团与亲水性基团的分布情况,还可以反映蛋白质的聚集程度。称取过80目筛的面筋蛋白样品8.5 mg,密封于铝制坩埚中。测定程序:温度20~100 ℃,升温速率5 ℃/min。
1.3.5 面筋蛋白二级结构的测定
取面筋蛋白样品与KBr按照质量比1∶ 100混合于研钵中,研磨均匀。傅里叶红外光谱仪光谱分辨率4 cm-1,波数范围400~4 000 cm-1,用软件Peakfit对酰胺Ⅰ带(1 600~1 700 cm-1)进行拟合数据,求出面筋蛋白的β-折叠、β-转角、α-螺旋以及无规则卷曲的相对百分含量。
1.3.6 面筋蛋白游离巯基含量的测定
参考文献[11]的方法并稍做修改,称取200 mg 面筋蛋白样品,溶于20 mL标准缓冲溶液中(8 mol/L脲、86 mmol/L三羟甲基氨基甲烷、90 mmol/L甘氨酸,pH 8.0),25 ℃搅拌30 min,然后4 000 r/min离心10 min。采用考马斯亮蓝法测定上清液蛋白质浓度。向比色管中加入5 mL标准缓冲液,然后加入1 mL上清液,最后加入0.04 mL 5,5′-二硫基(2-硝基苯甲酸),混合均匀后于25 ℃恒温水浴锅中保温30 min,在412 nm处测定该溶液的吸光度。
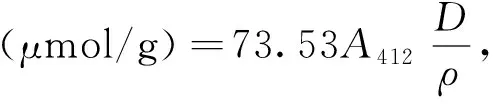
式中:73.53为消光系数;A412为吸光度;D为稀释因子;ρ为蛋白质质量浓度,mg/mL。
1.3.7 面筋蛋白表面疏水性的测定
参考文献[12]的方法并稍做修改,称取0.2 g面筋蛋白粉末分散于30 mL磷酸盐缓冲溶液(0.2 mol/L,pH 7.0)中,磁力搅拌30 min,4 000 r/min离心10 min。采用考马斯亮蓝法测定上清液蛋白质浓度。用磷酸盐缓冲溶液分别将上清液稀释为5个浓度(0.02~0.5 mg/mL)。吸取4 mL蛋白质样品于比色管中,加入40 mL 8-苯胺-1萘磺酸(15.00 mmol/L)混合均匀,避光反应10 min,用荧光分光光度仪测定吸光度。测试条件:激发、发射波长分别为365、484 nm。对以吸光度为纵坐标、蛋白质浓度为横坐标的曲线进行线性回归分析,得到的斜率表征蛋白质表面疏水性。
1.3.8 面筋蛋白微观结构的测定
将冷冻干燥后的面筋蛋白固定于样品台上,经过电子溅射仪喷金,然后置于电子显微镜上进行扫描拍摄,工作电压15 kV。
1.4 数据统计与分析
使用SPSS 20、Origin 2019进行数据处理和制图;采用Duncan检验法进行显著性分析。
2 结果与分析
2.1 CMC和HPMC不同复配比例及冻藏时间对面筋流变特性的影响
动态频率扫描在0.1~10 Hz范围内,所有的湿面筋样品的G′都大于G″(图1),表现为类固体的流变学特征,即面筋蛋白不仅具有黏性流体的特性,还具有弹性固体的特性[13]。含有CMC和HPMC的湿面筋的G′和G″均大于对照湿面筋的,其中CH4的最大。随着冻藏时间的增加,湿面筋的G′和G″有不同程度的下降。这与潘治利等[14-17]的研究结果相同,冻藏破坏了麦谷蛋白分子中的部分氢键和二硫键,改变了面筋蛋白的功能特性,从而导致面团结构的功能性和稳定性很大程度地下降。在冻藏过程中,低温导致面团中的水分发生结晶,由于冻藏时间的延长、温度的变化等还会造成冰晶重结晶。通过与对照湿面筋对比发现,冻藏28 d后,含有不同复配比例的CMC和HPMC的面筋的G′和G″变化减小,其中CH4的变化最小,说明复配胶体的加入有效地抑制了面筋蛋白网络结构被冰晶的破坏。这与Julianti等[18]的研究相似,亲水胶体中的亲水基团能与面筋蛋白发生相互作用,使面筋蛋白的网络结构达到最佳的水合状态,改变其流变学特性。
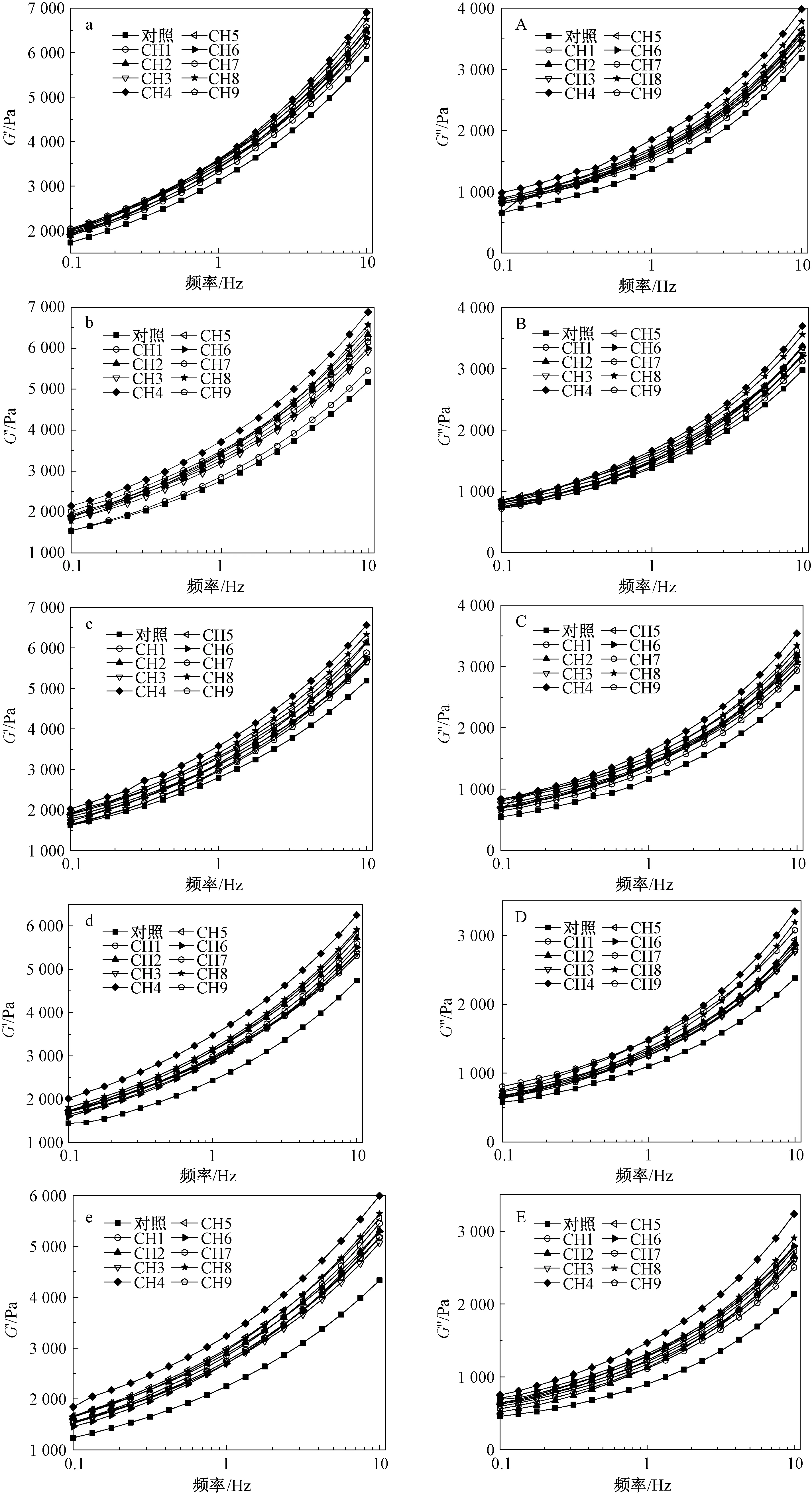
注:a—e分别为面筋蛋白冻藏0、7、14、21、28 d的弹性模量(G′); A—E分别为面筋蛋白冻藏0、7、14、21、28 d的黏性模量(G″)。图1 CMC和HPMC不同复配比例及冻藏时间对面筋蛋白的G′和G″的影响Fig.1 Effects of different ratios of CMC and HPMC and frozen storage time on G′ and G″ of gluten
2.2 CMC和HPMC不同复配比例及冻藏时间对面筋蛋白热力学特性的影响
未冻藏时对照面筋蛋白的Td和ΔH分别为56.02 ℃(表1)、1.294 J/g(表2),冻藏28 d后Td减少了4.48 ℃,ΔH减少了0.421 J/g,可能是因为在冻藏过程中,冰晶使面筋蛋白的构象发生改变,使面筋蛋白的伸展程度增加。这与Wang等[19]的研究结果相同,冻藏后面筋蛋白的有序结构减少,从而使面筋蛋白的ΔH减小。含有不同复配比例CMC和HPMC的面团,不仅可以提高面筋蛋白的Td和ΔH,并且冻藏28 d后,面筋蛋白的Td和ΔH的变化减小,其中CH4的变化最小,分别减少了1.59 ℃和0.182 J/g,说明不同复配比例的CMC和HPMC能够减少面筋蛋白在冻藏过程中受到的破坏,维持面筋蛋白的稳定性。亲水胶体可以通过物理缠结和非共价键相互作用与面筋蛋白相互作用,从而保持面筋蛋白的热稳定性[20]。

表1 CMC和HPMC不同复配比例及冻藏时间对面筋蛋白热变性温度(Td)的影响Table 1 Effects of different ratios of CMC and HPMC and frozen storage time on thermal denaturation temperature of gluten

表2 CMC和HPMC不同复配比例及冻藏时间对面筋蛋白热变性焓(ΔH)的影响Table 2 Effects of different ratios of CMC and HPMC and frozen storage time on thermal denaturation enthalpy of gluten
2.3 CMC和HPMC不同复配比例及冻藏时间对面筋蛋白二级结构的影响
随着冻藏时间的延长,面筋蛋白的二级结构有着不同程度的变化,其中β-折叠、α-螺旋含量增加,β-转角、无规则卷曲含量减小(表3),表明随着冻藏时间的增加,面筋蛋白稳定结构被破坏,这可能是因为面筋蛋白的β-转角含量与麦谷蛋白多肽链的β-回旋空间域的结构相关[21]。无规则卷曲的含量随着冻藏时间的延长显著减小,可能是由于冰晶挤压造成的。

表3 CMC和HPMC不同复配比例及冻藏时间对面筋蛋白二级结构的影响Table 3 Effects of different ratios of CMC and HPMC and frozen storage time on the secondary structure of gluten
不同复配比例的CMC和HPMC使未冻藏面筋蛋白的β-折叠、无规则卷曲含量增加,α-螺旋、β-转角的含量减少,这可能是因为CMC和HPMC与面筋蛋白之间存在着相互作用,形成了新的氢键,进而影响了蛋白的构象[22]。冻藏28 d,对照面筋蛋白的β-折叠、α-螺旋的含量分别增加了9.60%、20.88%,β-转角、无规则卷曲的含量分别减少了14.80%、19.38%,而添加了不同复配比例CMC和HPMC的面筋蛋白的二级结构变化减小,其中CH4的变化最小(CH4的β-折叠、α-螺旋的含量分别增加了3.38%、12.22%,β-转角、无规则卷曲的含量分别减少了7.60%、7.40%),说明添加不同复配比例的CMC和HPMC能够减少面筋蛋白在冻藏过程中二级结构的变化。这与汪星星[23]的研究结果相似,亲水胶体能够抑制面筋蛋白的变性,减小面筋蛋白二级结构中各结构含量的变化。
2.4 CMC和HPMC不同复配比例及冻藏时间对面筋蛋白表面疏水性的影响
冻藏0~28 d,在相同冻藏时间下,添加CMC和HPMC不同复配比例的面筋蛋白表面疏水性均小于对照样品,并且冻藏21 d的未添加亲水胶体的面筋蛋白表面疏水性为36.61,大于冻藏28 d的CH2、CH4、CH5、CH8的表面疏水性(图2)。随着冻藏时间的延长,冷冻面团中冰晶生长、重结晶,破坏了面筋蛋白的结构,导致构象发生变化,面筋蛋白分子内部的疏水基团暴露,从而使面筋蛋白表面疏水性提高[24]。冻藏28 d后,无论是否添加CMC和HPMC的面筋蛋白的表面疏水性均显著增加,CMC和HPMC的存在减小了面筋蛋白表面疏水性的增加量。说明在冻藏过程中添加不同复配比例的CMC和HPMC能够抑制蛋白质的变性程度。DSC测定面筋蛋白的变性温度也表明添加不同复配比例的CMC和HPMC能够抑制蛋白质的变性程度,这是因为其能够抑制冰晶对面筋蛋白的破坏,减少冷冻过程中面筋蛋白的解聚。

图2 CMC和HPMC不同复配比例及冻藏时间对面筋蛋白表面疏水性的影响Fig.2 Effects of different ratios of CMC and HPMC and frozen storage time on the surface hydrophobicity of gluten
2.5 CMC和HPMC不同复配比例及冻藏时间对面筋蛋白游离巯基含量的影响
在冻藏各个时期,不同复配比例CMC和HPMC的面筋蛋白中游离巯基含量均显著小于对照样品中游离巯基的含量(表4)。冻藏0~28 d所有样品中游离巯基含量有不同程度的增加,其中对照样品增加了3.63 μmol/g。不同复配比例CMC和HPMC的面筋蛋白中游离巯基含量变化减小,其中CH4的变化最小,为1.81 μmol/g。这可能是因为随着冻藏时间的延长,冰晶的生长对面筋蛋白网络结构的挤压作用越明显,使部分分子内与分子间的二硫键断裂,导致面筋蛋白中游离巯基含量增加。而添加不同复配比例的CMC和HPMC可以降低由于冰晶挤压对面筋蛋白造成的破坏,从而抑制面筋蛋白的解聚[25-26]。
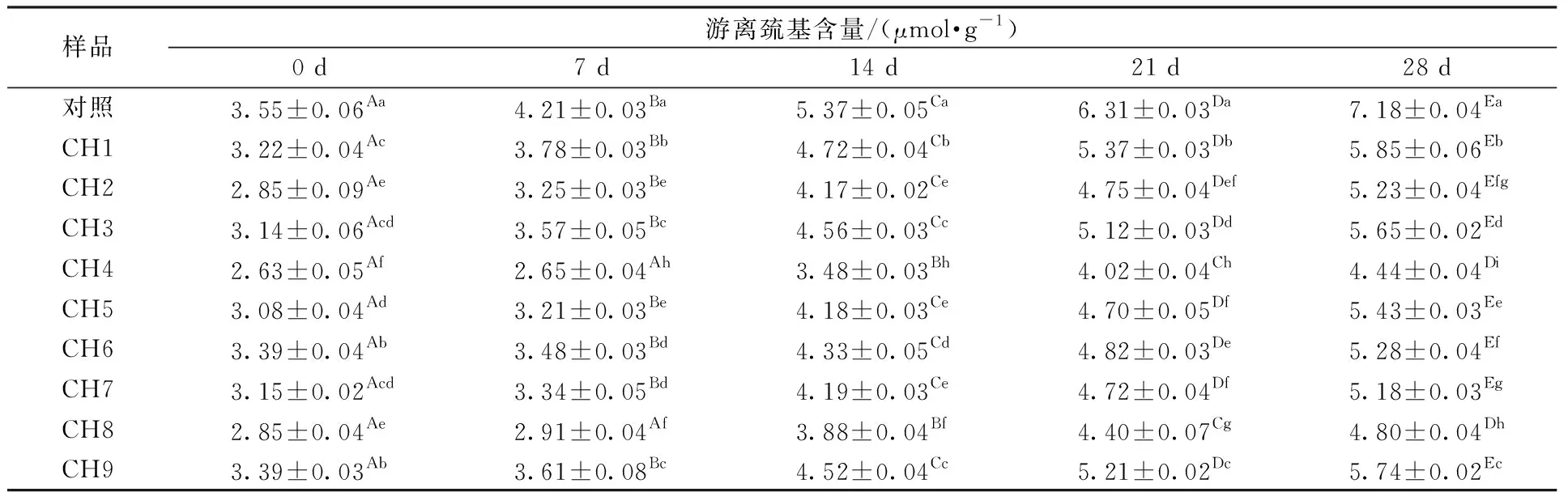
表4 CMC和HPMC不同复配比例及冻藏时间对面筋蛋白游离巯基含量的影响Table 4 Effects of different ratios of CMC and HPMC and frozen storage time on free sulfhydryl content in gluten
2.6 CMC和HPMC及冻藏时间对面筋蛋白微观结构的影响
对照面筋蛋白以及添加CH4的面筋蛋白在冻藏前(图3a、3c)孔室较为均匀和密集。冻藏28 d后(图3b、3d),面筋蛋白的孔室变大、分布不均匀、形状不规则,这可能是因为在冻藏过程中,冰晶的挤压破坏了面筋蛋白网络结构的完整性,与Kontogiorgos等[27]研究结果相近,由于冷冻收缩使面筋蛋白的网络孔室受到了挤压,使其完整性降低。另外,面筋蛋白微观结构被破坏,会导致水分的迁移和重分布,使部分不可冻结水转变成可冻结水。添加CH4的面筋蛋白孔室变化相对较小,仍保持较好的完整性和连续性,表明CMC和HPMC的存在可以帮助支撑面筋蛋白网络结构以及抑制冰晶的重结晶对面筋蛋白的伤害。

注:a、b分别为对照面筋蛋白冻藏0 、28 d;c、d分别为添加CH4(CMC和HPMC的质量比为0.7∶ 0.3)的面筋蛋白冻藏0 、28 d。图3 面筋蛋白的微观结构Fig.3 Microstructures of gluten
3 结论
研究了不同复配比例的CMC和HPMC经过不同冻藏时间(0、7、14、21、28 d)对面团中面筋蛋白的影响。结果表明:在冻藏的各个阶段,添加不同复配比例的CMC和HPMC能够增加面筋蛋白的G′和G″,提高面筋蛋白的Td和ΔH,降低面筋蛋白的表面疏水性以及游离巯基含量,减小面筋蛋白二级结构的变化。不同复配比例的CMC和HPMC通过保持冷冻面团中面筋蛋白的结构和特性从而改善其品质,其中以CMC和HPMC的质量比为0.7∶ 0.3时的作用最大。后续深入研究CMC和HPMC对冷冻过程中面筋蛋白的影响,需要缩短测试周期,并增加对面筋蛋白的测定指标,建立面筋蛋白的在冷冻过程中的品质变化模型。

