基于双位点同步微透析技术的青藤碱微乳凝胶皮肤及血液药代动力学研究
丁杨,钱珊珊,郭健,桂双英
(1.安徽中医药大学药学院,安徽 合肥 230012;2.安徽省中医药科学院药物制剂研究所,安徽 合肥 230012;3.现代药物制剂安徽省教育厅工程技术研究中心,安徽 合肥 230012;4.药物制剂技术与应用安徽省重点实验室,安徽 合肥 230012;5.安徽中医药大学第二附属医院,安徽 合肥 230061)
青藤碱(Sinomenine)为中药青风藤的根茎中提取分离得到的一种生物碱单体,具有抗炎、镇痛、免疫抑制等药理活性[1-3],临床上用于治疗风湿、类风湿性关节炎[4-5]。青藤碱口服给药后存在生物利用度低、半衰期短、经体循环后到达病变部位药物含量少等缺点[6]。经皮给药系统避免了口服给药可能发生的肝脏首过效应和胃肠道降解失活,可以延长药物在体内的半衰期,增加局部药物浓度,从而提高药物生物利用度[7-8]。因此选用微乳凝胶作为青藤碱载体,并通过经皮给药方式给药,有助于提高青藤碱在病灶局部的有效药物浓度,发挥长效治疗作用。采用精准的技术方法监测青藤碱微乳凝胶(Sinomenine microemulsion gel,SMG)给药后的皮肤和血液中药物浓度,对于探究和评价SMG的经皮释药行为具有重要意义。
微透析(Microdialysis)是一种生物取样技术,指在麻醉或活动状态的动物体内植入探针,联合运用HPLC、HPLC-MS等技术手段,检测灌流液中的药物浓度,实时、动态地监测药物成分在机体内的动态变化[9]。与传统药代动力学研究方法相比,双位点微透析技术不仅可以进行皮肤和血液的同步取样,还可以减少组织液取样损失和操作误差。此外,微透析在不影响动物正常生理状态下进行在体、在线取样,减少了动物使用量,降低了动物间个体差异所带来的实验误差[10-11]。因此,采用双位点同步微透析技术能够精准、真实地检测SMG经皮给药后皮肤和血液中的药物浓度。
本研究首先建立了青藤碱微乳凝胶中青藤碱的UPLC含量测定方法,然后在大鼠腹部和颈部分别埋入线性探针和血液探针,采用双位点同步微透析技术进行SMG经皮给药后大鼠皮下和血液药代动力学研究,为青藤碱微乳凝胶的开发应用提供实验依据。
1 材料
1.1 仪器
Waters Acquity UPLC®H-Class超高液相系统:包括四元泵洗脱系统、自动进样器、TUV可变波长紫外检测器和Empower色谱工作站(美国Waters公司);微透析系统:包括灌注器推进泵(CMA400 Syringe pump),灌注器(CMA 2.5 mL Exmire Microsyringe Ms-gan250),收集器(CMA470 Refrigerated fraction collector);线性微透析探针(CMA30,透析膜长度10 mm,膜直径0.24 mm,截留相对分子质量6 000 Da);血液微透析探针(MAB7,透析膜长度10 mm,膜直径0.6 mm,截留相对分子质量1 500 Da);85-2A型数显恒温磁力搅拌器(江苏金坛市金城国胜实验仪器厂);AG285电子天平(德国Sartorious);SevenMulti型pH测试仪[梅特勒-托利多仪器(上海)有限公司]。
1.2 试药
青藤碱对照品(中国药品生物制品鉴定所,批号:110774-200507);青藤碱原料药(纯度≥98%,成都曼斯特生物科技有限公司,批号:12101704);油酸(化学纯,天津光夏精细化工研究所);吐温-20(化学纯,天津市光复精细化工研究所);无水乙醇(分析纯,南京化学试剂一厂);薄荷醇(广州化工厂);林格氏液(Ringer's液:144 mmol·L-1Na+,1.5 mmol·L-1Ca2+,4.0 mmol·L-1K+,2.3 mmol·L-1Mg2+,用前过0.22 μm膜);三乙胺(天津市光复精细化工研究所);磷酸二氢钠(上海中试化工总公司);三乙醇胺(化学纯,上海苏懿化学试剂有限公司);肝素钠注射液(天津生物化学制药有限公司);戊巴比妥钠(上海麦克林生化科技有限公司);水为超纯水,其他试剂均为分析纯。
1.3 动物
SD雄性大鼠,体质量240~270 g,安徽医科大学实验动物中心提供,动物合格证号:SYXK(皖)2012002。动物饲养条件:温度25 ℃左右,自由饮食饮水,动物室保持自然光暗周期。实验经安徽中医药大学实验动物伦理委员会审批,伦理批号:1107261911002543。
2 方法与结果
2.1 青藤碱微乳凝胶的制备
青藤碱微乳凝胶的处方组成为:4%青藤碱,2%油酸,16.7%吐温-20,33.3%乙醇,3%薄荷醇,2%卡波姆,39%水。制备工艺如下:按处方的量将乳化剂吐温-20和助乳化剂乙醇均匀混合,在25 ℃恒温磁力搅拌器下将油酸和薄荷醇混匀,用滴管将吐温-20和乙醇的混合物缓慢滴加到油酸中,滴加过程不停搅拌,直至得到澄清透明的空白微乳。在空白微乳中加入处方量的青藤碱,再加24%的水,不断搅拌得无色透明青藤碱微乳液。再称取处方量的卡波姆,加15%水,静置24 h使其溶胀完全,得卡波姆液。将制备的青藤碱微乳缓慢加入溶胀完全的卡波姆液,用适量的三乙醇胺调节pH至6.0~6.5,搅拌均匀,即得4%的青藤碱微乳凝胶。
2.2 经皮药代动力学研究
2.2.1 色谱条件 色谱柱:ACQUITY UPLC BEH C18柱(2.1 mm×100 mm,1.7 μm);流动相:甲醇-0.01 mol·L-1磷酸二氢钠(40∶60,v/v),添加0.1%三乙胺调pH为7;检测波长:263 nm;流速:0.2 mL·min-1;柱温:30 ℃;进样量:2 μL。
2.2.2 样品的处理 微透析实验全过程使用的溶液均过0.22 μm滤膜,经过透析膜所得的透析液干净、无高分子蛋白,故不对微透析样品进行任何预处理,直接进行UPLC定量分析。
2.2.3 专属性考察 按上述建立的色谱条件,分别将对照品溶液、空白透析液、样品透析液进样。结果表明空白透析液在青藤碱出峰位置无吸收峰出现,透析液中杂质峰与青藤碱得到良好分离,可见在该色谱条件下的分析方法具有良好的专属性,分析方法可行。相关图谱见图1。
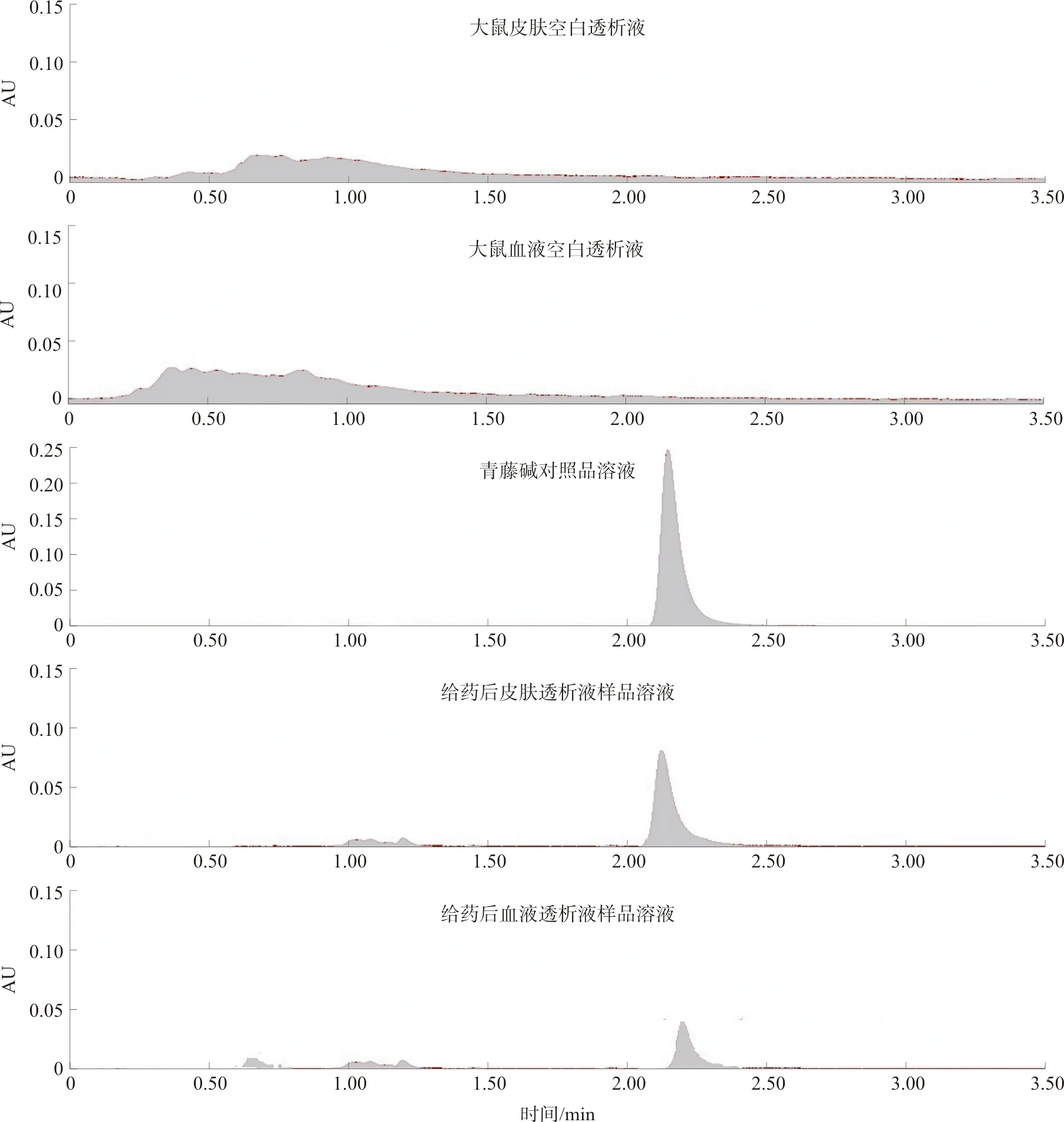
图1 专属性考察的UPLC色谱图
2.2.4 标准曲线的制备 精密吸取青藤碱对照品适量,置于10 mL容量瓶中,用甲醇定容得质量浓度分别为0.5、1、2、4、8、10、20 μg·mL-1的系列溶液,按照上述色谱条件进样测定,以青藤碱峰面积(Y)对进样浓度(X)进行线性回归,得回归方程:Y=9 390X-13 254(r=0.999 0),表明青藤碱质量浓度在0.5~20 μg·mL-1之间与峰面积呈良好的线性关系。
2.2.5 精密度 取高(20 μg·mL-1)、中(4 μg·mL-1)、低(0.5 μg·mL-1)3个质量浓度的青藤碱标准品溶液,连续进样5次,结果青藤碱峰面积RSD分别为1.2%、1.05%、0.92%,表明仪器精密度良好。
2.2.6 探针回收率的测定 当青藤碱微乳凝胶微透析药代动力学实验全部结束后,用肝素钠溶液浸泡探针,擦去探针透析膜表面吸附的杂质,用纯水充分冲洗2 h。清洗完成后将微透析探针分别浸没在2个空白Ringer's溶液的100 mL烧杯中,用保鲜膜覆盖,磁力搅拌转速为200 r·min-1,温度维持在37 ℃。以质量浓度为75 μg·mL-1(Cin)青藤碱溶液为灌流液,灌流速度为2 μg·mL-1,平衡1 h开始采集样品,采集量为40 μL,采集4份透析液样品。Cout为透析液中青藤碱的浓度。通过减量法公式计算青藤碱探针的回收率R=(Cin-Cout)/Cin×100%。得线性探针回收率为(23.58±0.16)%,血液探针的回收率为(28.80±0.74)%。
2.2.7 皮肤和血液同步微透析
2.2.7.1 探针预处理与植入 由于药代动力学取样时间的原因,在体内实验前将探针的透析膜浸泡于肝素钠注射液中,以2 μL·min-1的灌流速度灌流Ringer's溶液30 min,使探针透析膜内外充分饱和肝素钠注射液,防止在实验过程中出现凝血现象。
皮下探针植入:SD大鼠实验前一晚用动物剃毛器将大鼠腹部毛发剃除干净。禁食12 h,正常饮水。大鼠腹腔注射3%戊巴比妥钠(2 mL·kg-1)麻醉,将大鼠腹部朝上固定于鼠板上。用标记笔在皮肤上标注植入点和出点部位(植入点和出点之间的距离至少长于透析膜的长度4 mm以上)。将线性探针引导针从标记的植入点插入,使其在皮下穿过探针的植入点和出点。再将线性探针送入针管中,将探针从针头尾端慢慢拉出,一直拉到透析膜靠近引导针头的斜面端(注意不要将透析膜拉进针头,避免损坏透析膜)。缓慢将引导针往外拉,探针膜随着引导针的拉动慢慢进入目的部位。当针头全部抽出后,调整探针位置,使透析膜位于植入点和出点的中间部位,则皮下探针植入完成。整个操作过程结束后以2 μL·min-1流速灌流空白Ringer's溶液保持探针膜处于湿润状态,持续灌流1 h。
血液探针植入:SD大鼠实验前一天,禁食12 h,正常饮水。将大鼠腹腔注射3%戊巴比妥钠(2 mL·kg-1)麻醉,用细绳将大鼠四肢和头部仰位固定于鼠板上。在大鼠颈部右侧剪去毛发,露出洁净皮肤。剪开一小口,用钝性手术钳将大鼠的右颈静脉分离出来,手术线结扎远心端,将镊子垫在颈静脉血管下,眼科剪在颈静脉上剪一小口,用自制的引导管轻轻插入切口处,然后将血液探针小心地插入引导管中,朝心室方向插入,慢慢抽出引导管。用手术线将探针与颈静脉绑定好,探针植入完成。整个操作过程结束后以2 μL·min-1流速灌流空白Ringer's溶液保持探针透析膜处于湿润状态,持续灌流1 h。
探针植入完成后以2 μL·min-1流速灌流空白Ringer's溶液,持续灌流1 h,以缓解探针植入导致的局部微创状态。
2.2.7.2 给药与采样 机体平衡1 h后,收集皮肤和血管部位的空白透析液各2份,每份40 μL。将4%青藤碱微乳凝胶均匀涂抹在面积为2.0 cm×1.0 cm裸露大鼠腹部皮肤上,剂量为60 mg·kg-1,用保鲜膜包住,胶带固定,如图2所示。经皮给药后同时采用皮肤微透析和血液微透析技术采集样品,每隔20 min采集1份透析液,采集量为每次40 μL,持续采集时间为10 h。将透析液样品放于冰箱中,-20 ℃保存备用。

图2 探针植入图
将样品于-20 ℃冰箱中取出,置于室温解冻,按2.1.1项方法进行检测,根据皮下探针和血液探针各自对应的回收率值(R)对各个时间点的药物质量浓度(C测得)进行校正,按照以下公式求得各个时间点的实际药物质量浓度(C实际)。
C实际=C测得/R
采用3P97药代动力学软件进行数据的统计分析,大鼠腹部涂抹SMG后,皮肤组织、血液中青藤碱浓度-时间曲线见图3。各主要药代动力学参数如表1所示。

图3 大鼠皮肤和血液青藤碱浓度-时间曲线

表1 青藤碱皮肤和血液主要药代动力学参数
测得数据分析可得青藤碱在皮肤和血液中的Cmax分别为(10.91±3.05)(6.74±1.91)μg·mL-1;Tmax分别为(180.00±39.80)(239.98±40.85)min;AUC0→t分别为(736.51±45.30)(426.43±30.18)μg·min·mL-1。从图3可以看出,大鼠腹部给予青藤碱微乳凝胶后,由于微乳凝胶的促透作用,青藤碱经皮给药后吸收平稳迅速,皮肤中青藤碱的质量浓度在给药后3 h左右达到最大值,而血液中药物浓度在4 h左右达到峰值。
3 讨论
经皮给药的药物透过皮肤吸收进入体循环有2条途径,其中透过角质层和表皮进入真皮,被毛细血管吸收进入体循环,是药物透皮吸收的主要途径[12]。在以往的药代动力学研究中,药物的浓度-时间曲线常常通过在不同时间点处死数只动物来获得。这种方法得到的样品在进行含量测定之前要经过一系列样品前处理,使得药代动力学数据比较间接、粗糙,结果的准确性与可靠性不高,不能完全反映药物在体内的变化过程[13]。本文应用微透析取样技术,通过皮肤、血液双位点同步进行微透析取样,获得青藤碱在大鼠皮肤、血液组织中随时间变化的药物浓度动态变化过程。采样时间充足,一只动物可以获得完整的体内浓度-时间过程曲线。这与传统研究方法相比,不但减少了实验动物的数目,而且增加了时间分辨性,使药代动力学信息更准确[14-15]。
从图3可见,青藤碱微乳凝胶经皮给药后,在皮肤中形成较高的浓度梯度,皮肤和血液两者之间的浓度差异性明显,可能是由于微乳具有高渗透性,可以在皮肤角质层形成药物储库[16]。Hu等[17]将3,5,4′-三甲氧基反式二苯乙烯(BTM)为外用载体的微乳凝胶(MBH)制剂用于治疗骨关节炎,结果发现外用BTM-MBH显示出良好的抗骨关节炎作用,并降低了促炎细胞因子的水平。Mehanna等[18]制备了负载双氯芬酸钠的微乳凝胶,发现其可以使皮肤渗透性提高,延长药物释放时间且治疗效果显著。因此微乳凝胶制剂可以有效地提高药物疗效,而青藤碱在临床上主要用于治疗风湿、类风湿性关节炎等慢性疾病,将青藤碱制备成微乳凝胶经皮给药后,可以在给药部位形成药物储库,使药物缓慢持续释放,从而有助于局部药效发挥。
除此之外,血液中达到最大药物浓度的时间较皮肤滞后近60 min。分析可能原因有:①经皮给药的药物要经过皮肤吸收进入真皮,由毛细血管吸收,再经过全身的血液循环才会到达颈静脉。这需要一段时间,皮肤较血液容易浓度富集,较早达到最大药物浓度。②大鼠四肢一直处于捆绑状态,导致动物在实验过程中出现初步的肿胀发紫,影响血液循环的速度,延长了药物运输到血液探针的时间。
通过微透析取样技术直接从大鼠皮肤和血液中采集青藤碱样品,并绘出药物浓度-时间曲线,比较皮肤和血液中药物浓度的变化,与传统药代动力学方法相比,可以更好地评价外用制剂的经皮吸收动力学和生物等效性。

