跑台运动对帕金森病模型小鼠不同脑区DAT、BDNF和TrkB表达的影响
张康 张业廷 付燕
1四川师范大学体育教育研究中心(成都 610101)
2中国民用航空飞行学院(成都 618307)
3西南民族大学体育学院(成都 610225)
帕金森病(Parkinson’s disease,PD)是较常见的、与衰老相关的神经退行性疾病,典型的病理特征是黑质、纹状体多巴胺能神经元进行性死亡[1]。中枢神经系统中,多巴胺能神经元密集地存在于中脑黑质中,维持运动功能稳定;黑质多巴胺能神经元可以通过中脑边缘系统通路投射到海马区,向海马区输送多巴胺(dopamine,DA)等神经递质,发挥调节认知功能的作用[2]。当PD患者黑质多巴胺能神经元受损时,海马区投射的多巴胺能神经元减少,DA释放和代谢降低,除表现出典型的运动障碍外,往往也表现出明显的认知功能障碍[3]。
脑源性神经营养因子(brain derived neurotrophic factor,BDNF)是维持突触发育和调节突触可塑性的关键因子,其表达增强一直被认为是解释运动改善神经元结构和功能的最流行假说。多巴胺能神经元合成、释放的DA可与多巴胺D1受体(dopamine D1 receptor gene knockout,D1R)结合,通过环磷酸腺苷(Cyclic adenosine monophosphate,cAMP)-蛋白激酶A(Proteinkinase A,PKA)/环磷酸腺苷反应原件结合蛋白(cAMPresponse element binding protein,CREB)/BDNF通路,诱导BDNF表达[4,5]。BDNF与酪氨酸激酶受体B(Tyrosine Kinase receptor B,TrkB)结合,起到保护神经元存活、神经递质释放以及突触完整性的作用[6]。DA的合成、囊泡的定位和释放以及细胞分化的持久性等动态稳定受多巴胺转运体(Dopamine transporter,DAT)等多种因素的共同调节[7]。DAT是突触前多巴胺能神经元末梢的重要标志物,可以反映突触前多巴胺能神经元功能的完整性[8]。DAT和BDNF缺失都会导致多巴胺能神经元可塑性受损,上调DAT和BDNF的表达有助于PD的预防与康复。
运动作为神经发生和神经元可塑性的调节器,发挥着维持大脑功能稳定的作用。人体实验和动物实验的资料均表明,运动可以减少PD黑质和纹状体多巴胺神经元受损,改善依赖性运动功能障碍,对PD具有良好的防治效果[9-13]。但以往关于运动与PD关系的研究主要集中在黑质、纹状体等运动功能障碍脑区展开,涉及多巴胺能神经元投射脑区的研究极少。本研究观察了1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-Methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)诱导的PD模型小鼠多巴胺能神经元中脑边缘系统投射路径中与运动和认知功能相关的黑质、海马CA1区和海马下托神经元计数及DAT、BDNF和TrkB表达的变化,并探讨跑台运动对MPTP诱导PD小鼠不同脑区DAT、BDNF和TrkB蛋白和神经元完整性的影响。
1 研究对象与方法
1.1 实验对象与分组
24只正常雌性C57/BL6小鼠,体重19.11±0.96 g,于SPF级动物实验室分笼饲养。适应性喂养7天后,随机分为4组:生理盐水对照组(SC组)、PD模型组(PD组)、生理盐水+运动组(SE组)、PD+运动组(PDE组),每组6只。饲养环境干净整洁,通气良好,饲养温度保持在23℃±2℃,湿度保持在40%~60%。PD组和PDE组小鼠注射MPTP构建PD模型,SE组和PDE组通过跑台运动构建跑台运动模型。
1.2 模型构建与取材
实验流程图见图1。

图1 实验流程图
1.2.1 PD模型构建
PD和PDE组小鼠按照30 mg/kg[14]的剂量每隔3.5天腹腔注射MPTP溶液一次,SC和SE组在相同的时间段腹腔注射同等剂量的生理盐水,每周2次,共5周。通过震颤麻痹量表和黑质酪氨酸羟化酶(Tyrosine hydroxylase,TH)检测、行为学测试等多种方式发现MPTP诱导的小鼠中66.67%符合PD频繁性震颤和活动逐渐受限等特征,83.3%的小鼠出现不同程度黑质多巴胺能神经元受损[15]。
1.2.2 跑台运动模型构建
SE组和PDE组第一周为适应运动阶段,采用较低运动强度进行,跑速分别为6 m/min,每天60 min,持续2天;8 m/min,每天60 min,持续2天;10 m/min,每天60 min,持续1天。第二周增加跑台速度,跑速设置为12 m/min[16],每天60 min,5天/周,持续7周(行为学测试期间持续运动1周)。整个实验周期中跑台坡度均设置为0°。PD模型和跑台运动模型实验流程见图1。
1.2.3 取材及切片制作
干预结束后,断颈处死。取小鼠完整脑组织,放入液氮速冻,-80℃冰箱保存,待制作黑质、海马部位的切片。
切片制作:①小鼠全脑于10%中性甲醛固定液中固定;②后经0.01M磷酸盐缓冲液漂洗,并依次于70%、85%、90%、95%、100%、100%乙醇溶液中脱水;③二甲苯Ⅰ和二甲苯Ⅰ中透明;④透明后的脑组织浸于蜡液4~5小时后置于包埋筐中冷却;⑤将包埋好的组织块固定于切片机上,根据脑立体定位图谱,黑质切片选取前囟-4.8 mm到-6.3 mm,海马CA1区选取约前囟-2.0到-4.4 mm,海马下托选取约前囟-4.8到-5.4 mm,切片厚度2 μm;⑥将切片置于45℃烤箱内干燥60 min后4℃冷藏待用。
1.3 尼氏染色
采用尼氏染色观察小鼠黑质、海马CA1区和海马下托神经元的变化。将制作的组织切片进行防脱处理;脱蜡,将载玻片浸入50℃的1%甲苯胺蓝溶液,放入56℃恒温箱20 min;双蒸水清洗载玻片;70%的酒精溶液分色;95%酒精溶液中分化,显微镜下操作,直至尼氏小体可以清晰显示。无水乙醇中脱水2次,5 min/次;二甲苯透明10 min/次,共2次,之后使用中性树脂进行封片;显微镜下观察并采集黑质及海马各区神经元形态和结构,通过观察神经元的完整程度、核萎缩情况和正常锥体神经元的数目来判断神经元的损伤程度,在黑质、海马CA1和海马下托中各选择一个区域对对未损伤神经元进行计数。
1.4 免疫荧光
利用免疫荧光技术观察小鼠黑质、海马CA1和海马下托神经元中DAT、BDNF和TrkB表达水平。将制作的组织切片脱蜡至水;浸入0.01 M柠檬酸盐缓冲液(pH=6.0)中加热至沸腾,重复1次,之后PBS清洗5 min/次,反复清洗3次;37℃室温下使用10%山羊血清封闭30 min;滴加一定比例DAT、BDNF和TrkB一抗(浓度1∶100、1∶500和1∶50),4℃过夜;PBS清洗5 min/次,反复3次;滴加二抗,37℃孵育30 min;PBS清洗切片3次,5 min/次;滴加DAPI染液,37℃孵育30 min;PBS清洗切片3次,5 min/次;用抗荧光衰减封片剂封片;采用免疫荧光显微镜观察并采集黑质、海马CA1区和海马下托的图像;使用image J软件分析平均荧光强度(荧光强度=荧光面积/总面积),获得蛋白的相对表达数据。
1.5 主要的实验试剂与仪器
MPTP(proteintech公司),Anti-Tyrosine Hydroxylase抗体(abcam公司),BDNF Antibody(abcam公司),TrkB Antibody(proteintech公司),DAT Antibody(proteintech公司),二抗(abcam公司),荧光显微镜(德国Leica公司),正置光学显微镜(日本NIKON公司),自动图像分析仪(德国Zeiss-Kontron公司)等。
1.6 统计学分析
采用SPSS26.0对小鼠各项数据进行分析,结果均采用均值±标准差(x±s)表示,采用单因素方差分析(one-way ANOVA)法分析小鼠组间指标的差异程度;采用双因素方差分析(Two-Way ANOVA)法分析跑台运动与MPTP注射的交互效应。P<0.05和P<0.01均记为差异具有显著性。
2 结果
2.1 跑台运动对PD模型小鼠不同脑区神经元计数的影响
由图2可见,与SC组相比,PD组小鼠黑质和海马CA1区神经元排列松散,胞体存在不同程度损伤;SE组小鼠海马CA1区神经元层次分明,排列较为紧密。与PD组相比,PDE组小鼠黑质排列较为紧密。
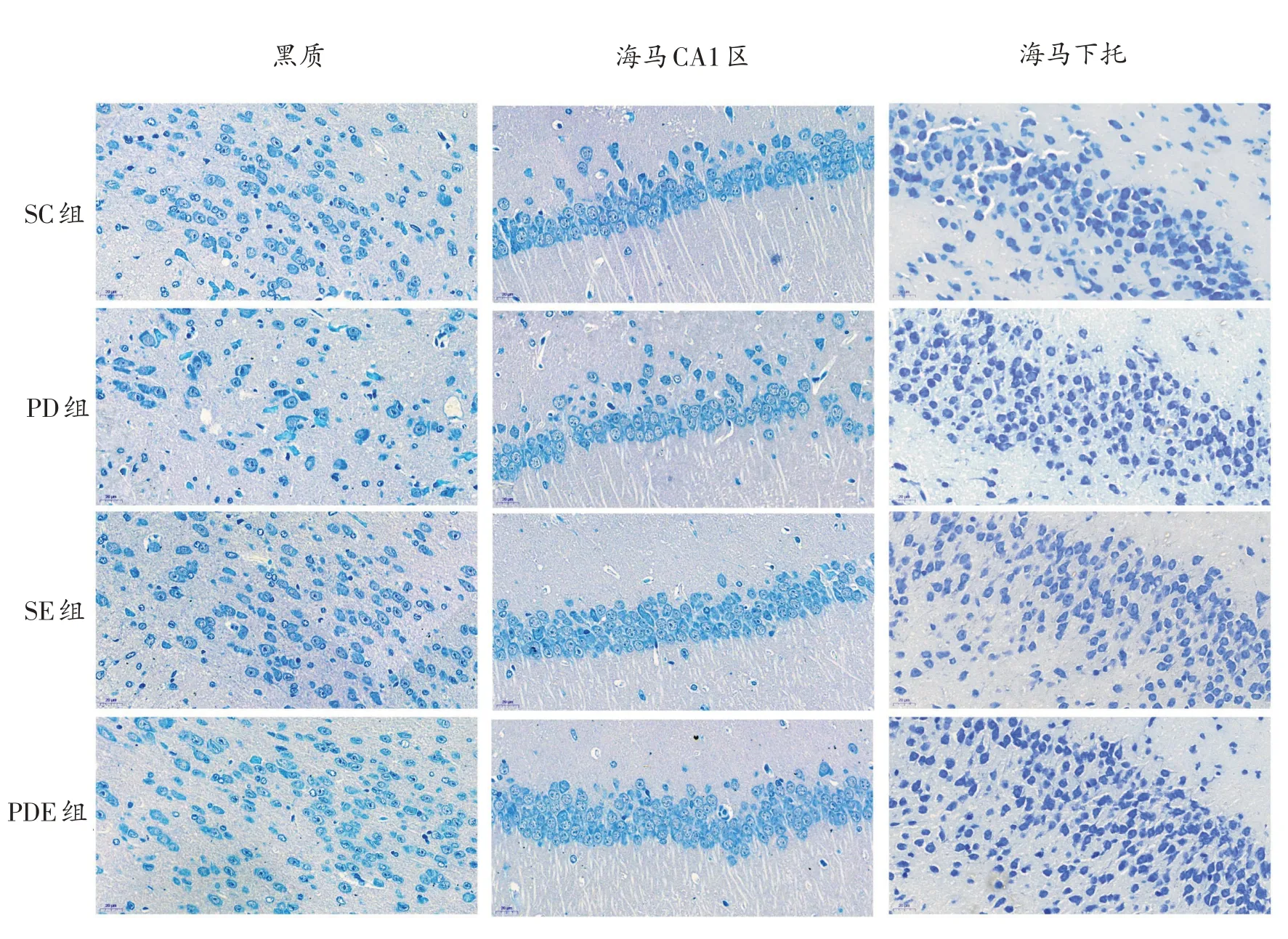
图2 各组小鼠黑质、海马CA1区以及海马下托神经元尼氏染色结果(40×)
双因素方差分析(表1)表明,跑台运动和MPTP注射对小鼠黑质(F=3.751,P>0.05)、海马CA1区(F=5.266,P>0.05)和海马下托(F=0.011,P>0.05)神经元计数均无交互作用,说明跑台运动干预与MPTP注射的作用机制相互独立。
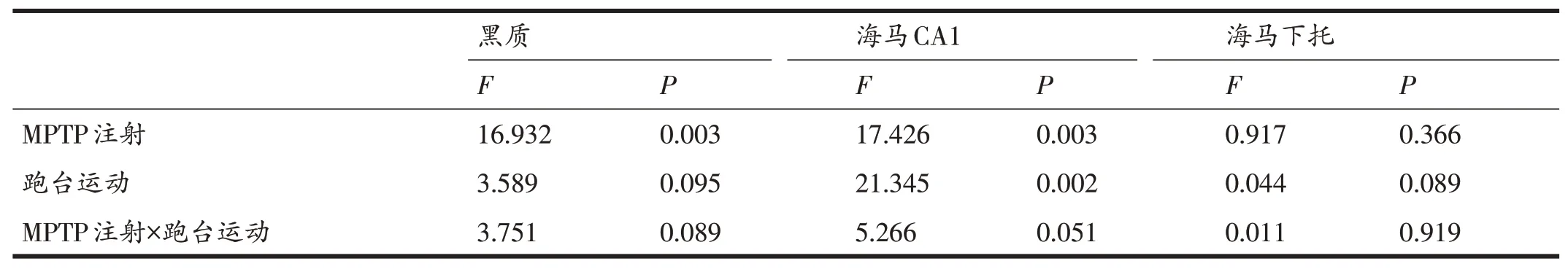
表1 跑台运动和MPTP注射对各部位神经元计数影响的双因素方差分析结果
40倍显微镜下计数不同脑区未损伤神经元数量(表2)发现,与SC组相比,PD组小鼠黑质神经元计数显著减少(P<0.01),海马CA1区和海马下托出现下调的趋势;与SC组相比,SE组小鼠海马CA1区神经元计数显著增加(P<0.01)。与PD组相比,PDE组小鼠黑质神经元计数显著增加(P<0.01),海马下托和海马CA1区神经元计数仅出现了增加的趋势,但不显著。

表2 各组小鼠黑质、海马CA1区以及海马下托神经元计数
2.2 跑台运动对PD模型小鼠不同脑区DAT表达的影响
与SC组相比,PD组小鼠黑质、海马CA1区和海马下托DAT免疫荧光面积均明显减少,SE组明显增加;与PD组相比,PDE组小鼠黑质和海马CA1区DAT免疫荧光面积明显增加(图3)。
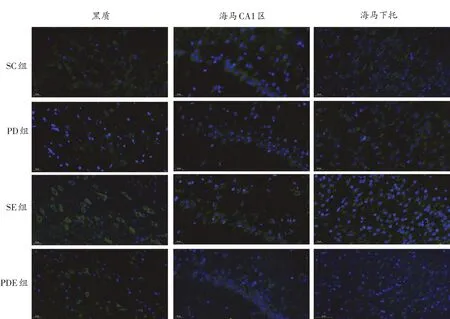
图3 各组小鼠不同脑区DAT免疫荧光染色结果(40×)
双因素方差分析表明,跑台运动和MPTP注射对小鼠黑质(F=0.096,P>0.05)、海马CA1区(F=0.175,P>0.05)和海马下托(F=2.507,P>0.05)DAT蛋白表达均无交互作用。
各组小鼠不同脑区DAT表达(表3)中,与SC组相比,PD组黑质和海马下托DAT表达均显著降低(P<0.05),海马CA1区DAT表达存在下降的趋势但不显著;SE组小鼠黑质和海马下托DAT表达显著升高(P<0.01,P<0.05),海马CA1区DAT表达变化不显著。与PD组相比,PDE组小鼠黑质DAT表达显著升高(P<0.01)。
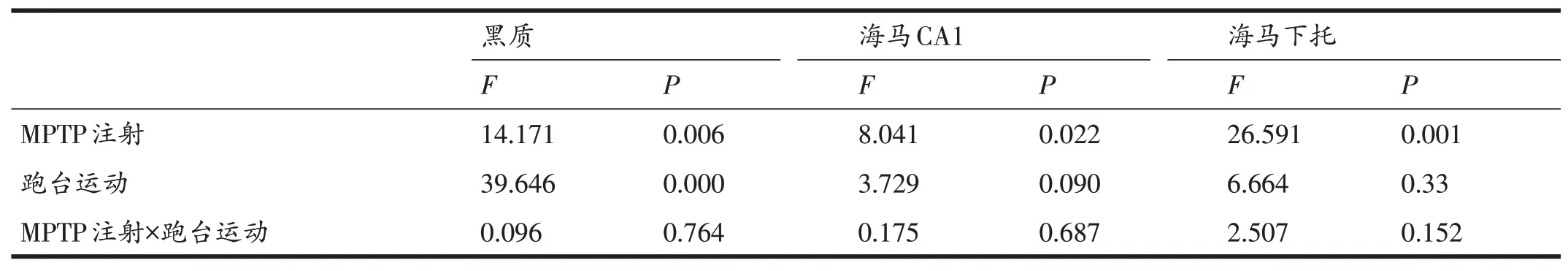
表3 跑台运动和MPTP注射对各部位DAT表达的双因素方差分析结果
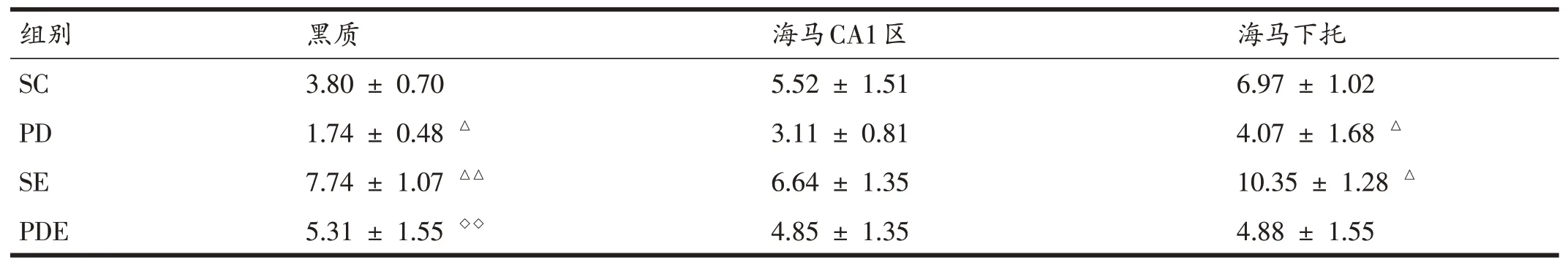
表4 各组小鼠不同脑区DAT表达
2.3 跑台运动对PD模型小鼠不同脑区BDNF和TrkB表达的影响
双因素方差分析表明(表5、6),跑台运动和MPTP注射交互作用对小鼠黑质BDNF(F=0.979,P>0.05)、TrkB表达(F=0.774,P>0.05)、海马CA1区TrkB(F=0.003,P>0.05)以及海马下托TrkB表达(F=0.049,P>0.05)均无显著影响。对小鼠海马CA1区BDNF(F=17.963,P<0.05)和小鼠海马下托BDNF(F=6.523,P<0.05)具有显著影响。

表5 跑台运动和MPTP注射对不同脑区BDNF表达的双因素方差分析结果
与SC组相比,PD组小鼠黑质、海马CA1区及海马下托BDNF和TrkB荧光面积明显较少;黑质、海马下托BDNF和TrkB表达明显降低(P<0.05,P<0.01);海马CA1区BDNF和TrkB表达存在降低的趋势,但不具有统计学意义(P>0.05);SE组小鼠黑质、海马CA1区及海马下托BDNF表达均显著升高(P<0.01、P<0.05、P<0.01),TrkB表达存在升高的趋势但不显著。与PD组相比,PDE组小鼠黑质、海马CA1区及海马下托BDNF和TrkB免疫荧光面积明显增加;黑质、海马CA1区BDNF表达显著升高(P<0.05),黑质、海马CA1区TrkB表达及海马下托BDNF、TrkB表达仅存在升高的趋势。见图4、5和表7。
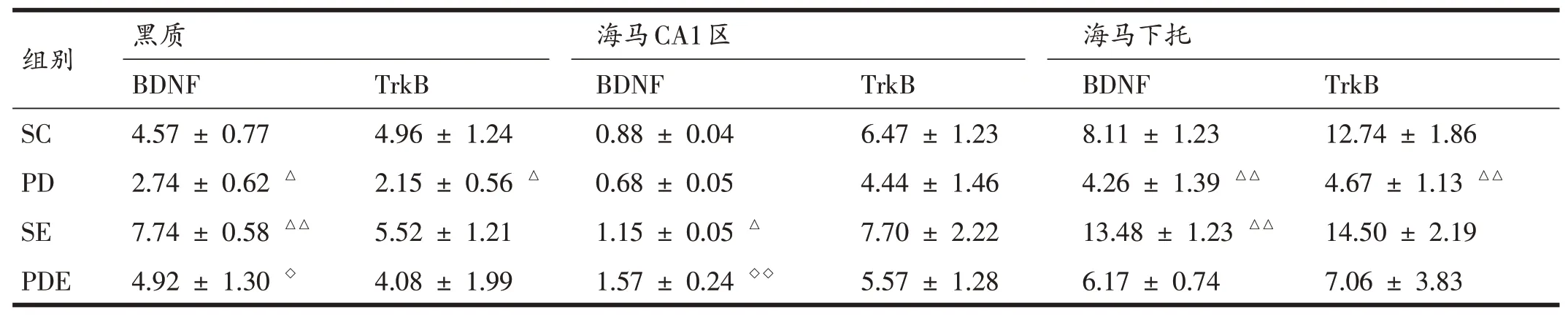
表7 各组小鼠黑质、海马CA1区以及海马下托BDNF和TrkB表达
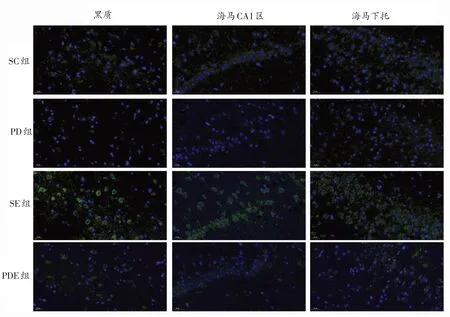
图4 各组小鼠黑质、海马CA1区以及海马下托BDNF表达的变化(40×)
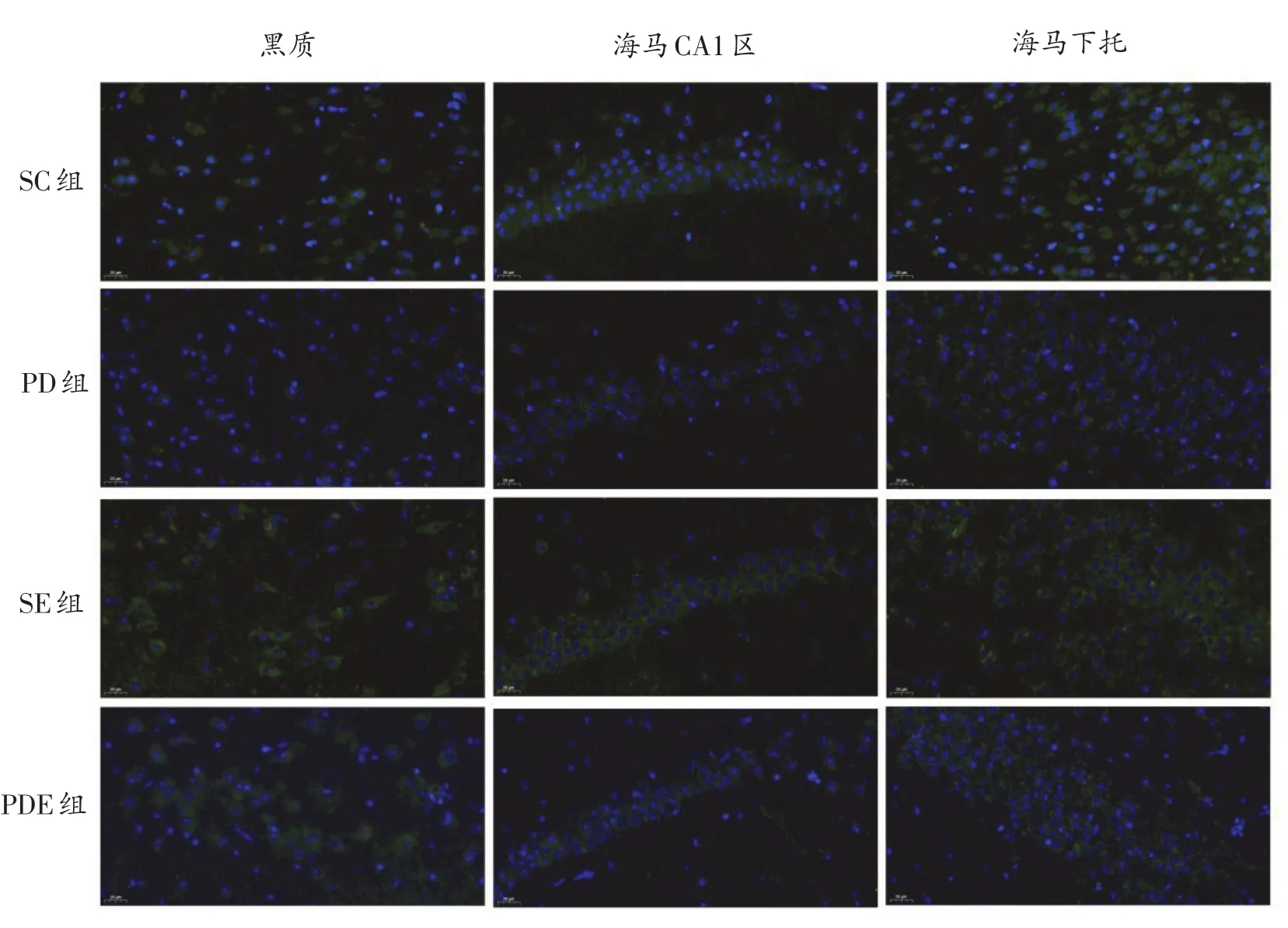
图5 各组小鼠黑质、海马CA1区以及海马下托TrkB表达的变化(40×)

表6 跑台运动和MPTP注射对不同脑区TrkB表达的双因素方差分析结果
3 讨论
DAT是中枢多巴胺能神经末梢膜上的单胺特异性转运蛋白,负责DA从突触间隙转运至突触前膜,是控制大脑中多巴胺水平的关键因子[17]。正常情况下,DA在神经传递过程中稳定的储存于多巴胺能神经元神经末梢中的突触小泡内,并从突触小泡释放到突触间隙;为了终止神经传递,DAT将DA转运到突触终末的细胞质,细胞质中的DA通过囊泡单胺转运蛋白Ⅱ型转运回突触小泡,并稳定储存在突触小泡内[18]。DAT浓度降低或异常表达会导致DA转回突触终末困难,阻碍突触DA重新摄入,临床生物学研究均显示PD等多巴胺神经退行性疾病除表现出明显的行为障碍以外,往往会表现出不同程度DAT受损,而上调DAT表达可以将DA有效的转运至突触末梢,增强突触完整性和传递效率[19,20]。且DAT被认为是检测PD患者黑质多巴胺能神经元神经退行性变化的标志蛋白[21]。因此,观察脑组织DAT可以间接了解多巴胺能神经元退行性变化和DA重摄水平。
本研究中发现PD模型小鼠黑质DAT阳性表达明显降低,下降幅度约54.21%。以往的研究表明,PD动物模型中容易表现出DAT蛋白和基因表达受损。如:Xuan等[21]观察MPTP/丙磺舒诱导的PD模型小鼠发现纹状体DAT密度较正常对照组显著降低30.03%。Gyu等[19]在基于MPTP诱导的PD模型小鼠中观察到,症状前期的黑质DAT mRNA含量与对照组相比无明显变化,而症状期的黑质DAT mRNA含量降低63%;在蛋白表达方面,症状前和症状期的黑质DAT蛋白的表达分别减少了48%和28%,纹状体中DAT蛋白的表达在症状前期和症状期分别比对照组低35%和58%。基于这些研究进一步证实了本研究中慢性MPTP诱导小鼠模型较为成功,并间接证明此时小鼠正处于PD症状期。与此同时,本研究发现跑台运动可以显著提高PD小鼠和正常黑质DAT阳性表达,说明跑台运动在正常或PD小鼠中均能起到促进黑质突触DA重新摄入的效果,这可能是跑台运动改善PD运动症状的原因之一。国外许多研究也得出与本研究相似的结论,认为DAT在跑台运动改善PD模型小鼠行为功能障碍中具有潜在价值。如:Beth[22]等发现跑台运动可以改善PD模型小鼠的纹状体DAT和TH蛋白的表达,提高运动能力。Koo[20]等也发现跑台运动可以通过促进TH和DAT的表达来抑制多巴胺能神经元的丢失,改善MPTP诱导的PD模型小鼠运动功能障碍。
海马是边缘系统的一部分,在长时记忆存储、提取和转换中具有潜在价值。黑质中的多巴胺能神经元可以通过中脑-边缘系统投射海马,促进DA释放入海马,维持海马神经递质的传递和海马突触可塑性。黑质多巴胺能神经元损伤和DA转运回突触前膜受阻,均可导致海马DA耗竭,降低海马神经递质传递效率,进而导致PD等认知障碍;因此,改善海马DAT表达对于改善认知功能具有潜在价值。本研究中发现,PD模型小鼠海马下托DAT阳性表达也显著降低,说明PD小鼠黑质投射的海马下托的DA转运和再摄取能力降低;跑台运动可以显著提高正常海马下托DAT阳性表达,表明跑台运动可以增强黑质及其边缘系统通路中DAT表达,这可能诱导更多的DA被重新吸收回神经元,补偿通路中降低的DA水平。但本研究中未发现运动干预的小鼠海马CA1区中DAT出现明显变化,仅表现出上调的趋势,可能是由于6周跑台运动未能达到防治效果的最大化,对此本课题组将调整运动强度和运动时间进一步跟踪研究。
中枢神经系统中,DA可以与D1R结合,通过PKA/CREB信号通路调节下游BDNF表达;BDNF与其具有高亲和力的TrkB作用,激活胞内多条信号转导通路,诱导转录因子和与神经元增殖、存活和炎症反应等相关的基因表达来抑制神经退行性变[6]。PD模型小鼠神经元中DA转运和再摄取受阻,DA储备降低,会导致BDNF激活受阻,进而导致BDNF低表达,影响神经元增殖、分化及发育。BDNF表达又会反向影响多巴胺能神经元数量,导致多巴胺能神经元数量减少。先前的文献已经证实,敲除BDNF基因的动物脑中多巴胺神经元的数量明显减少;相反,将BDNF载体导入PD患者的纹状体中,又可以改善局部多巴胺能神经元功能,说明多巴胺能神经元生存和行为功能的维持取决于BDNF[23]。临床实验表明,PD患者多巴胺能神经元中BDNF蛋白表达和mRNA水平明显降低[24,25],经各种应激治疗的PD症状减轻的同时BDNF和TrkB蛋白表达升高[26,27]。动物模型实验也表明,震动和跑台运动均能够上调PD模型小鼠脑组织中BDNF表达,促进神经发生、轴突分支和树突形成,预防和减缓神经元凋亡;且运动持续时间越长对PD在细胞核分子水平的增益效果越明显[28,29]。基于国内外诸多研究数据,我们推测上调BDNF和TrkB蛋白表达可能是有效预防或减缓PD运动和非运动症状发展的原因之一。
本研究观察到PD模型小鼠黑质BDNF和TrkB表达均降低,跑台运动干预的PD模型小鼠黑质BDNF和TrkB表达水平存在升高的趋势;同时,黑质神经元细胞的完整性较好,神经元数量增多,说明跑台运动具有增强PD模型小鼠黑质中BDNF和TrkB表达水平的潜力,增强黑质神经元生长、发育以及完整性。以往的研究已经证实,运动能够改善正常人或动物海马神经元的发生,可以通过促进BDNF的释放和信号传导来实现增强内嗅皮质与海马神经元通路之间的神经信号传递[30]。Tuon[31]等发现跑台运动可以显著升高PD模型大鼠海马BDNF和TrkB蛋白表达,该结论与本研究结论相似。海马CA1区和海马下托是记忆形成和提取的关键脑区,该区域BDNF具有促进记忆形成和提取的作用,若BDNF合成或分泌不足将导致记忆难以形成和固有记忆提取困难,PD患者的认知障碍表现为明显的记忆和执行功能发起困难,因此,改善海马CA1和海马下托中BDNF表达有助于改善PD认知症状。以往的研究也证实了海马CA1和海马下托在认知中的潜力。Roy[32]等揭示了海马CA1区和海马下托在记忆中的作用,海马下托调控记忆的提取以及回忆所引起的应激反应,CA1区调控记忆的形成而不是提取过程。因此,我们推测PD患者经常表现出的学习记忆、工作记忆、情景记忆等认知障碍可能与海马CA1区和海马下托受损有关,跑台运动有效改善PD小鼠黑质及其投射的海马CA1区和海马下托中DAT、BDNF蛋白表达,可能是跑台运动改善PD认知症状的原因之一。但本研究未通过阻断剂抑制DAT或BDNF表达,无法直接说明各指标之间的关系。下一步研究将进一步跟进研究。
4 结论
跑台运动可以延缓MPTP染毒导致的小鼠黑质海马CA1区和海马下托中DAT、BDNF和TrkB蛋白表达下调,提示可能是运动预防PD症状的原因之一。

