氯氰菊酯和马拉硫磷对斑马鱼下丘脑-垂体-性腺轴基因的雌激素联合效应
郭东梅,邱静,钱永忠,徐丽红,*,徐明
1. 浙江省农业科学院农产品质量与标准研究所,杭州 310021 2. 中国农业科学院农业质量标准与检测技术研究所,北京100081 3. 北京市化工职业病防治院,北京 100093
在自然界的水生态系统中,残留在水体中的化学污染物,并非以单一的形式存在水环境中,它们通常是以复合污染物的形式残存于环境中[1-3]。然而当前的水生态系统的风险评估研究大多数集中在单一污染物的研究上,而关于复合污染物对水生生物的毒理效应的研究相对较少[4-6]。因此,迫切需要开展农药混合污染物对水生生物的毒理效应研究,来评估混合污染状态下的潜在风险。
氰菊酯作为拟除虫菊酯类农药的一种,在农业和一些卫生害虫防治中被普遍应用[7]。尽管氯氰菊酯农药在土壤环境中不易迁移但是它极易通过径流的方式进入水生生态系统污染水环境[8]。氯氰菊酯农药在水体中被频繁检出,如在巴西的潘塔纳尔盆地的水体中有0.01~9.8 mg·L-1的残留[9-10]。马拉硫磷在全球是一种被广泛应用的农药,低毒且具有较好的杀虫和杀螨效果,防治范围广[11-12]。氯氰菊酯和马拉硫磷的残留物经常在水体中被发现,它们可能共同存在于水生态系统中,并对水生生物造成严重威胁。
斑马鱼的个体比较小,养殖方便,而且生育周期不长,且产卵量高,目前被国内外作为研究内分泌干扰效应的模型毒理学生物[13]。在所有的脊椎动物鱼类中,它的繁殖是由下丘脑-垂体-性腺轴(HPG)来调控的。目前国内研究雌激素内分泌干扰效应主要通过检测HPG轴相关的雌激素基因。
笔者研究了农药(氯氰菊酯、马拉硫磷及其二元混合物)对模型生物斑马鱼胚胎的雌激素作用轴相关基因的联合效应,以期为农药复合污染物对水生态系统的毒理学限量标准提供数据。
1 材料与方法(Materials and methods)
1.1 实验材料
将野生AB系斑马鱼饲养在具有活性炭过滤的水循环系统中,水温度保持恒温(26±1) ℃,pH=8.34,总硬度为28~32度,光/暗周期14 h/10 h。斑马鱼每早、中和晚喂食刚孵化的丰年虾3次。挑选成年斑马鱼雄雌鱼比为1∶2,放入底部具有隔层的孵化池,然后待斑马鱼孵化。收集的胚胎,用暴氧水进行反复清洗,用于胚胎染毒试验。
1.2 试剂
氯氰菊酯原药(95%乳油)和马拉硫磷原药(95%乳油)均购自山东中石药业有限公司;上海生工生物技术有限公司合成引物;美国Invitrogen公司提供荧光定量SYBR Premix、PCR染料和Trizol提取液;北京全式金生物技术有限公司提供反转录试剂盒。
1.3 实验方法
1.3.1 农药对斑马鱼胚胎急性毒性试验
氯氰菊酯和马拉硫磷农药是用丙酮稀释成100 00 mg·L-1贮备液。采用实验室的暴氧水对农药贮备液进行稀释,配制成1.5倍浓度梯度的一系列测试液,配制的测试液中二甲基亚砜(DMSO)终浓度<0.05%。选用24孔细胞培养板进行试验,农药测试时向培养板的每个孔先加入2.5 mL测试液,然后再用移液管向每个孔移进斑马鱼胚胎。每张24孔细胞板作为一个浓度,每一个测试液浓度设置16个孔,空白对照设置4个孔,另外设置4孔作为溶剂的对照组。每个农药测试浓度设置3次实验重复,用封口膜将测试培养板进行封闭,防止溶液挥发。将斑马鱼胚胎放入恒温培养箱培养,设置温度为(26±1) ℃,光照/黑暗周期为14 h/10 h。为了保证测试药液的浓度,测试期间每隔24 h更换暴露药液一次。每24 h调查斑马鱼胚胎的死亡数。
1.3.2 农药对斑马鱼胚胎亚慢性暴露试验
在农药对斑马鱼仔鱼急性毒性试验基础上,基于单一农药LC50值,测试液最高浓度不超过1/20 LC50值,设计了氯氰菊酯(1、2和4 μg·L-1)、马拉硫磷(250、500和1 000 μg·L-1)和氯氰菊酯+马拉硫磷联合暴露组(4 μg·L-1氯氰菊酯+1 000 μg·L-1马拉硫磷、2 μg·L-1氯氰菊酯+500 μg·L-1马拉硫磷和1 μg·L-1氯氰菊酯+250 μg·L-1马拉硫磷)对斑马鱼胚胎的6 d暴露试验。将配制的农药放入烧杯中,然后再移入100个斑马鱼胚胎于烧杯中,配制的每个农药浓度设置3次实验重复。烧杯放置于恒温培养箱中培养,培养条件为:温度(26±1) ℃、光照/黑暗周期14 h/10 h。暴露试验开始后,每隔24 h用相同浓度新鲜的农药药液更换,确保暴露试验药液的浓度保持不变,每天都对处理样品进行观察,及时剔除死亡的胚胎。在斑马鱼的胚胎孵化6 d后,开始每天定时喂2次鸡蛋黄。在暴露5 d和10 d后,从每个农药浓度的暴露处理组中挑取20条存活的仔鱼,立即放置到EP管中,每个暴露浓度处理组分别收集3管处理样品。将处理样品放置-80 ℃冰箱中保存,用于后期的总RNA提取。
1.3.3 总RNA提取和实时荧光定量PCR
RNA的提取和cDNA反转录按照试剂盒的说明书步骤进行操作。采用Quawell超微量分光光度计测定RNA的质量和浓度,测定A260/A280比值在1.8~2.0之间,说明提取的RNA无蛋白质和DNA污染,符合实验要求。实时定量PCR反应条件:95 ℃ 5 min预变性后,95 ℃ 10 s,60 ℃ 15 s,72 ℃ 30 s;40 cycles。所有检测的目标基因引物序列如表1所示。
1.3.4 数据统计与分析
试验数据用统计分析SPSS 16.0软件进行整理和分析,将浓度的对数值设置为自变量(x),斑马鱼的死亡率设置为因变量(y),建立“剂量-效应”线性方程,计算农药的LC50和95%置信区间。
实时荧光定量PCR结果的计算,釆用参照基因的ΔCt法计算目标基因的表达量,并进行对数转换。以18SrRNA作为内参基因,根据目标基因和18SrRNA的Ct釆用2-ΔΔCt方法计算各个目标基因的mRNA相对表达量。
利用SPSS16.0软件对计算的数据进行统计分析,采用单因素方差分析(One-way ANOVO)法,并用LSD(least significant difference)法进行检验,比较不同农药浓度处理组之间的差异显著性(P<0.05为差异显著,用小写字母表示)。
2 结果(Results)
2.1 氯氰菊酯和马拉硫磷对斑马鱼仔鱼急性毒性
采用急性毒性试验,测定了氯氰菊酯和马拉硫磷对斑马鱼胚胎在不同暴露时间的LC50值(表2)。试验结果表明,2种农药对斑马鱼胚胎的毒杀作用在所有暴露时间24、48、72和96 h存在一定的时间-剂量效应关系,并且农药对斑马鱼胚胎的LC50随着暴露时间的延长而逐渐降低。马拉硫磷对斑马鱼胚胎的96 h-LC50值为17.88 mg·L-1。在暴露96 h时,氯氰菊酯对斑马鱼的胚胎LC50值为0.12 mg·L-1,而且其对胚胎的毒性是马拉硫磷对仔鱼毒性的149倍。
2.2 单一农药氯氰菊酯和马拉硫磷对斑马鱼胚胎慢性毒性
在急性毒性试验的基础上,研究了氯氰菊酯和马拉硫磷药剂分别处理斑马鱼胚胎10 d后,对HPG轴雌激素基因(ERα、ERβ1、ERβ2、VTG1、CYP19b、CYP19a和VTG2)表达量的影响(图1和图2)。研究结果表明,氯氰菊酯药剂(1、2和4 μg·L-1)对斑马鱼胚胎处理10 d,斑马鱼体内的CYP19a基因表达和空白对照组的表达相比,表达量明显被抑制。马拉硫磷(250 μg·L-1和500 μg·L-1)对斑马鱼体处理后,能显著增加体内的VTG1和VTG2的基因表达量。马拉硫磷(250、500和1 000 μg·L-1)对斑马鱼体内的CYP19a基因显著抑制。

表1 荧光定量PCR引物序列Table 1 Primer sequences of the fluorescence quantitative PCR

表2 单一农药对斑马鱼仔鱼半数致死浓度(LC50)Table 2 The median lethal concentration (LC50) of zebrafish larvae exposed to various concentrations of single pesticide
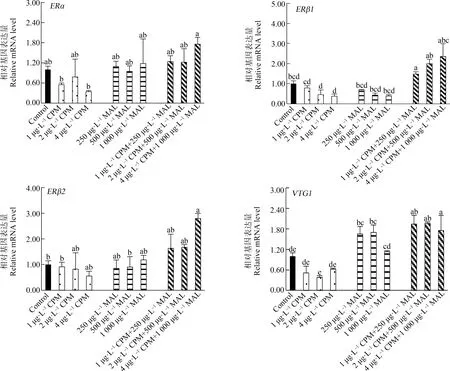
图1 氯氰菊酯、马拉硫磷和氯氰菊酯+马拉硫磷联合暴露对斑马鱼幼鱼下丘脑-垂体-性腺轴基因表达量的影响注:CPM为氯氰菊酯,MAL为马拉硫磷,CPM+MAL为氯氰菊酯+马拉硫磷;ERα、ERβ1和ERβ2为雌激素受体基因,VTG1为卵黄蛋白基因。Fig. 1 Effects of exposure to cypermethrin, malathion and cypermethrin+malathion on gene expression in hypothalamic-pituitary-gonad axis in juvenile zebrafishNote: CPM is cypermethrin, MAL is malathion, and CPM+MAL is cypermethrin+malathion; ERα, ERβ1 and ERβ2 are estrogen receptor genes, and VTG1 is vitelloprotein gene.
2.3 氯氰菊酯和马拉硫磷复合污染对斑马鱼胚胎慢性毒性
在研究了氯氰菊酯和马拉硫磷单一农药对斑马鱼胚胎的雌激素效应的基础上,也进行了氯氰菊酯和马拉硫磷的混合污染对斑马鱼胚胎的雌激素联合效应研究。1 μg·L-1氯氰菊酯+250 μg·L-1马拉硫磷对斑马鱼胚胎暴露10 d,斑马鱼体内的HGP轴ERβ1基因的表达和空白对照组表达相比,表达量被显著增加。4 μg·L-1氯氰菊酯+1 000 μg·L-1马拉硫磷对斑马鱼胚胎暴露10 d,斑马鱼体内的HPG轴VTG1基因表达和空白对照组表达相比,表达量被显著增加。1 μg·L-1氯氰菊酯+250 μg·L-1马拉硫磷、2 μg·L-1氯氰菊酯+500 μg·L-1马拉硫磷和4 μg·L-1氯氰菊酯+1 000 μg·L-1马拉硫磷对斑马鱼胚胎暴露10 d,斑马鱼体内的HPG轴CYP19b基因表达和空白对照组表达相比,表达量被显著增加。2 μg·L-1氯氰菊酯+500 μg·L-1马拉硫磷和4 μg·L-1氯氰菊酯+1 000 μg·L-1马拉硫磷对斑马鱼胚胎暴露10 d,斑马鱼体内的HPG轴CYP19a基因表达和单一农药处理组表达相比,表达量呈显著上调。氯氰菊酯和马拉硫磷联合暴露组,在不同联合暴露浓度下可以与不同的雌激素受体结合,增强雌激素效应。

图2 氯氰菊酯、马拉硫磷和氯氰菊酯+马拉硫磷联合暴露对斑马鱼幼鱼下丘脑-垂体-性腺轴基因表达量的影响注:CPM为氯氰菊酯,MAL为马拉硫磷,CPM+MAL为氯氰菊酯+马拉硫磷;VTG2为卵黄蛋白基因,CYP19a和CYP19b为芳香化酶基因。Fig. 2 Effects of exposure to cypermethrin, malathion and cypermethrin+malathion on gene expression in hypothalamic-pituitary-gonad axis in juvenile zebrafishNote: CPM is cypermethrin, MAL is malathion, and CPM+MAL is cypermethrin+malathion; VTG2 is vitelloprotein gene, and CYP19a and CYP19b are aromatase genes.
3 讨论(Discussion)
斑马鱼对外源污染物有较高的敏感性,在本研究中,氯氰菊酯和马拉硫磷2种农药对斑马鱼仔鱼毒性分别属于高等毒性和低等毒性。在以往的报道中,拟除虫菊酯类农药(氯氰菊酯)对鱼类(鲤鱼、尼罗罗非鱼、虹鳟和褐鳟鱼)的毒性均属于高等毒性[14],这类农药对鱼类具有高等毒性的原因是鱼鳃对农药水解率相对比较缓慢,但却对农药有较高的吸收率,且鱼类神经系统对菊酯类农药敏感性较强[15-16]。
斑马鱼在无外源污染物的暴露下,幼鱼体内VTG基因的含量较低,但当斑马鱼幼鱼受到其他环境雌激素污染物诱导时,采用分子生物学手段就能检测到鱼体肝脏内的VTG基因。目前斑马鱼体内VTG基因已作为评价雌激素内分泌干扰物敏感的特定生物标志物[17]。雌激素的生理作用是通过靶细胞特异性的受体介导的,在硬骨鱼类中雌激素受体基因主要有3种,为ERα、ERβ1和ERβ2[18]。雌激素的合成是通过芳香化酶(CYP19)催化雄激素(如睾酮和雄烯二酮)转化成雌激素(如雌二醇)[18-19]。在本研究中斑马鱼体内的HPG轴的VTG1和VTG2基因能被一定浓度的马拉硫磷显著诱导,表明了马拉硫磷对斑马鱼具有雌激素内分泌干扰活性。以往研究也表明,马拉硫磷对MVLN细胞和中国仓鼠卵巢细胞(CHO)具有弱的雌激素效应[20-21]。在本研究中,马拉硫磷对斑马鱼胚胎具有一定的雌激素效应,它可能通过介导雌激素受体和改变芳香化酶活性来实现雌激素效应。
在天然的水生态系统中,污染物并非以单体形式单独存在,而是往往以复杂污染物的形式存在,因此目前关于复合污染物的混合效应研究受到了更大的关注。二元农药氯氰菊酯和马拉硫磷复合污染对斑马鱼胚胎暴露研究表明,在一定时间和剂量下二元农药混合物能显著增加斑马鱼体内的HPG轴VTG1的基因表达量,这表明2种农药联合显著增强雌激素效应,并能显著改变雌激素受体和芳香化酶的活性来增加雌激素效应。Wang等[22]研究了4种农药(辛硫磷、氯氟氰菊酯、毒死蜱和乙草胺)的二元、三元、四元和多元混合污染对模式生物体蚯蚓的联合毒性效应,结果表明,多种农药混合时(三元和四元农药)对蚯蚓的联合毒性作用均表现协同作用。当多种农药残留污染共存时,对水生生物体可能产生复杂的混合毒性污染效应。因此,在未来研究中有必要更多关注混合污染物的复合毒理效应及其复合污染的风险评估。

