靶向甲型流感病毒血凝素的人源单克隆抗体研究进展
王春颖,李延柏,尹 哲,霍珊珊,3,于 飞,3
(1. 保定市妇幼保健院,河北 保定 071066;2. 河北农业大学 生命科学学院,河北 保定 071001;3.河北省人畜共患病原微生物分析与防控重点实验室,河北 保定 071001)
呼吸道病毒始终是威胁人类健康的最主要元凶之一,给公共卫生带来巨大挑战。2019 年底爆发的新型冠状肺炎(COVID-19)已经造成全世界范围内5.2 亿人感染,约630 万的人死亡,引发巨大的人员经济损失,目前感染人数和死亡人数仍在增加[1]。除此之外,具有高致病性和感染性的流感病毒(Influenza virus,IV)同样引人注目,其中就包括流感的大流行,季节性流感以及禽流感的跨种传播[2]。虽然国家和政府每年都提倡按时接种相应年份的疫苗,但是根据世界卫生组织报道,流感季节性流行每年在全球依然可导致300 ~500 万重症病例,29 ~65 万呼吸道疾病相关死亡[3]。上个世纪以来,IV 经历了4 次大流行,包括1918 年的H1N1,1957—1958 年的H2N2,1968 年的H3N2,以及2009 年的H1N1,均造成了大量的人员死亡[4]。除此外,高致病性禽流感病毒H5N1 和H7N9 在人类中的爆发以及H5N6 和H5N8 的跨物种传播同样不容忽视[5-8]。
IV 属于正粘病毒科,根据其核蛋白和基质蛋白抗原的不同分为甲、乙、丙、丁4 种类型[1-9]。其中甲型流感病毒(Influenza A virus,IAV)的致病性最强,其RNA 具有8 个片段,负责编码病毒的各个蛋白结构[10]。IAV 表面存在2 种糖蛋白,血凝素(Hemagglutinin,HA)和神经氨酸酶(Neuraminidase,NA)。根据序列比较和结构特征的差异,HA 的18 种亚型分为2 组,I 组包括H1、H2、H5、H6、H8、H9、H11、H12、H13、H16、H17、H18,II组 包 括H3、H4、H7、H10、H14、H15[11]。成 熟的HA 分为Head(HA1)和Stalk(HA1/HA2)2 部分,通过二硫键连接[12]。前者帮助病毒识别宿主表面的唾液酸受体,后者在低pH 的介导下促进病毒膜与宿主膜的融合释放病毒基因组[11]。鉴于HA 在病毒侵染过程中发挥的重要作用,常被作为单克隆抗体药物研发的靶点。
单克隆抗体药物是近年来药物研究的热点方向,这主要源于它的高亲和活性和生物活性,但还没有针对IAV HA 的抗体药物获得上市批准。因此,本文就目前靶向IAV HA 的单克隆抗体研究进行综述,旨在为抗IV 药物的研发提供新的思路。
1 靶向Head 的抗体
1.1 靶向受体结合区
由于受体结合区(Receptor binding domain,RBD)的特殊功能性,位于HA Head 的RBD 相对保守,其主要包含130 环、150 环、190 螺旋以及220 环,因此,RBD 常作为单克隆抗体的识别位点,并通过与唾液酸的竞争性结合抑制IV 的感染(图1)。
CH65 是从分选的单个浆细胞中分离并通过重组重链和轻链得到的[13],它模拟唾液酸,通过重链互补决定区3(Heavy chains complementary determining region,HCDR3) 与H1 Head 的RBD结合,可中和30 种H1N1 病毒,有效抑制浓度低至0.012 μg/mL(表1)[13]。CH67、641 I-9、H2526和5J8 是与CH65 相似的几种单抗,它们从不同方向利用HDCR3 上的一个关键二肽与H1 RBD 结合,能够有效抑制病毒(表1)[14]。Xu 等从人的外周血中分离到3 个H2N2 特异性单抗8F8、8M2 和2G1。其中8F8 通过HCDR3 上的Tyr100 与RBD 结合,8M2 和2G1 通 过HCDR2 上 的Phe54 与RBD结合,并以空间位阻的方式阻止病毒与唾液酸结合(表1)[15]。L4A-14、L3A-44 和L4B-18 是从感染H7N9 志愿者体内分离得到的,对多种H7 均具有中和活性。晶体结构表明,L4A-14 靶向HA 的RBD 区 域,而L3A-44 和L4B-18 识 别RBD 外 周的氨基酸残基[16]。在体内预防试验中,20 mg/kg的L4A-14 能够100%保护小鼠,且体重恢复相对较快,而L3A-44 则需要30 mg/kg 的剂量才能提供完全保护,L4B-18 不能帮助小鼠抵抗致命性的感染。除了预防效果以外,L4A-14 和L3A-44 同样能够起到较好的治疗效果(表1)[16]。
1.2 靶向抗原位点
IV 感染或疫苗接种产生的中和抗体通常靶向位于HA-Head 上的抗原。目前已经对H1-和H3-Head 上 的5 个 抗 原 位 点 进 行 了 鉴 定:Sa、Sb、Ca1、Ca2 和Cb,或A 到E 位点(图1)。
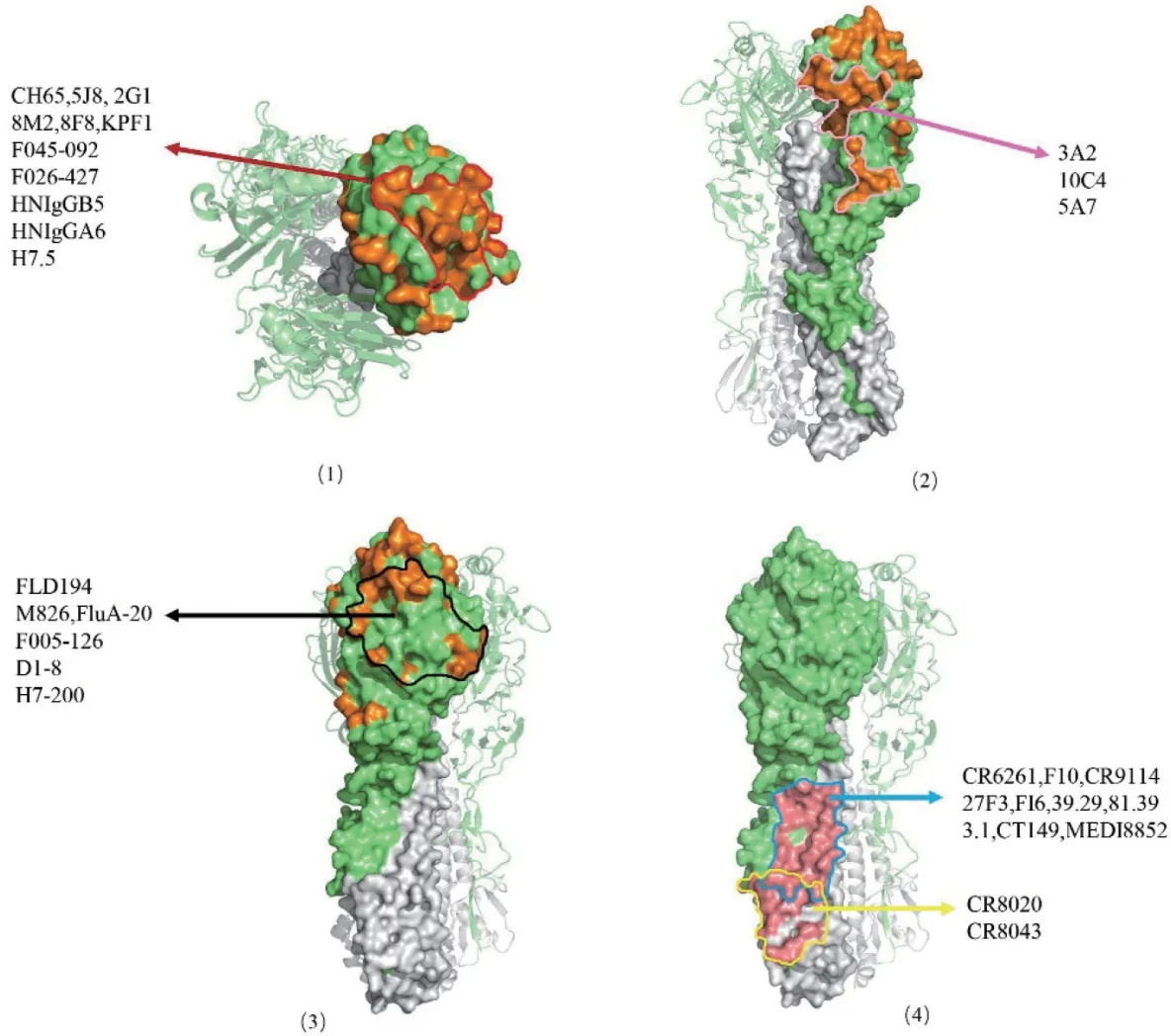
图1 针对流感病毒HA 的单克隆抗体表位概述Fig. 1 Overview of monoclonal antibody epitopes against influenza virus HA
从利用噬菌体展示技术构建的抗体库中筛选出具有广泛交叉反应活性的单抗F045-092 和F026-427[17]。这些靶向HA-Head 的单抗可以通过抑制HA 与唾液酸的结合来中和多种亚型,包括H1、H2、H3 和H5,此外,F045-092 与H1 结合的晶体结构显示:结合位点位于抗原A 和B 附近(表1)[17]。F005-126 从噬菌体展示库中分离得到,能广泛中和H3N2 病毒[18]。F005-126 的表位穿过了2 个HA单体的裂缝,其中一个对应于Ca1 位点的多肽在H3亚型中相对保守,只有少量氨基酸差异,可以通过抑制低pH 诱导的HA 介导的膜融合来中和H3N2 病毒(表1)[18]。
D1-8 是来自于人B 细胞的一种独特的单抗,它靶向H3-Head 抗原位点Ca2 近端新保守的表位[19]。D1-8 对H3 病毒具有广泛的中和活性。此外,在剂量依赖的方式下,D1-8 被证明比奥司他韦治疗感染小鼠更有效(表1)[19]。FLD194 对H5N1 亚型高致病性禽流感病毒具有较强的抑制作用,IC90低至0.007 μg/mL[20]。在感染前注射2.5 和7.5 mg/kg 的FLD194,能够分别保护感染致死剂量的H5N1 的小鼠和雪貂,从而降低肺部病毒滴度。FLD194 通过5个CDRs 与多个抗原位点结合,并利用Fc 片段阻断HA 与唾液酸的结合抑制病毒(表1)[20]。Nogales等从接种疫苗的志愿者外周血细胞中分离出单抗KPF1,该单抗识别抗原位点Ca 和Cb 之间高度保守的氨基酸(表1),具有广泛中和H1 株的活性[21]。体内试验显示,1 或10 mg/kg 的KPF1 可保护小鼠免受H1 病毒的致死剂量感染[21]。随后,研究小组利用烟草表达系统生产KPF1,它与哺乳动物细胞表达系统生产的KPF1 在中和H1N1 毒株时具有相同的活性,剂量低至0.271 μg/mL[22]。20 mg/kg 烟草表达系统生产的KPF1 既能预防感染,又能治疗感染H1N1 病毒的豚鼠,防止病毒传播[22]。这是首次报道植物表达系统生产的抗IAV 人源单抗在体外和体内均具有活性,为产生新的单抗提供了一种新的免疫疗法(表1)。
1.3 其他
通过筛选H7N9 康复患者的噬菌体抗体库,获得2 种 单 克 隆 抗 体HNIgGA6 和HNIgGB5[23]。186V 和226L 2 个氨基酸是2 种单抗识别H7 HA 的关键,对H7N9 具有高的中和活性,且呈剂量依赖性[23]。在HA 抑制试验中,HNIgGA6 和HNIgGB5的有效抑制浓度分别为0.8 μg/mL 和1.6 μg/mL。此外,HNIgGA6 和HNIgGB5 能有效治疗感染致死剂量H7N9 的BALB/c 小鼠(图1,表1)[23]。
在酸性pH 条件下,单抗M826 与H7N9 HA 具有纳摩尔以下的亲和力[24]。晶体结构表明,低pH诱导HA 三聚体的构象发生变化时,M826 的结合位点能够完全暴露,并且,该位点是H7 HA 中存在的一个独特的表位[24]。该抗体通过介导抗体依赖性细胞介导的细胞毒作用(Antibody-dependent cellmediated cytotoxicity,ADCC)的方式保护BALB/c小鼠免受致死剂量H7N9 的攻击(表1)[24]。
单抗FluA-20 能识别几乎所有IAVs 亚型的Head 区域,其中和活性为5-142 ng/mL[25]。与其他单克隆抗体不同的是,FluA-20 靶向于HA 三聚体界面的一个新位点,该位点与RBD 相邻,但不重叠,并且在不同的IAV 亚型中高度保守[25]。该位点以前被认为是稳定的,且抗体无法进入。FluA-20 通过与三聚体界面的短暂接触破坏HA 的三聚体结构,从而抑制病毒传播[25]。试验证明,10 mg/kg的单抗可保护小鼠免受亚致死和致死剂量H1N1、H3N2、H5N1 和H7N9 毒 株 的 感 染[25]。之 后,Turner 等报道了1 种类似的H7 特异性单抗H7.5,其识别位点位于早期的HA-Head[26]。只要很少的接触,就可以诱导HA 的三聚体解离,防止HA 完全暴露在唾液酸中,从而阻止病毒融合(表1)[26]。H7-200 是识别H7-HA1 的特异性单克隆抗体,作用机制与FluA-20 相似,通过作用于HA 三聚体的内部界面,从而促使HA 的三聚体构象发生解离[27]。与FluA-20 相比,H7-200 具有更高的亲和活性,同时,它还存在结合H15 HA 的能力。体内预防实验显示,H7-200 能有效保护感染H7N9 的小鼠并降低临床症状(表1)[27]。
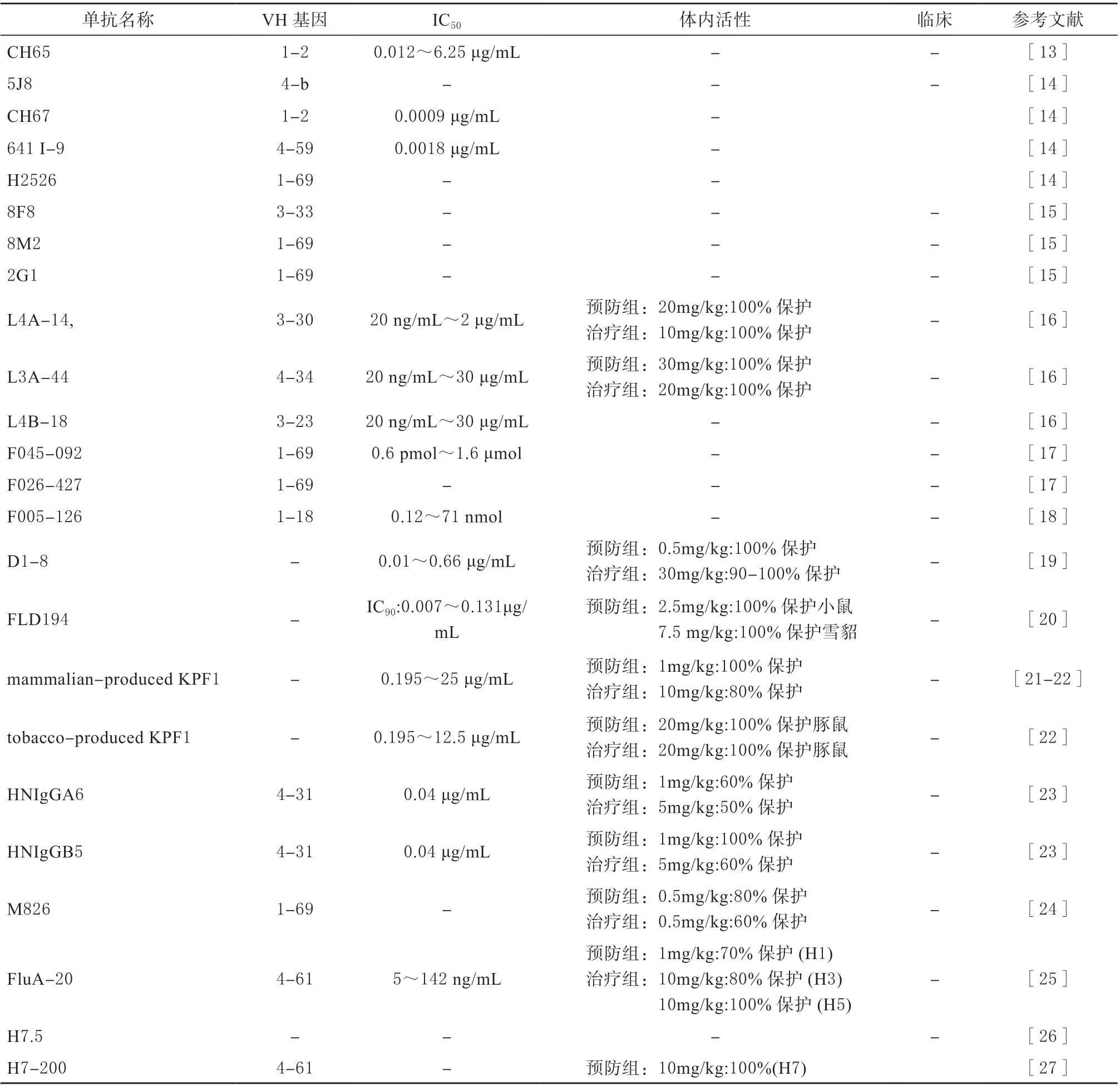
表1 靶向HA-Head 的单克隆抗体Table 1 Monoclonal antibodies targeting HA-Head
2 靶向Stalk 的抗体
2.1 VH1-69 基因编码的单克隆抗体
VH1-69 基因是人类唯一编码HCDR2 环末端2个疏水残基的重链基因,VH1-69 类单克隆抗体可以通过自身的重链识别Stalk 上的疏水沟槽结构,从而发挥抑制作用[28-29]。目前,多种VH1-69 基因编码的单克隆抗体被报道,这些抗体通常能够针对HA 的多种亚型,具有高度的广谱性(图1)[28-30]。
CR6261 单抗是从接种流感疫苗的志愿者记忆B细胞构建的噬菌体抗体库中分离出来的[31-32],该单抗对H1、H3、H5、H6、H8、H9 亚型具有中和活性,其浓度范围是0.12 ~50 μg/mL[31]。CR6261 的作用机制是结合HA-Stalk 的保守疏水口袋[31-33]。此外,5 mg/kg 的单抗可以保护小鼠免受H5N1 和H1N1 病毒的致命攻击(表2)[31]。此外,另外一种具有广谱中和活性的单抗CR8020 也被筛选出来,该单抗能够中和H1、H3、H4、H5、H7、H9 和H10 亚型的流感病毒,其活性低至1.1 μg/mL[34]。晶体结构表明,CR8020 识别了靠近病毒膜的HA-Stalk 高度保守的位点[34]。在体内,3 mg/kg 的CR8020 能有效预防和保护致死剂量H3N2 和H7N7 的小鼠感染(表2)[34]。CR8043 通过不同的残基和角度作用于CR8020 相似的表位,在体外与H3 和H10 具有较高的亲和力[35],高于3 mg/kg 剂量的CR8043 可保护小鼠免受H3N2 和H7N7 感染(表2)[35]。单抗F10 可以中和所有的I 组IAVs,包括H5N1,它通过结合HA-Stalk 的保守的疏水槽来阻止病毒膜与核内体膜的融合[36],10 mg/kg 的F10 可预防感染并治疗H5N1 感染小鼠(表2)[36]。CR9114 是从接种过季节性流感疫苗的志愿者的B 细胞组合展示库中分离得到的[33],它通过结合HA-Stalk 高度保守的位点,阻断pH 诱导的HA 与膜融合相关的构象变化[33]。CR9114 与H1、H3、H7、H9 和IBV HA具有良好的交叉反应性。研究表明高于1.7 mg/kg剂量的单抗CR9114 可以保护小鼠免受几种不同亚型IAVs 的致命攻击(表2)[33]。SUN 等从感染H5N1 的患者体内分离出了2 种广泛中和抗体2-12D5 和3-37G7.1,对试验测试的H1、H5 和H6均有较好的中和活性和ADCC 活性。其中2-12D5由VH1-69 编码,3-37G7.1 由VH1-2 编码,它们靶向与CR6261 相似的位点,位于HA2 上的氨基酸残基I45 是关键的氨基酸结合位点(表2)[37]。
单抗27F3 经噬菌体展示库分离得到,它主要通过HCDR2 结合HA-Stalk 的疏水槽,HCDR1 与HA2 形成2 个氢键,其有效抑制浓度为0.008 ~4.8 μg/mL,可广泛识别I 组和II 组的IAVs 亚型(表2)[30]。从人外周血浆细胞中分离出一种广泛中和的单抗FI6[38],该单抗可识别16 种亚型(H1-16)的HA,并中和I 组和II 组的IAVs[38]。X 射线晶体学分析表明,FI6 的HCDR3 环结合在HA-Stalk的融合肽子域的一个保守位点上[38]。4 和15 mg/kg的FI6 分别能预防和治疗感染H1N1 的BALB/c 小鼠,另有试验表明,该单抗能保护雪貂抵抗高致病性禽流感H5N1(表2)[38]。从噬菌体展示库中分离出的单抗3.1 能有效中和H1、H2、H5、H6 亚型IAVs[39],该单抗由VH3-30 编码,并通过HCDR1 和HCDR3环与疏水沟槽结合[39]。单次注射10 mg/kg 的单抗3.1 可提供完全的保护并防止体重下降(表2)[39]。CT149 是从2009 年H1N1 大流行患者体内分离出来的一种具有广泛中和活性的单抗[40]。晶体结构表明,CT149 的表位位于Stalk 融合肽中,它通过抑制低pH 诱导的HA 介导的膜融合过程,能够中和I 组和II 组(H1、H2、H3、H7、H9)中所有测试的IAVs[40]。此外,它还可以介导ADCC 和CDC 促进感染细胞凋亡[40]。在体内中和实验中,该单抗对感染多种IAVs 亚型的小鼠提供有效保护(表2)[40]。
2.2 其他基因编码的单克隆抗体
从接种H1N1 流感疫苗的志愿者血浆细胞中分离到3 株单克隆抗体,分别为05-2G02、09-2A06和09-3A01,经竞争性ELISA 和序列同源性分析证明,抗体与HA-Stalk 结合[41]。这3 种单抗均能中和所有检测到的H1N1 毒株,其中05-2G02 对H3N2 和H5N1 也有广泛的中和活性(表2)[41]。同样,Nakamura 等[42]分离出39.29 和81.39 2 个单抗,可以中和H1、H2 和H3 亚型, 抑制活性分别为1.3 ~45.1 nmol 和0.65 ~26.3 nmol。晶体结构表明,39.29 的表位位于HA2 螺旋A 的顶部[42]。竞争ELISA 结 果 显 示,81.39 与39.29 在H3 Stalk 上的位点存在重叠[42]。与奥司他韦相比,45 mg/kg的39.29 对H1N1 和H3N2 病毒感染的小鼠和雪貂的治疗效果更好。此外,39.29 与奥司他韦联合使用具有协同作用(表2)[42]。在II 期临床试验中,虽然39.29(MHAA4549A)被证明具有良好的耐受性,并显著降低了流感相关症状,但在二期临床评估后,终止了单抗和奥司他韦联合治疗住院的严重流感患者的相关实验[43-44]。单抗81.39a 是亲本81.39 的衍生物,可有效中和16 个亚型,活性浓度为0.01 ~4.9 μg/mL[45]。在小鼠模型中,用15 或45 mg/kg 的81.39a 单次注射治疗感染H5Nx、H6N1 或H7N9 病毒的小鼠,证明其能抑制病毒复制和阻止体重减轻[45]。此外,25 mg/kg 的81.39a 可有效降低H1N1感染雪貂的病毒滴度,减轻肺部病变(表2)[45]。
VIS410 靶向HA-Stalk,可广泛中和H1、H3 和H5 亚型,抑制活性为0.3 ~11 μg/mL[46]。在体内试验中,VIS410 能够有效保护感染H3N2 和H7N9的BALB/c小鼠,且与奥司他韦联用具有协同作用(表2)[46]。之后的临床试验旨在评价使用VIS410 治疗是否会降低高危人群的发病率,减少严重疾病的发生,并建立了流行微观模拟模型[47]。结果表明,VIS410 总体上是安全的,具有降低疾病发生率的潜力,可大大降低65 岁以上人群的住院率,可推荐作为治疗或预防IAVs 的药物[47]。近期,又在非住院感染IAVs 患者中评估了VIS410 的安全性和耐受性,证明了该单抗能够有效缓解症状,抑制病毒复制[48]。这为开发治疗和预防严重流感感染的疫苗提供了有力支持[48]。
MEDI8852 是一种广谱性人源单抗,可有效对抗所有HA 亚型IAVs, 抑制活性为0.41~4.05 μg/mL[49]。它是通过将CDRs 中的低频突变位点与框架中不必要的体细胞恢复突变相结合来优化供体记忆B 细胞FY1 的效力、广度和低体细胞突变而产生的[49-50]。MEDI8852 通过CDRs 与融合区域的疏水槽和大部分融合肽结合[49]。与其他单克隆抗体相比,它具有更高的抗体中和广度和效价,在小鼠和雪貂模型中,25 mg/kg 的MEDI8852 治疗效果优于奥司他韦(表2)[49-51]。然而,在随后的临床试验中,MEDI8852 产生了不良反应,而与奥司他韦联合用药治疗单一流感的研究由于受试者人数较少,无法证实有效的临床意义。因此,没有进入II 期试验[52-53]。
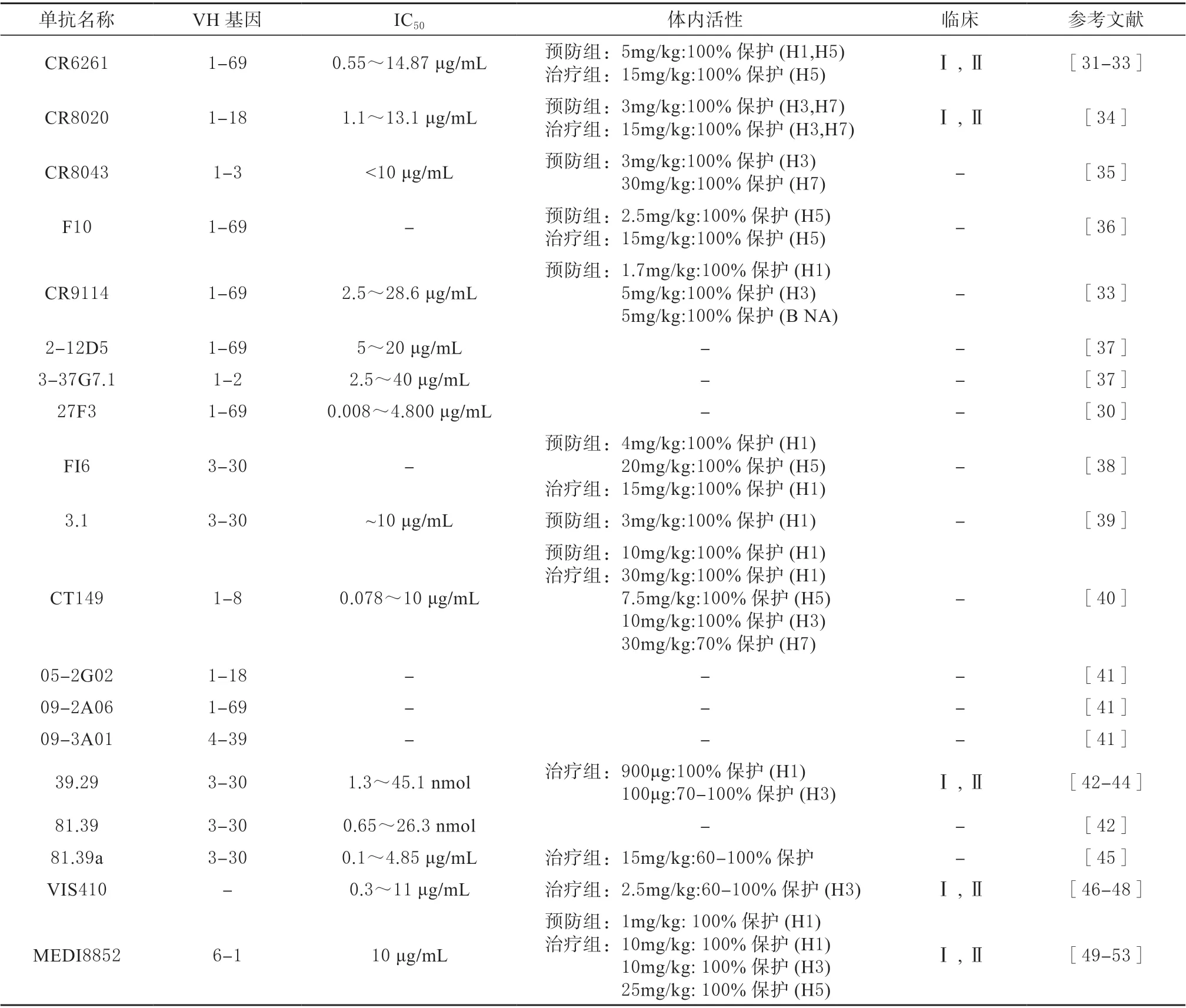
表2 靶向HA-Stalk 的单克隆抗体Table 2 Monoclonal antibodies targeting HA-Stalk
3 讨论和展望
IBV 与IAV 共同构成了流感的季节性流行,其主要在儿童和老人等群体之间传播。为了更好的预防流感,可以通过建立足够大的抗体库,提高筛选更具广谱性的单克隆抗体的可能性。同时为预防交叉感染,降低IV 的影响力,研究靶向IBV 的单克隆抗体也是具有重要意义的。在IBV RBD 和Stalk 之间的残留酯酶结构域相对保守,可以作为单抗识别位点[33]。有研究证明,CR8071 与该位点结合,保护感染Victoria 和Yamagata 2 种谱系的IBVs 的小鼠接受致死剂量的挑战,尽管效力较小,但已经为后续更多针对IBVs 特异性抗体的研发提供了范例[33]。
目前,研发利用中和活性抑制IV 的单克隆抗体是抗体药物研究的主要方向,但也可以同时开发具有其他作用机制的抗体,例如通过介导ADCC 发挥作用,目前有多种单克隆抗体可以实现这一功能。如Yu 等开发的M826,它通过介导ADCC 保护感染H7 IAV 的小鼠正常存活[24];靶向IBV 的特异性单抗46B8 和C12G6 同样可以介导ADCC[54-55]。
在通常情况下,单一抗体所结合的流感亚型通常是有限的,多种单克隆抗体的综合使用可能会提高药物的治疗效率。例如CR8020 与CR6261 识别位点不同,但2 种单抗协同治疗能够中和大多数IAV 亚型[34]。
综上所述,应用能中和多种亚型的人单抗是预防和治疗流感最有效的方法,也是未来研究的一个主要方向。然而,由于HA 的抗原漂移,单抗治疗往往不能达到预期的效果。这就需要进一步探索HA 上保守位点及其作用机制。

