尼拉帕尼合成研究进展(一)
陈慧杰,王秀军
(江苏海洋大学药学院,江苏 连云港 222005)
尼拉帕尼(niraparib)化学名(S)-2-(4-(哌啶-3-基)苯基)-2H-吲唑-7-羧酰胺(结构式见图1),是一种多聚腺苷二磷酸核糖聚合酶(PARP-1,PARP-2)抑制剂,主要用于卵巢癌的治疗[1],具有药效高、服用安全等优点和广阔的市场前景。尼拉帕尼于2017年3月27日获得美国食品药品监督管理局(FDA)批准上市,商品名为Zejula,其有效成分为甲磺酸尼拉帕尼。

图1 尼拉帕尼的结构式
目前已在全球上市的PARP抑制剂主要有4款,分别是阿斯利康的奥拉帕尼(Olaparib),美国克洛维司肿瘤公司的卢卡帕尼(Rucaparib),尼拉帕尼以及2018年在中国获批上市辉瑞公司的他拉唑帕尼(Talazoparib)[2]。4款药物详细对比信息见表1[3]。尼拉帕尼与其他PARP抑制剂相比主要有以下3点优势:1)尼拉帕尼作为第3款上市的PARP抑制剂与奥拉帕尼和卢卡帕尼相比活性更优,半衰期更长,每日服药一次即可;2)尼拉帕尼易通过血脑屏障,对于卵巢癌脑转移患者疗效较好;3)无论患者是否存在BRCA突变,无论HRD阳性或阴性,皆可使用尼拉帕尼进行维持治疗。

表1 PAPR抑制剂活性对比
基于尼拉帕尼对于卵巢癌的良好疗效,因此寻找一条适合大生产的尼拉帕尼合成工艺具有重要意义。本文则对尼拉帕尼文献报道的10条合成路线进行归纳、比较,以期对尼拉帕尼的合成研究并为工业化生产提供参考依据。
1 以3-甲基-2-硝基苯甲酸(2)为起始原料
2008年,Jones等[4]采用3-甲基-2-硝基苯甲酸为原料,经酯化,苄基溴代,再用N-甲基吗啉-N-氧化物(NMMO)氧化得到相应的苯甲醛(4)。醛和胺缩合后利用叠氮化钠在高温下处理实现关环,引入最终的氮原子并挤压氮原子形成吲唑环,同时也可将该化合物6在氨溶液中加热转化为羧酸进行酰胺偶合来实现。最终使用手性SFC分离得到尼拉帕尼,见图2。该反应总收率8.8%。
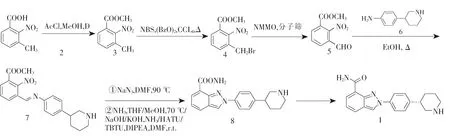
图2 尼拉帕尼合成路线一
2 以三吡啶硼酸(9)与1-碘代-4-硝基苯(10)为起始原料
2011年,Wallace等[5]提出了以三吡啶硼酸与1-碘代-4-硝基苯为起始原料的工艺路线。该工艺通过缩合、还原、手性拆分、哌啶氮保护得化合物13,后进一步与芳香醛化合物5缩合得到关键中间体14,化合物14再经叠氮化、环化反应、酰胺化反应、脱保护和成盐反应得到尼拉帕尼盐酸盐粗品,最后通过手性HPLC纯化得目标产物,见图3。该路线涉及酒石酸拆分和手性色谱分离,比较繁琐,总收率不到10%,成本较高,工艺放大后只适合百克级别的生产,另外该工艺生成的盐酸盐容易吸潮,不利于贮存。
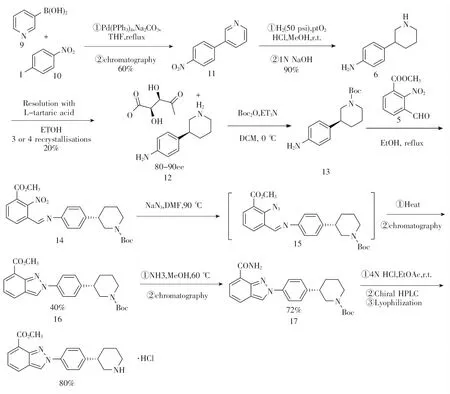
图3 尼拉帕尼合成路线二
3 以三吡啶硼酸(9)与1-溴代-4-硝基苯(18)为起始原料
路线三是Wallace等[5]对路线二的改进(见图4),以三吡啶硼酸与1-溴代-4-硝基苯为起始原料,通过缩合、还原、哌啶氮保护、手性色谱分离得化合物13,后与芳香醛5缩合得到化合物14,化合物14再经叠氮化、环化反应、酰胺化反应、脱保护和成盐反应得到尼拉帕尼甲磺酸盐。与路线二相比,改进后工艺主要有4点不同:1)采用便宜的1-溴代-4-硝基苯替代1-碘代-4-硝基苯;2)化合物20在分离时采用手性色谱分离,收率从酒石酸盐方法拆分的25%提高到46%;3)采用碳酸氢铵进行酰胺化反应,替代氨气后更环保;4)酰胺化反应后加入硅胶处理提高了产品品质,收率从前期的37%提高至52%。路线三降低了生产成本,适合公斤级放大生产。
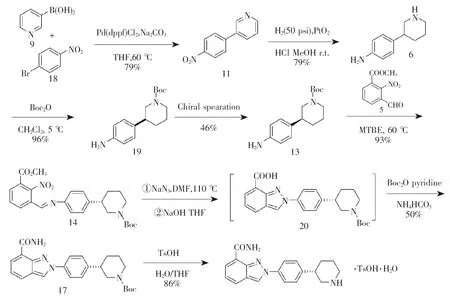
图4 尼拉帕尼合成路线三
(未完待续)

