去甲去氢斑蝥素酰亚胺缩茴香醛的荧光性质
汤 富,曾 造,王继杉,顾 熙,谢 美,吴 雷
(1.贵州工程应用技术学院化学工程学院,贵州 毕节 551700;2.贵州省应用化学特色重点实验室,贵州 毕节 551700)
斑蝥素是昆虫纲类动物大斑蝥中提取的有效成分,可作为传统中医药学中治疗疾病的一种药物分子[1]。研究表明[2],斑蝥素对肿瘤细胞的蛋白质合成有一定的抑制作用,具有较高药用价值,但斑蝥素毒副作用较大,合成工艺复杂,因此在临床应用方面受限。去甲去氢斑蝥素是天然抗肿瘤药物斑蝥素的去甲基去氢类似物,两者抗肿瘤作用类似,毒副作用较低,能减缓斑蝥素对泌尿系统、肾脏等的刺激作用[3]。去甲斑蝥素是我国首先研发的唯一可以升高白细胞且副作用小的人工合成抗癌药物,抗肿瘤的某些机制尚未明确。茴香醛作为天然抗微生物生物剂[4]之一,具有良好的抗菌、抗真菌、抗氧化的活性[5-7]。人血清白蛋白(简称HSA)[8-11]是人体血浆中的最丰富的蛋白质,约占总量的60%,具有增加血容量、运输配体、维持血浆胶体渗透压和调节血液pH值等功效,常被选作目标蛋白,用以研究药物分子对其结构的影响。分子对接是以预测药物活性成分与蛋白质相互作用强有力的工具,在阐明药物活性成分与靶蛋白相互作用方向发挥着重要作用,主要应用在药物设计与研发领域。基于此,笔者以呋喃、马来酸酐和水合肼为原料合成了去甲斑蝥素酰亚胺茴香醛,通过荧光光谱法和计算机辅助药物设计(CADD)[12]为基础,模拟、推测去甲去氢斑蝥素缩茴香醛与HSA之间的相互作用关系。
1 实 验
1.1 试剂与仪器
顺丁烯二酸酐,AR,广州市中业化工有限公司;呋喃,AR,上海麦克林生化科技有限公司;乙醚,AR,天津市富宇精细化工有限公司;水合肼、对甲氧基苯甲醛、二甲基亚砜(DMSO),AR,国药集团试剂有限公司;人血清白蛋白(HSA),AR,上海华美生物有限公司。
F-2700 FL荧光分光光度计,日立公司;600 MHz核磁共振仪(TMS为内标),瑞士Bruker公司;冷冻药品保存柜,中科美菱;制冰机,Watoor;显微熔点仪,上海仪电物理光学仪器有限公司。
1.2 目标化合物的制备
称取1.5 g(152.9 mmol)顺丁烯二酸酐放入100 mL清洁无水三颈烧瓶中,滴加适量乙醚使其完全溶解。逐滴添加2.04 g(339.6 mmol)呋喃,搅拌30 min,加热回流24 h,趁热过滤,结晶得到2.06 g粗品去甲去氢斑蝥素(中间体Ⅰ)。通过重结晶并用无水乙醇干燥得到1.86 g白色针状物,收率73.2%。称取1.66 g(100.0 mmol)中间体Ⅰ于三颈烧瓶中,加入适量无水乙醇溶解,溶解后逐滴加入1 g(20 mmol)水合肼,加热回流20 h。趁热过滤,沉淀结晶,用无水乙醇重结晶,得到去甲去氢斑蝥素酰亚胺(中间体Ⅱ),干燥后得1.12 g,收率为62.2%。称取中间体Ⅱ 0.18 g(1.00 mmol)于三颈烧瓶中,向烧瓶中添加适量无水乙醇以溶解。加入0.27 g(2 mmol)茴香醛,加热回流5 h,用TLC跟踪反应过程。冷却结晶后过滤,用无水乙醇重结晶,干燥制得到淡黄色固体(Ⅲ),收率60.4%。m.p.145.2~146.3 ℃(文献值[13]:145.6~146.5 ℃)。合成路线如图1。

图1 去甲去氢斑蝥素酰亚胺缩茴香醛合成路线
1.3 目标化合物荧光实验
1.3.1 药品的配置
称取0.03 g(0.1 mmol)去甲去氢斑蝥素酰亚胺缩茴香醛于烧杯中,使其完全溶解。完全溶解后,转移至250 mL容量瓶中,定容,配制成1×10-4mol/L溶液,保存在4 ℃冷冻药品保存柜中备用。称取0.33 g HSA于烧杯内,溶解,转移至250 mL容量瓶中,定容,配制成2×10-5mol/L的HSA溶液备用。Tris-HCl 缓冲溶液(pH=7.4,含0.10 mol/L的NaCl)。所用试剂均在4 ℃下的药品保存柜中保存,备用。
1.3.2 荧光猝灭实验
取7个洁净的10 mL容量瓶,分别取Tris-HCl 缓冲溶液和HSA溶液各1 mL于容量瓶内,并分别移取0、1、2、3、4、5、6 mL,1×10-4mol/L的去甲去氢斑蝥素酰亚胺缩茴香醛,用去离子水定容。按以上方法步骤继续配置2组,将3组溶液分别置于温度为293、303、313 K的恒温水浴锅中恒温40 min左右。将处理好的溶液倒入比色皿中,分别测量不同温度下目标产物的荧光性质(设定激发波长和发射波长分别为286、340 nm),由低到高的浓度依次进行测量。
1.4 分子模拟对接
1.4.1 配体预处理
通过Chemdraw和GaussView分别构建出所需的小分子,即合成出的目标产物分子。
在GaussView软件中画出3D视图后,用Gaussian对小分子结构优化和相关计算,AutoDockTool分子对接软件将小分子加全氢、设置为配体(自动分布电荷)、检测扭转键、选择扭转键等操作,完成配体预处理。
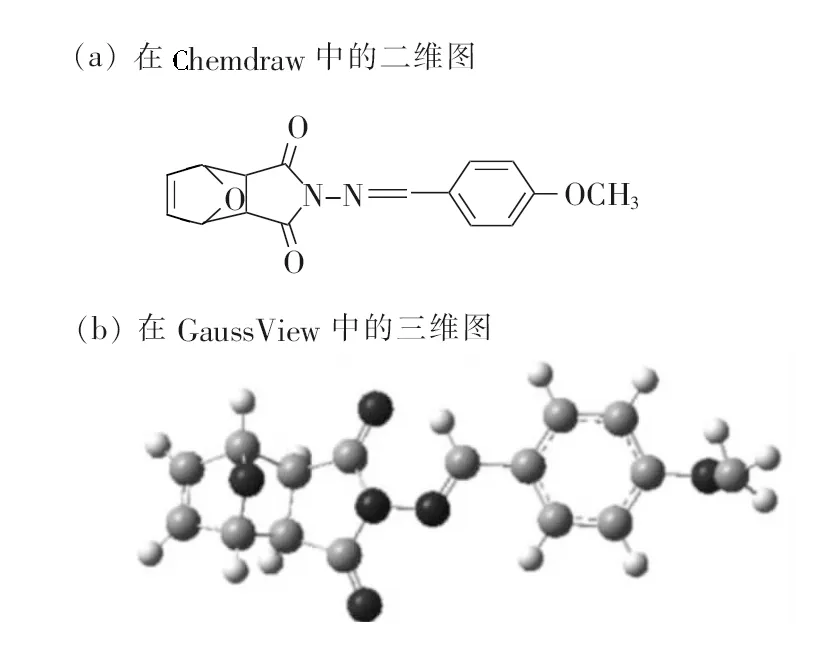
图2 目标分子的结构

图3 目标分子在AutoDockTool中经处理后检测到的可扭转键(加粗部分)
1.4.2 受体预处理
从蛋白质数据库(PDB)中下载人血清白蛋白(HSA)后,用pymol去掉HSA中的水分子、非蛋白质小分子,及HSA的一半。打开AutoDockTool分子对接软件对HSA加氢、添加蛋白质类型、计算G电荷,完成受体预处理(图4)。
图4 HSA处理前后对比
1.4.3 配体-受体对接
将上述已经处理好的配体、受体进行配体-受体对接。受体和配体间总的对接能量[14]如下:
E总=E1+E2+E3+E4+E5
式中:E1为范德华力,E2为氢键相互作用力,E3为静电相互作用,E4为配体分子内部能量,同样包含前3项的内容。E总越低则表示对接结果越稳定。对接方法如下。
1)导入配体、格点对接BOX:蛋白质名称——1AO6;XYZ维格点数目——126:98:112;格子盒子空间大小——0.714;格点盒子中心——27.326:-14.976:23.101。
2)设置对接参数及运算方法,运行Autodock4命令,待运行完可查看结果。
2 结果与讨论
2.1 荧光猝灭光谱
HAS的天然荧光性受结构上能发射荧光的氨基酸残基基团(Trp、Tyr、Phe基团)的影响,其内源荧光基团[15]为色氨酸(Trp)和酪氨酸(Tyr),HSA的天然荧光主要来自于色氨酸残基(Trp基团)的贡献(激发波长295 nm)。图5是298 K下不同浓度的目标产物与一定浓度的HSA相互作用荧光猝灭光谱。在286 nm的激发光下,最大荧光发射峰出现在350 nm附近。从图6可以看出,随目标产物的浓度逐步增加,HSA的最大荧光强度有规律地降低,发射峰位置基本没有变化,表明目标产物对HSA的Trp基团有猝灭作用。

图5 产物对HSA荧光猝灭光谱
2.2 荧光猝灭机理和常数
根据药物分子与蛋白质相互作用时,外界环境引起生色基团激发态能级发生改变,即引起内源荧光强度(Trp基团最强,Tyr基团次之,Phe基团最弱)降低不同。HSA的荧光猝灭大致可分为静态猝灭和动态猝灭。对于静态猝灭,基态配合物稳定性减小,猝灭常数随之减小,动态猝灭则相反。药物分子对HSA的猝灭过程规律通常遵循Stern-Volmer方程[15]:
F0/F=Kqτ0[Q]+1=Ksv+1
(1)
式中:F0、F分别为HSA溶液加入药物前后的荧光强度,Kq为双分子的猝灭数率常数,Ksv是荧光的猝灭常数,[Q]为猝灭剂Q 的浓度,τ0是不存在猝灭剂时的荧光分子平均寿命,约为1×10-8s。以F0/F对[Q]作目标产物与HSA的Stern-Volmer荧光猝灭曲线(图6)。图中直线方程的斜率为猝灭常数,293、303 K和310 K下Ksv分别为5.489×104、4.736×104L/mol和4.149×104L/mol。猝灭常数随温度的逐步升高而降低,由此可推测该过程为静态猝灭。

图6 目标产物与HSA的Stern-Volmer荧光猝灭曲线
2.3 结合常数和结合位点
目标产物对HSA的作用主要表现为静态猝灭作用,由静态猝灭公式(2)可计算结合常数KA和结合位点n。
lg[(F0-F)/F]=lgKA+nlg[Q]
(2)
分别以lg[Q]、lg[(F0-F)/F]的值为横、纵坐标作图,可得结合常数为直线截距,结合位点数为斜率,结果如图7和表1所示。

图7 同温度下产物对HSA的Lineweaver-Burk曲线

表1 产物与HSA的结合常数和结合位点数
2.4 相互作用力类型
药物小分子与蛋白质通常相互作用形成复合物。相互作用力的类型主要有氢键力、疏水力、静电力和范德华力。由热力学方程式(3)~(5)可计算出两者相结合的作用力类型。
ΔG=-RTlnKA
(3)
ln(KA2/KA1)=[(1/T1-1/T2)ΔH]/R
(4)
ΔG=ΔH-TΔS
(5)
式中:ΔG反应的吉布斯自由能;R为摩尔气体常数(8.314 J/(mol·K)。联立(3)~(5)可得ΔH=72.039 kJ/mol;ΔS=331.88 J/(mol·K);ΔG=-25.2 kJ/mol(293 K),-25.99 kJ/mol(303 K),-26.93 kJ/mol(313 K)。
依据Ross理论可得目标产物与HSA相互作用的热力学参数ΔH>0,ΔS>0主要表现为疏水作用力,ΔH>0表明反应为吸热反应,同时本反应为自发反应(ΔG<0)。
2.5 分子模拟对接结果进行初步分析
对接结果进行初步分析:通过文本可知,由遗传算法(寻找最优算法)计算出最佳打分构象,去甲去氢斑蝥素酰亚胺缩茴香醛与HSA结合对接50次,得到的构象进行一个聚类与能量分析。在大多数晶体原配体重对接的情况下,最佳结合聚类便是最佳聚类,在第33次尝试对接时结合能量最低,可以认为在第33次对接最优为,氢键对接结合能为-26.69 kJ/mol。
由图8可知,去甲去氢斑蝥素酰亚胺缩茴香醛与人血清白蛋白(HSA)周围6×1010m范围内相互作用氨基酸残基分别为:HIS-146;SER-193;ASN-429;LYS-432。

图8 分子对接结果通过PYMOL展示
2.6 分子模拟对接结果
去甲去氢斑蝥素酰亚胺缩茴香醛与人血清白蛋白(HSA)在对接位点最优处形成2个氢键,分别为1AO6:B:SER193:OG;1AO6:B:LYS432:HZ3;通过设置对接参数及运算方法,运行Autodock4命令,得到结果在第33次尝试对接时结合能量最低,这两个氢键的最低共同结合能为-26.93 kJ/mol(图9)。

图9 分子对接模拟结果
3 结 论
a.去甲去氢斑蝥素酰亚胺缩茴香醛与HSA相互作用猝灭过程为静态猝灭;去甲去氢斑蝥素酰亚胺缩茴香醛与HSA之间的作用力主要为疏水作用力,作用过程自发放热;且由Stern-Volmer方程可知两者相结合的位点有一个。
b.分子对接模拟得到去甲去氢斑蝥素酰亚胺缩茴香醛与HSA周围6×1010m范围内相互作用的疏水性氨基酸残基:HIS-146和ASN-429的存在说明两者相互作用力类型为疏水作用,另外分子中部分基团与SER193、LYS432等氨基酸残基之间还存在氢键的作用。氢键使得亲水性减小,疏水性增大,相互作用更加稳定。分子对接模拟还得到两者相互作用的最小结合能约为-26.69 kJ/mol,与实验结果(-26.93 kJ/mol,313 K)大致相同。
c.去甲去氢斑蝥素酰亚胺缩茴香醛与HSA相互作用机制为药物在机体内的运输分布、作用机理、药物活性等进一步研究提供理论参考价值。

