一种芳基含氮杂环硼酸酯的制备
李林璐,刘鹏举,郭利兵
(河南省科学院化学研究所,河南 郑州 450002)
芳基含氮硼酸酯是硼酸中氢被芳基含氮官能团取代后的衍生产物,具有高稳定性、低污染、良好摩擦学性能等优点[1-4],被广泛应用于有机合成中间体、光电材料、医药、农药等领域[5-8]。另外,芳基含氮硼酸酯也是Suzuki交叉偶联反应的重要原料,可以形成C—O键、C—N键、C—S键,也因其高反应活性、低毒性及最终降解为环境友好硼酸酯的优势被认为是一类理想反应底物[9-10]。因此,开发高效、温和的芳基含氮硼酸酯合成方法一直都是人们关注的重点[11]。
芳香硼酸酯的经典合成是在格氏试剂或锂试剂作用下完成的,但若卤代芳基分子中带有酯基、氰基等官能团则无法通过有机金属试剂直接制备[7-12]。1995 年,Miyaura等[9-14]率先以卤代芳烃及联硼酸频哪酯为原料在钯催化下获得芳基硼酸酯,随后发现除卤代芳烃外,芳基三氟甲磺酸酯、芳基重氮盐等底物均可通过过渡金属催化的硼基化反应制得芳基硼酸酯。后又发展了锌、镍、铜、铁等过渡金属催化芳基硼基化反应,但由于合成条件苛刻、收率低等问题没有较好解决,材料应用仍受到限制[15-17]。
本文提供了一种新型芳基含氮杂环硼酸酯及其制备方法。以卤代芳基乙酸为原料,氯化亚砜为试剂完成与苯的复合反应,后用二甲基亚砜(MDSO)在酸性条件下氧化C—H键(图1)获得高活性的双羰基芳基中间体,进而与氨基环合构筑C—N键,最后硼酸取代,制备目标产物芳基含氮杂环硼酸酯,并由液相色谱及核磁氢谱确证产物结构及纯度。合成路线见图式2(其中反应物1、2、3、4中R=Br,H;产物4中R=Br)。

图1 DMSO氧化醛基反应机理
1 实 验
1.1 主要试剂和仪器
间溴苯乙酸(纯度98%)、氯化亚砜(纯度99.7%)、异丙醇频哪醇硼酸酯(纯度98%),麦克林生化科技有限公司;DMSO(纯度99%),上海阿拉丁生化科技股份有限公司;(1R,2R)-1,2-二苯基乙二胺(纯度98%),TCL公司;正丁基锂(2.5 mol/L己烷溶液),北京迈瑞达有机科技有限公司。其他均为市售分析纯。
Agilent 1260 高效液相色谱仪(C18色谱柱,250 mm×4.6 mm×5 μm。分析条件:A相为φ= 0.1%三氟乙酸的甲醇溶液;C相为φ=0.1%三氟乙酸的水溶液;检测波长254 nm;流速1.0 mL/min);DPX-400型超导核磁共振仪。

图2 目标化合物的合成路线
1.2 新型芳香基含氮杂环硼酸酯合成
1.2.1 中间产物3的合成
溴甲烷基1,2-二苯基乙烷-1-酮(R=Br)。将50 g溴苯乙酸,55.3 g氯化亚砜加入1 000 mL三口瓶中。室温搅拌1 h至完全溶解,后油浴85 ℃回流过夜。次日减压蒸馏除去过量氯化亚砜,后降低装置温度至30 ℃以下,加入500 mL二氯甲烷,23.6 g苯,及40.3 g无水三氯化铝,室温搅拌2 h反应终止。混合物水洗,干燥,加入甲醇分散过滤,完毕得产物溴甲烷基1,2-二苯基乙烷-1-酮。对溴甲烷基1,2-二苯基乙烷-1-酮:黄色粉末59.56 g,产率91.4%,纯度98%;1H NMR(DMSO-d6,400 MHz),δ: 8.00~7.33(m,9H,—Ar—H),4.14(d, 2H,—CH2—)。间溴甲烷基1,2-二苯基乙烷-1-酮:黄色粉末59.22 g,产率90.9%,纯度98%;1H NMR(DMSO-d6,400 MHz),δ: 8.00~7.18(m,9H,—Ar—H),4.14(d, 2H,—CH2—)。
烷基1,2-二苯基乙烷-1-酮(R=H)。将45 g苯乙酸,60 g氯化亚砜加入1 000 mL三口瓶中。室温搅拌1 h至完全溶解,后油浴85 ℃回流过夜。次日减压蒸馏除去过量氯化亚砜,后降低装置温度至30 ℃以下,加入500 mL二氯甲烷,26 g苯,及45 g无水三氯化铝,室温搅拌2 h反应终止。混合物水洗,干燥,加入甲醇分散过滤,得到产物。浅黄色粉末61.5 g,产率93%,纯度98%;1H NMR(DMSO-d6,400 MHz),δ: 8.00~7.22(m,10H,—Ar—H),4.14(d, 2H,—CH2—)。
1.2.2 中间产物4的合成
溴甲烷基苯甲酰(R=Br)。称取50 g 3a(3b),30 g DMSO,153 g 48%氢溴酸于500 mL烧瓶中,100 ℃下加热回流5 h,冷却至室温,终止反应。反应物水洗3次,过滤干燥,重结晶得产物溴甲烷基苯甲酰。对溴甲烷基苯甲酰:黄色粉末50.1 g,产率94.3%,纯度97%。1H NMR(DMSO-d6, 400 MHz),δ: 8.01~7.49(m, 9H,—Ar—H)。间溴甲烷基苯甲酰:黄色粉末49.9 g,产率94%,纯度97%。1H NMR(DMSO-d6, 400 MHz),δ: 8.03~7.49(m, 9H,—Ar—H)。
烷基苯甲酰(R=H)。称取50 g 3c,40 g DMSO,211 g 48%氢溴酸于500 mL烧瓶中,100 ℃下加热回流5 h,冷却至室温,终止反应。反应物水洗3次,过滤干燥,重结晶得产物。黄色粉末51.36 g,产率95%,纯度97%;1H NMR(DMSO-d6, 400 MHz),δ: 7.81~7.49(m, 10H,—Ar—H)。
1.2.3 中间产物5的合成
溴甲烷基2,3,5,6-四苯基吡嗪(R=Br)。称取48 g 4a(4b),42.3 g(1R,2R)-1,2-二苯基乙二胺,200 g醋酸加于500 mL烧瓶中,30 ℃下回流24 h,反应完毕。生成物冷却过滤,甲醇洗涤得产物5a(5b)。对溴甲烷基2,3,5,6-四苯基吡嗪:黄色粉末70.8 g,产率92%,纯度97%。1H NMR(DMSO-d6, 400 MHz),δ: 8.34~7.32(m,19H,—Ar—H)。间溴甲烷基2,3,5,6-四苯基吡嗪:黄色粉末70.3 g,产率91.3%,纯度97%。1H NMR(DMSO-d6, 400 MHz),δ: 8.28~7.32(m,19H,—Ar—H)。
1.2.4 终产物芳基含氮杂环硼酸酯的合成
氩气氛围中,液氮使装置降温至-78 ℃以下,以200 mL四氢呋喃为溶剂加入45 g 5a(5b)、52 mL正丁基锂己烷溶液、40 g异丙醇频哪醇硼酸酯,装置自然升至室温,反应8 h。混合物加入等体积氯化铵水溶液,后用乙酸乙酯萃取,水洗,干燥,减压浓缩,重结晶得终产物。芳基含氮杂环对位硼酸酯:白色粉末42.89 g,产率90.6%,纯度97%;1H NMR(DMSO-d6, 400 MHz),δ: 8.229~7.216(m, 19H,—Ar—H), 1.327(m, 12H,—CH3)。芳基含氮杂环间位硼酸酯:白色粉末42.61g,产率90%,纯度97%;1H NMR(DMSO-d6, 400 MHz),δ: 8.23~7.32(m, 19H,—Ar—H), 1.2(m, 12H,—CH3)。
2 结果与讨论
2.1 原料配比对收率的影响
在DMSO对中间产物3的氧化反应中,足量的氢溴酸可保证烷基被取代完全,但过量易造成苯环多位不确定性取代,严重影响氧化效率及产物纯度。据理论分析,DMSO与中间产物3的反应摩尔比大于2∶1即可,故保证其他实验条件相同情况下,考察原料配比对产物4收率的影响,结果见图3。
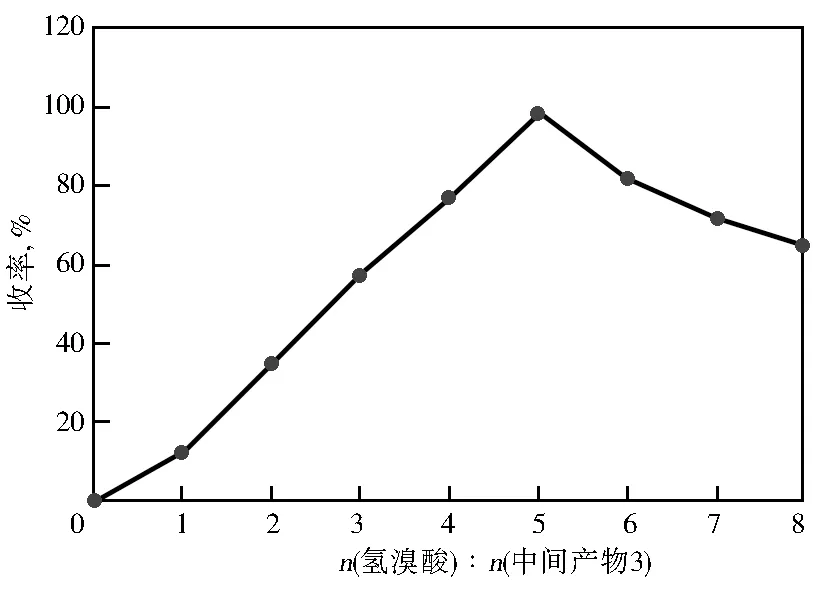
图3 原料配比对产物4收率的影响
从图3可见,当氢溴酸与中间产物3的摩尔比为5∶1时,中间产物的收率已大于94%,总收率在70%以上,继续增加氢溴酸配比时,收率逐渐降低。故反应过程中选用氢溴酸、DMSO与中间产物3的最佳摩尔比应为5∶2∶1。
2.2 反应温度对反应过程的影响
DMSO在氢溴酸环境下对中间产物3的氧化反应在低温时不易发生或进程缓慢,温度过高又会产生副反应,影响收率。因此,必须控制温度,保证反应效率及产物收率。操作如下:将反应物置入油浴反应器中,选择温度随时间匀速增加,每隔10 min监测产物收率情况,结果见图4。
由图4可知:当温度大于50 ℃时,开始有产物检测到;随着温度不断升高,产物单位时间产出量不断增加;当温度达到100 ℃时,产物产出率最大,继续升温,产物产出率明显降低。因此,反应适宜温度为100~105 ℃。

图4 温度对反应过程的影响
2.3 热稳定性
采用Mettler-Toledo的TGA/DSC同步热分析仪对目标产物含氮杂环硼酸酯在氮气气氛(流速为20 cm3/min,升温速率10 ℃/min)中的热分解状况进行考察,评价其热稳定性。
图5为芳香基含氮杂环硼酸酯的热稳定性分析结果。从图5可以看出,芳香基含氮杂环硼酸酯的分解温度范围是257.28~396.83 ℃。

图5 芳香基含氮杂环硼酸酯的TG谱
3 结 论
a.以卤代芳基乙酸为原料,利用DMSO反应系统特点,结合其他有机基元反应完成设计。其关键步骤为借助H+/DMSO强氧化性为基础,定向进行C—H官能团化来构建多羰基化合结构体进而完成含氮官能团环化,实现多个目标产物的准确制备。
b.适宜工艺条件为:n(氢溴酸)∶n(DMSO)∶n(中间产物3)=5∶2∶1,反应温度100~105 ℃,中间产物收率可达95%以上,总收率在70%以上。芳香基含氮杂环硼酸酯的分解温度范围为257.28~396.83 ℃,具有良好的高温稳定性。该结果为进一步解决C—H键氧化的问题,H+/DMSO系统反应深入探究及新型含氮杂环硼酸酯的开发、利用提供依据。

