基于甘油稳定碳同位素的葡萄酒掺糖鉴别研究
◎ 李信萍,张 昂,马紫朝,杨彦宝
(1.宁夏大学 食品与葡萄酒学院,宁夏 银川 750021;2.秦皇岛海关技术中心,河北 秦皇岛 066000;3.甘肃民族师范学院,甘肃 甘南 747000;4.宁夏大学 农学院,宁夏 银川 750021)
随着我国葡萄酒市场日渐繁荣,2021年,我国葡萄园面积已达78.3万hm2,葡萄酒消费量约在10.5亿L, 呈快速增长趋势[1-2]。在经济利益驱动下,不法生产商在葡萄酒酿造过程中,通过掺廉价糖、掺外源乙醇、掺水等方式欺骗消费者[3]。这些行为侵犯了消费者的权益,同时损害了葡萄酒行业的形象[4]。目前国内外鉴别葡萄酒掺假的方法较多,其中行之有效的当属利用各种稳定同位素建立的鉴别方法。例如,王广浩[5]利用EIM-IRMS和SNIF-NMR测定葡萄酒样品中δ2H值来鉴别葡萄酒中外源糖的添加,发现葡萄酒样品中乙醇不可交换位点δ2H值可以被用来鉴别掺糖葡萄酒。谭梦茹等[6]采用EA-IRMS对不同种类纯正葡萄汁中的糖、有机酸δ13C值进行测定,初步建立了纯正葡萄汁中δ13C值的数据库,根据糖和有机酸δ13C值间的差异鉴别葡萄汁中C4植物糖的掺假。基于此,本文通过制备不同δ13C值分布的外源糖,并将其添加到纯正葡萄汁中进行发酵,测定发酵后葡萄酒样品中甘油δ13C值,建立葡萄酒掺糖鉴别模型,旨在为我国葡萄酒掺糖鉴别的深入研究提供思路,以期促进葡萄酒产业的健康发展。
1 材料与方法
1.1 材料与试剂
蔗糖,选取来自黑龙江、吉林、内蒙古等主要产区的甜菜糖和广西、福建、广东等主要产区的蔗糖作为试样,信息如表1所示;葡萄汁,实验室现榨葡萄汁;水,实验室纯净水。
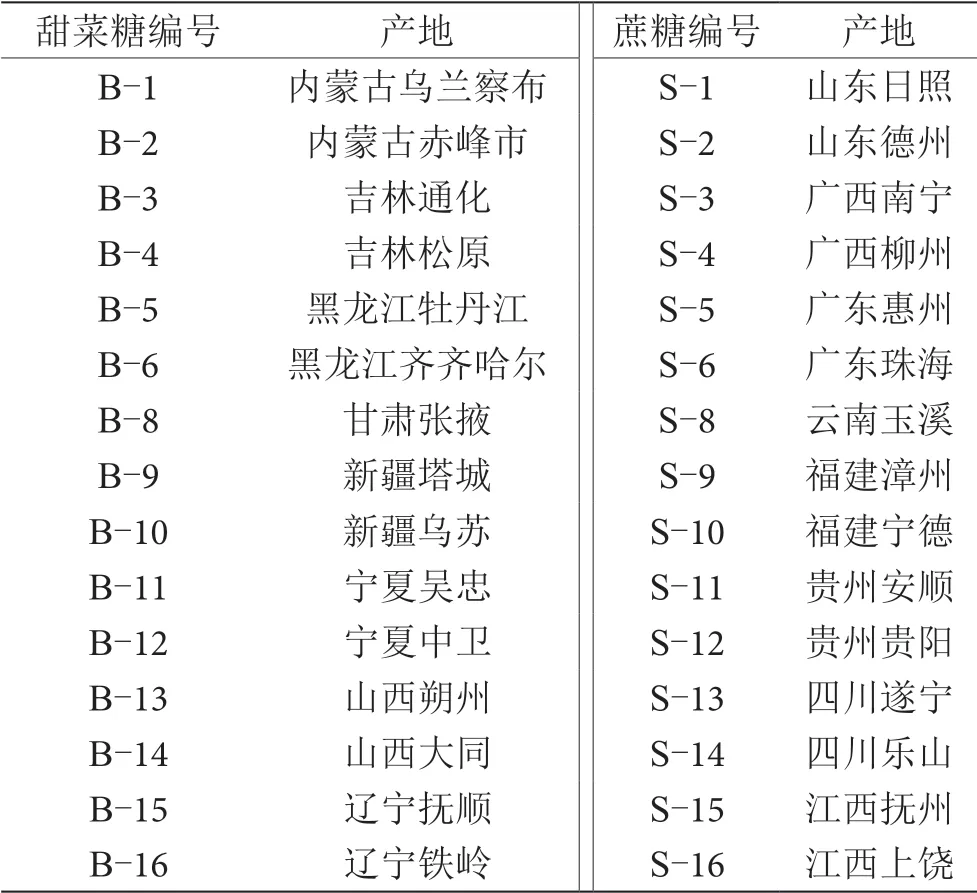
表1 不同稳定碳同位素比值分布的外源糖样品信息表
甲醇(色谱纯),天津永晟精细化工有限公司;4-甲级-2-戊醇(99%),北京百灵威科技有限公司;超纯水,Millipore公司的Milli-Q系统制备;淀粉标准物质(δ13C值:-24.55‰),奥地利维也纳国际原子能机构,作为碳稳定同位素参照标准;Chromosorb W 吸附剂,Sercon公司。
1.2 仪器与设备
元素分析仪(EA GSL),英国Sercon公司;超纯水制备仪(Milli-QG),美国Millipore公司;气相色谱仪(GC 2023),日本岛津公司;恒温恒湿培养箱(HPP260),德国Memmert公司。
1.3 实验方法
1.3.1 采用EA-IRMS测定不同δ13C值分布的外源糖
制备外源糖样品:分别称取每个编号的蔗糖和甜菜糖样品10 g置于烧杯中,加入20 mL纯净水,低温加热溶解,摇匀后移入容量瓶中对应编号备用。
采用移液器移取制备好的样品1~3 μL。称样时,选用规格为5 mm×8 mm的锡杯,先在锡杯中加少量吸附剂,然后用柱塞式移液器吸取制好的液体样品2 μL注入锡杯中,用弯曲的镊子将锡囊置于洁净平磁板上,并用镊子轻轻镊紧锡杯侧壁使之闭合;以侧面平置锡杯,用一只镊子压住其底部,以另一只镊子的扁平面适当用力刮压锡杯使之侧壁完全闭合成扁平状;然后将其叠成小圆球状,并将其压紧[7]。设定标准物质名称,输入标准物质参数,按照已设定检验顺序,在自动进样器上摆放好待测外源糖样品,在计算机软件控制下,运行检测批进行测定。测定完毕后,试样的δ13C值由计算机自动计算给出。δ13C值按公式(1)计算。

式中:X为13C/12C;R样品和R标准分别为样品和标准物中的重轻同位素的丰度比。
1.3.2 模拟掺糖葡萄酒样品发酵
发酵预实验:在250 mL三角瓶中量取200 mL纯正葡萄汁、掺水葡萄汁、掺糖葡萄汁。发酵7.0%(v/v, 下同)、13.0%葡萄酒(接入酵母0.06 g/200 mL),发酵16.0%葡萄酒(另加酵母多糖0.08 g/200 mL),纱布封口,置于恒温恒湿培养箱发酵。设定发酵条件为温度28 ℃;湿度60%RH,发酵时间根据发酵酒精度数设定,发酵期间多次对酒样摇匀并观察气泡变化,待气泡完全消失用滴定法测得葡萄酒样品中残糖量小于4 g·L-1时,发酵完全,采用滴定法测得葡萄酒中总糖含量为241.6 g·L-1,按理论上17.5 g的糖可以转化 1.0%的酒精度,纯正葡萄汁可发酵成潜在酒精度为13.8%的葡萄酒。
根据葡萄汁发酵后潜在酒精度13.8%,将纯正葡萄汁通过加水稀释使其能发酵成3.0%、3.5%、4.0%、4.5%、5.0%、6.0%、9.0%、9.5%、10.0%、10.5%、11.0%和12.0%的葡萄汁,通过加糖(与纯正葡萄汁δ13C值相同的糖)使其能发酵成12.5%、13.0%、13.5%、14.0%和15.0%的葡萄汁,再将1.3.1制备好的不同δ13C值分布的外源糖掺入以上葡萄汁中,纱布封口,置于恒温恒湿培养箱中发酵(条件同上),使其发酵成国家标准中要求的最低酒精度7.0%,生活中普遍可见的酒精度为13.0%以及普通酵母耐受的酒精度为16.0%。发酵结束后,采用气相色谱仪测定葡萄酒样酒精度(以已知葡萄酒的酒精度为基准)。
1.3.3 采用LC-IRMS测定葡萄酒中甘油δ13C值
将7%vol的葡萄酒样品用超纯水稀释50倍,13.0%、16.0%的葡萄酒样品用超纯水稀释100倍,过0.22 μm尼龙滤膜,移至样品瓶中,供LC-IRMS测定葡萄酒中乙醇和甘油的δ13C值。在测定酒样之前,先要用蔗糖IAEA-CH6(δ13C值:-10.4‰)碳稳定同位素参考标准对实验室工作标准(葡萄糖水合物:δ13C值:-26.03‰±0.2‰)进行校准测定,再使用实验室工作标准对CO2气体进行标定,每次测定样品使用CO2标准参考气体计算δ13C值。将经过前处理的葡萄酒样品上机测样,以上步骤均由仪器软件程序自动控制。
2 结果与分析
2.1 不同稳定碳同位素比值分布的蔗糖和甜菜糖
采用EA-IRMS对不同产区蔗糖和甜菜糖样品δ13C值进行测定,测定结果如表2所示。每个产区蔗糖和甜菜糖δ13C值都在C3(-34‰~-22‰)和C4(-19‰~-9‰)植物δ13C值之间。从测定结果中选取δ13C值为-12.68‰的蔗糖和-26.68‰的甜菜糖,进行任意质量配比,制备实验中所需不同δ13C值分布的外源糖。
2.2 不同δ13C值分布的外源糖测定结果表
将表2中δ13C值为-12.68‰的蔗糖和-26.68‰的甜菜糖以任意比例混合均匀,采用EA-IRMS测定δ13C值,结果如表3所示。从表3测定结果中筛选出δ13C值分别为-14.64‰、-16.63‰、-18.67‰、-20.65‰、-22.68‰和-24.64‰的外源糖,将这8种不同δ13C值分布的外源糖添加到纯正葡萄汁中进行发酵来模拟掺糖葡萄酒样品,根据表3测定的结果发现:这些不同δ13C值分布的外源糖基本处于C3(-34‰~-22‰)和C4(-19‰~-9‰)植物的δ13C值范围内。
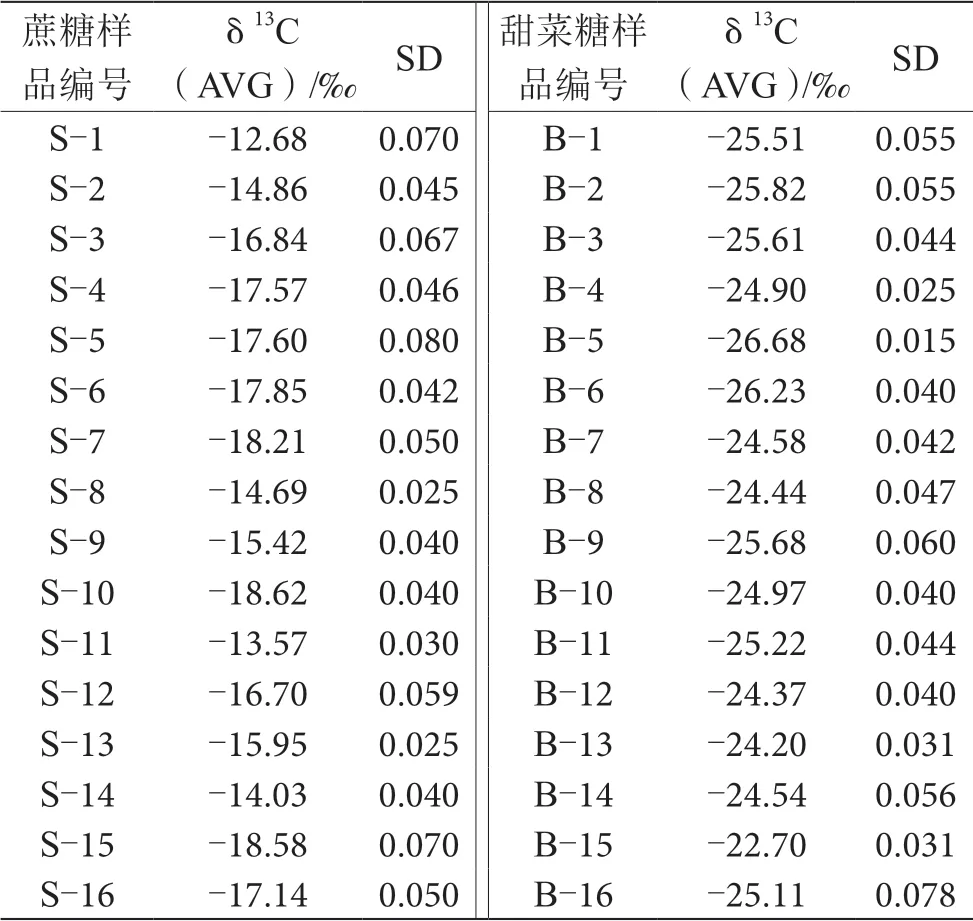
表2 不同稳定δ13C值分布的蔗糖和甜菜糖表
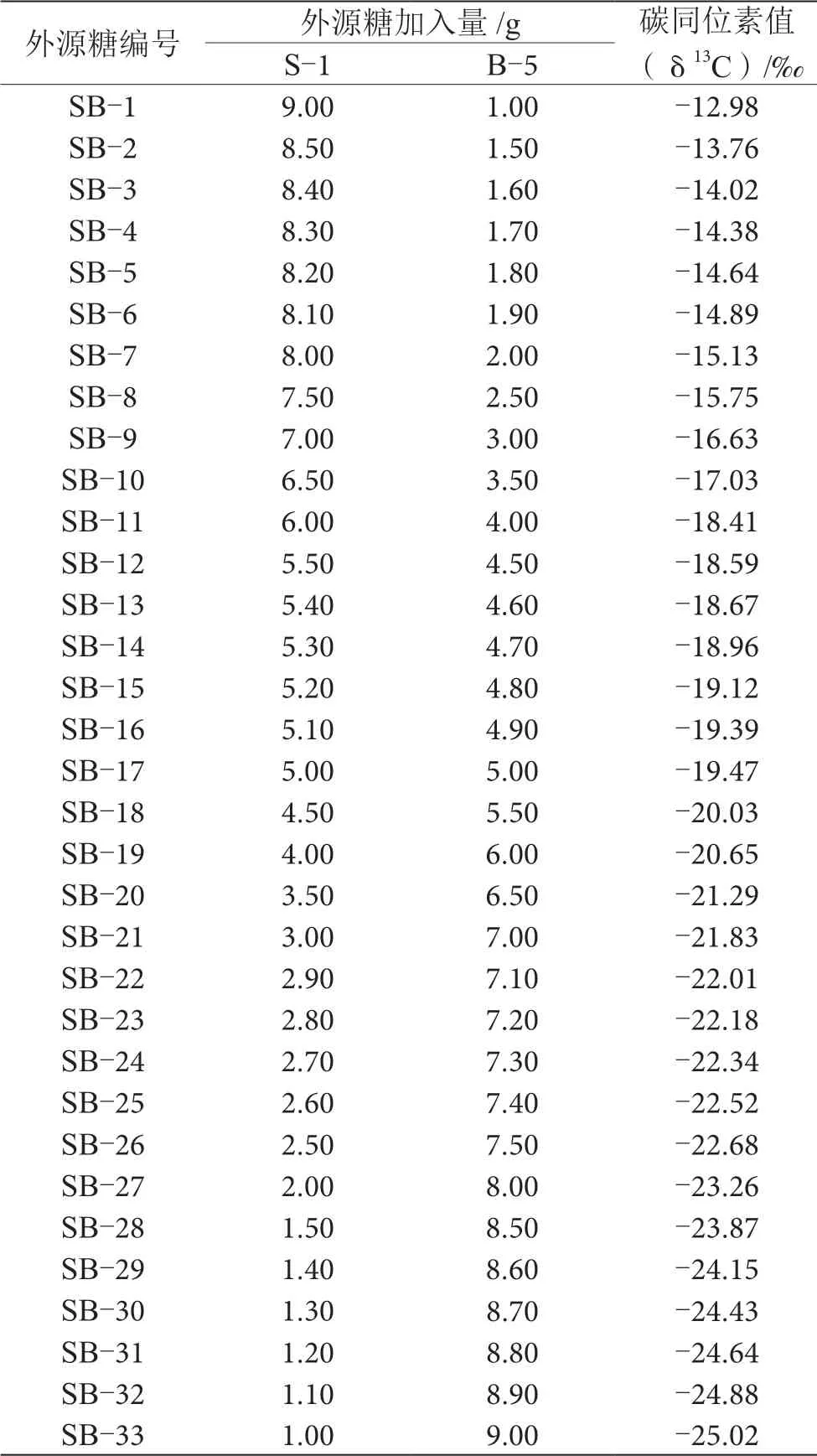
表3 不同稳定碳同位素比值分布的外源糖表(n=3)
2.3 发酵后葡萄酒中甘油δ13C值测定
采用LC-IRMS技术测定不同酒精度葡萄酒样品中甘油δ13C值,结果如表4所示。不同δ13C值分布的外源糖发酵的葡萄酒样品中甘油稳定碳同位素比值的结果为-33.27‰~-25.37‰。

表4 葡萄酒中甘油稳定碳同位素比值测定表
2.4 基于甘油稳定碳同位素的葡萄酒中外源糖鉴别技术
2.4.1 外源糖添加量与葡萄酒中甘油δ13C值的相关性分析对不同外源糖添加量的葡萄酒中甘油稳定碳同位素值测定并进行相关性分析,结果如表5、图1、图2所示。对不同稳定碳同位素比值分布的外源糖添加量与葡萄酒中甘油δ13C值数据进行线性判别分析,由图1可知,掺入与葡萄汁同位素值(δ13C值:-25.17‰) 相比,偏正的外源糖进行发酵后,葡萄酒中甘油δ13C值会明显偏正,不同外源糖添加量与葡萄酒中甘油δ13C值呈良好正相关关系,拟合方程分别为YS1=0.46X-32.31,R2=0.9 9 4;YSB5=0.4 7X-3 2.8 7,R2=0.9 9 6;YSB9=0.38X-32.87,R2=0.982;YSB13=0.31X-32.73,R2=0.9 7 0;YSB19=0.2 4X-3 2.7 8,R2=0.9 9 2;YSB26=0.15X-32.45,R2=0.989;YSB31=0.09X-32.93,R2=0.999;由图2可知,掺入与葡萄汁同位素值(δ13C值:-25.17‰)相比,偏负的外源糖进行发酵后葡萄酒中甘油δ13C值会明显偏负,不同外源糖添加量与葡萄酒中甘油δ13C值呈良好负相关关系,拟合方程为y=0.04x-32.61,R2=0.984。
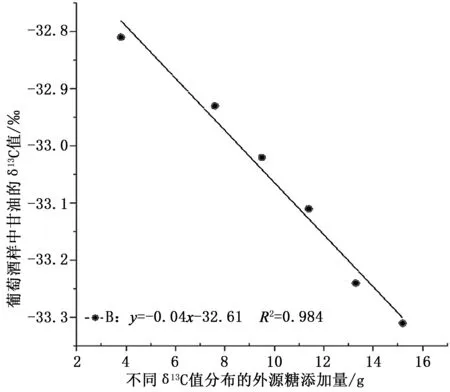
图2 偏负外源糖添加量与葡萄酒中甘油稳定碳同位素图

表5 不同外源糖添加量的葡萄酒中甘油稳定碳同位素测定结果表
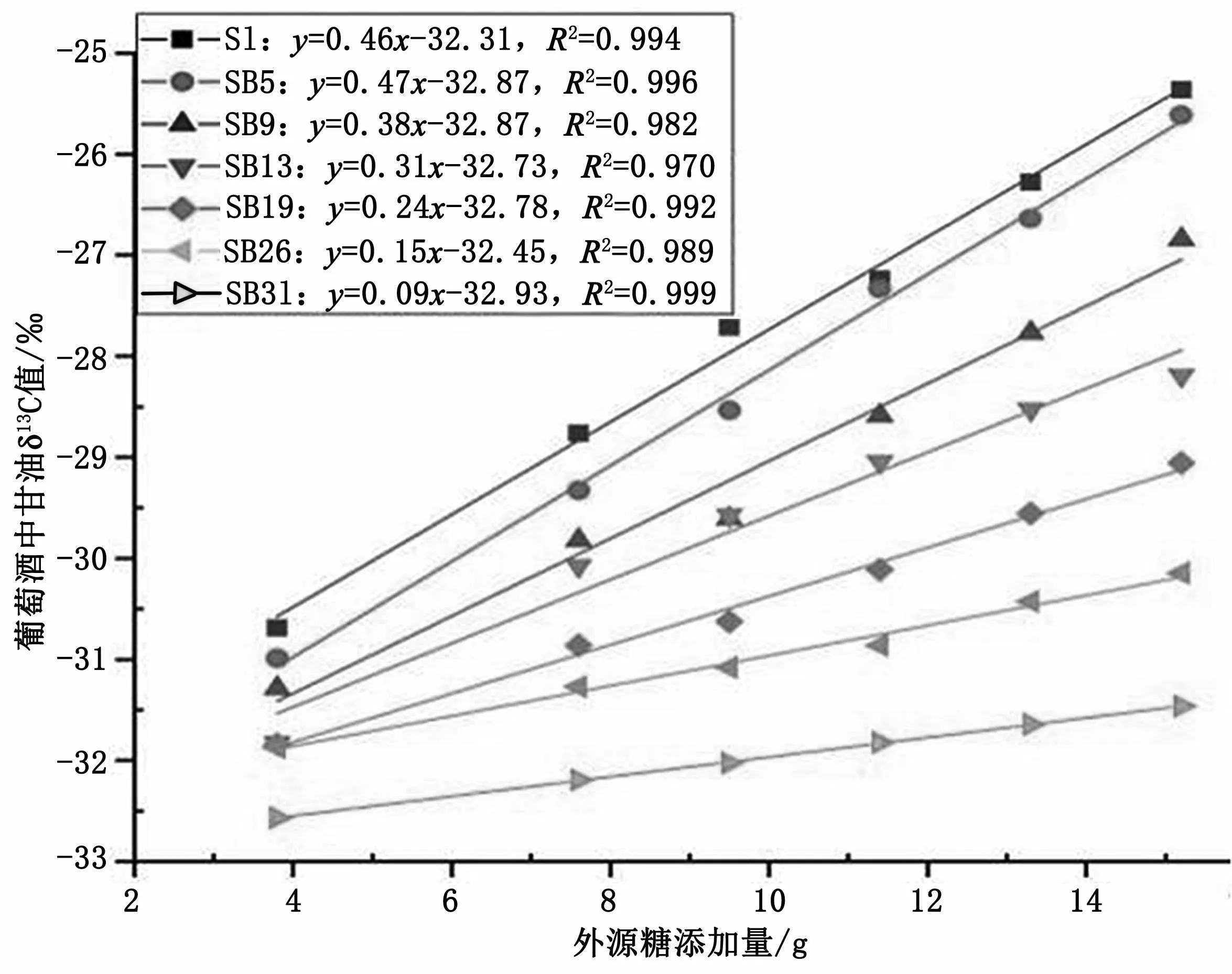
图1 外源糖添加量与葡萄酒中甘油稳定碳同位素图
2.4.2 葡萄酒中甘油δ13C值显著性差异分析
葡萄酒作为一种营养成分丰富的低酒精度饮料,在发酵过程中添加非来自葡萄的乙醇、糖、水以增加葡萄酒中乙醇含量,使其满足葡萄酒国家标准对酒精度的要求。这不仅给合法生产者带来了经济损失,同时也使消费者对食品供应链及政府监管产生不信任[8]。因此,针对葡萄酒掺假现象,建立葡萄酒真实性的鉴别方法至关重要[9]。
葡萄酒酿造过程中,约8%的糖转化为甘油,是仅次于水和乙醇的重要副产物,在酒精发酵开始时,参加3-磷酸甘油醛转化为3-磷酸甘油酸这一反应所需的辅酶Ⅰ(NAD),是通过磷酸二羧丙酮的氧化作用来提供的,甘油伴随着这一氧化作用产生[10-11]。因此,甘油δ13C值间的差异也可用于鉴别葡萄酒发酵过程中有无外源糖的添加。通过测定对照组和掺糖葡萄酒样品中甘油δ13C值来鉴别外源糖的掺入。对照组中葡萄酒中甘油δ13C值为-32.78‰,与掺糖葡萄酒样品中甘油δ13C值进行SD分析,当SD>0.100时,认为两个样品存在显著性差异,可以检出葡萄汁在发酵过程中添加了外源糖,分析结果如表6~13所示。
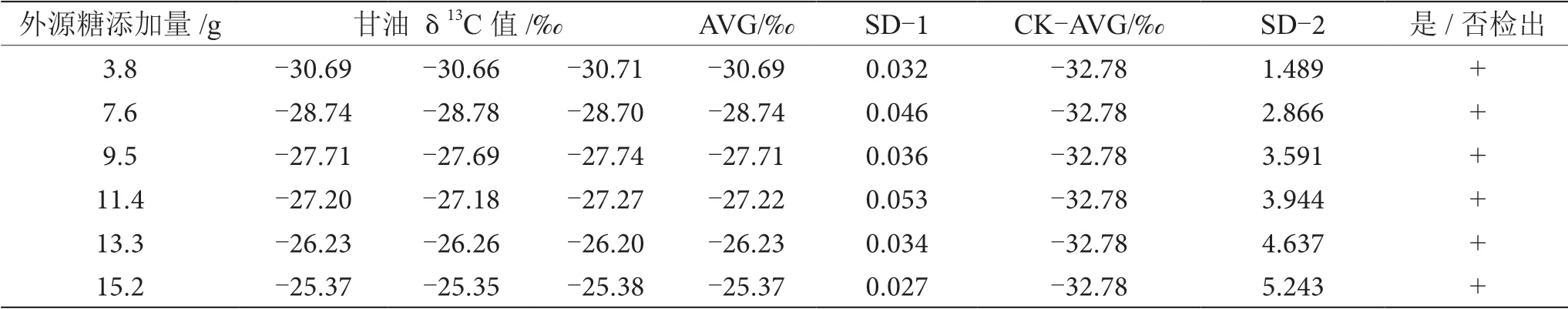
表6 掺δ13C值为-12.68‰的外源糖葡萄酒中甘油δ13C值显著性差异分析表
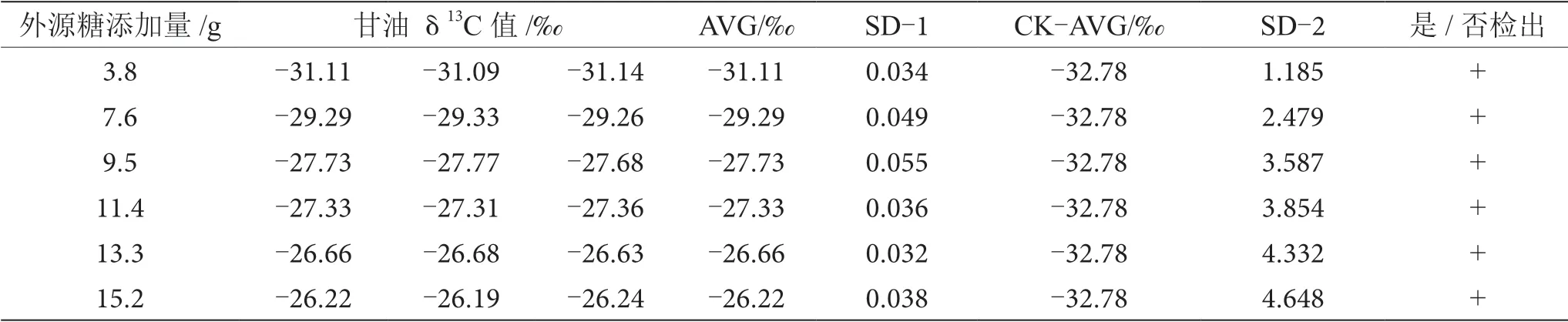
表7 掺δ13C值为-14.64‰的外源糖葡萄酒中甘油δ13C值显著性差异分析表
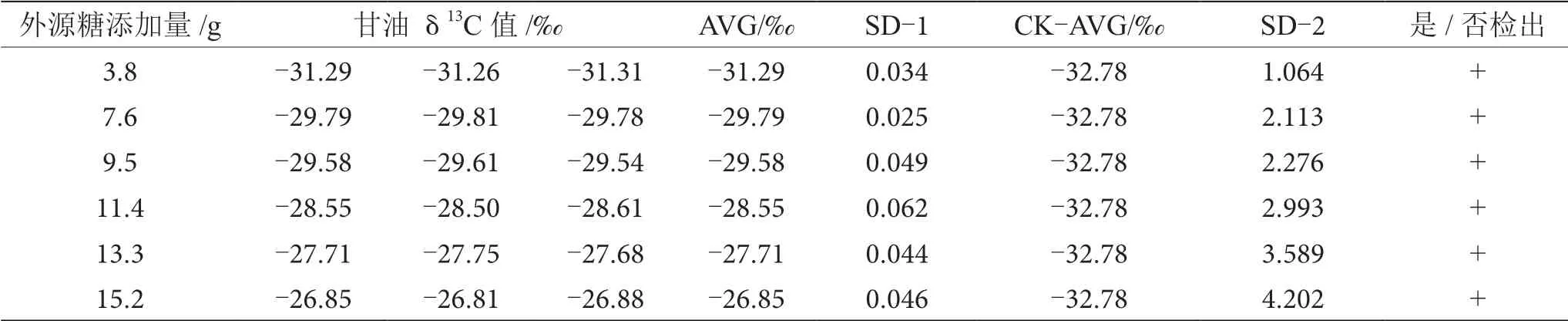
表8 掺δ13C值为-16.63‰的外源糖葡萄酒中甘油δ13C值显著性差异分析表
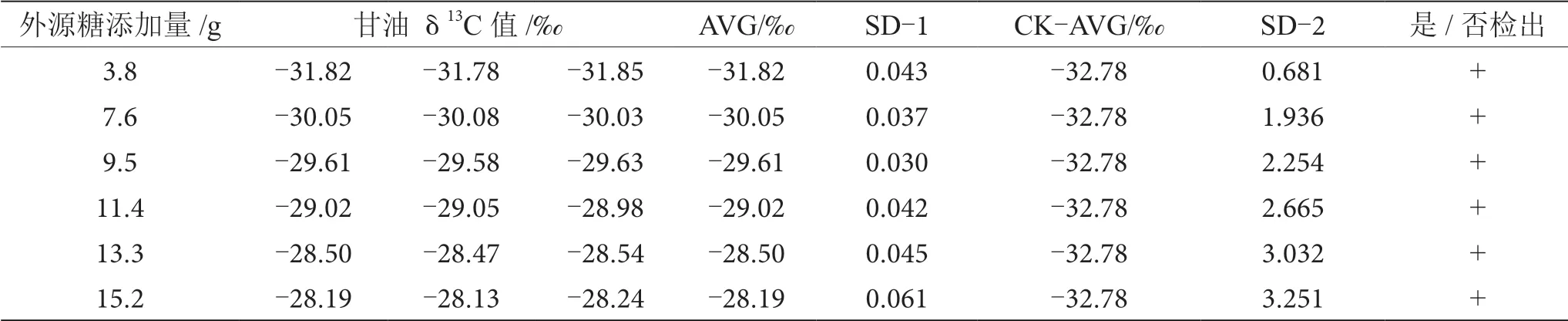
表9 掺δ13C值为-18.67‰的外源糖葡萄酒中甘油δ13C值显著性差异分析表
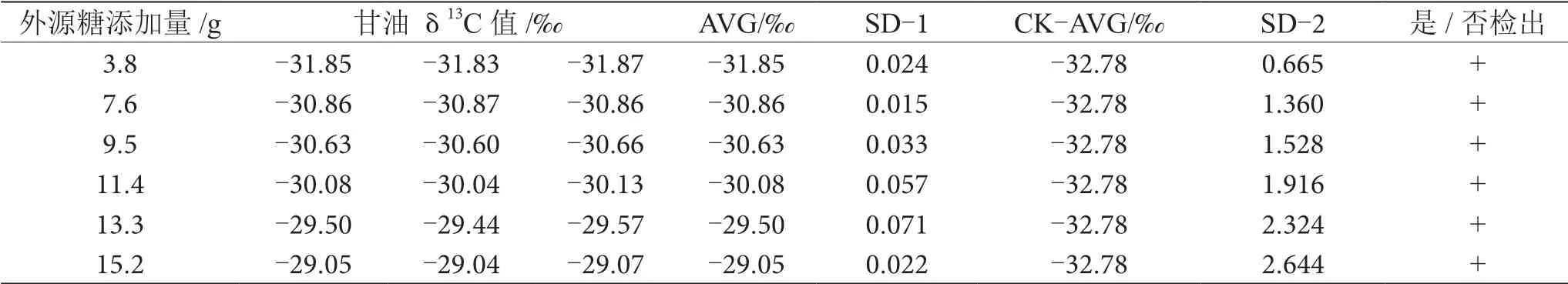
表10 掺δ13C值为-20.65‰的外源糖葡萄酒中甘油δ13C值显著性差异分析表
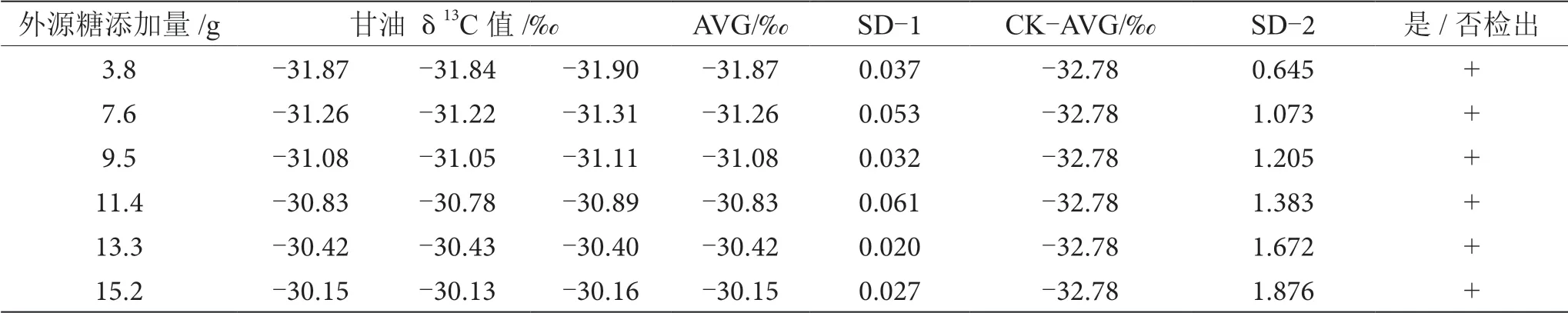
表11 掺δ13C值为-22.68‰的外源糖葡萄酒中甘油δ13C值显著性差异分析表
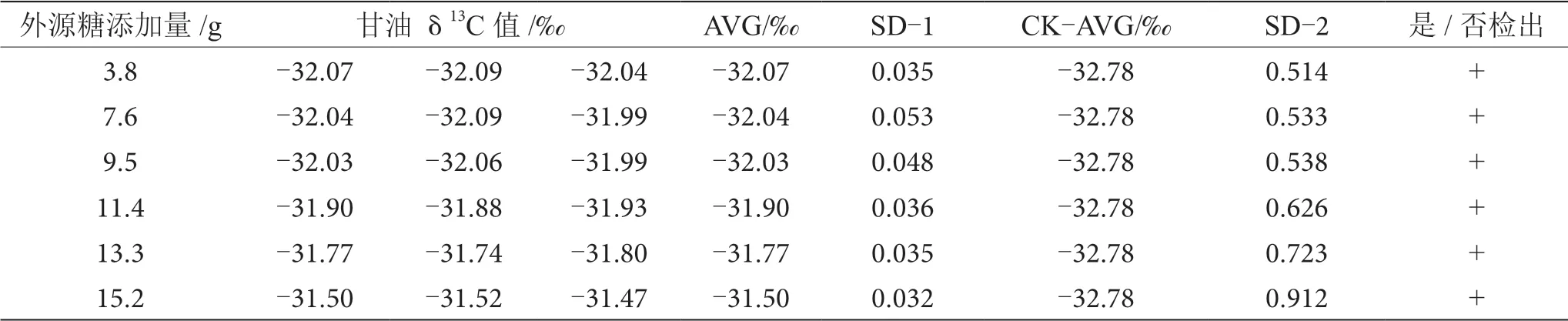
表12 掺δ13C值为-24.64‰的外源糖葡萄酒中甘油δ13C值显著性差异分析表
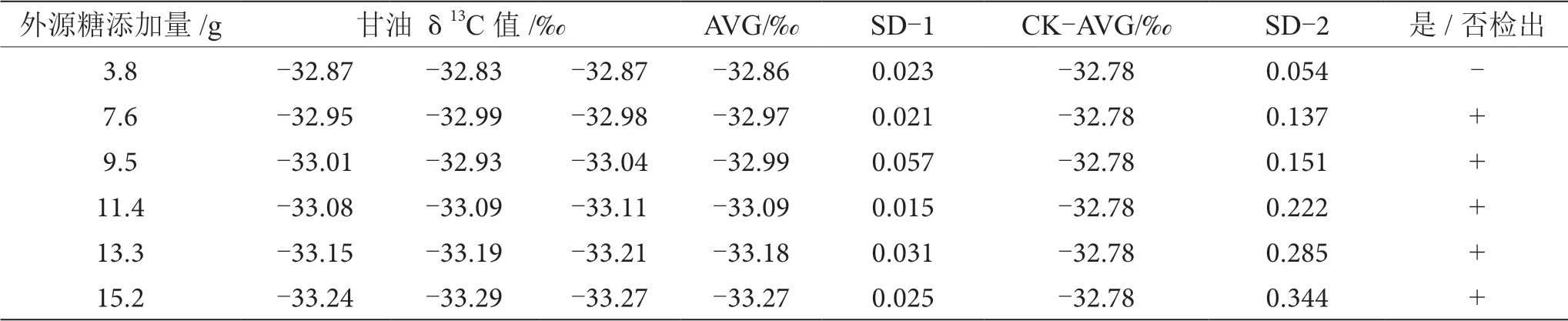
表13 掺δ13C值为-26.68‰的外源糖葡萄酒中甘油δ13C值显著性差异分析表
由表6~13可知,在200 mL的葡萄酒样品中,掺入δ13C值为-12.68‰、-14.64‰、-16.63‰、-18.67‰、 -20.65‰、-22.68‰和-24.64‰的外源糖,葡萄汁与外源糖δ13C值分别相差12.49‰、10.53‰、8.54‰、6.50‰、4.52‰、2.49‰和0.53‰,酒精度调节1.0%时,SD>0.100,说明当掺入δ13C值为-12.68‰、-14.64‰、 -16.63‰、-18.67‰、-20.65‰、-22.68‰和24.64‰的外源糖时,该预测模型至少能够检出酒精度提升1.0%时的添加量;在200 mL的葡萄酒样品中,当掺入与葡萄汁较相近的δ13C值为-26.68‰的外源糖时,葡萄汁与外源糖δ13C值相差1.53‰,酒精度调节1.0%时,对照组样品与葡萄酒掺糖样品中甘油δ13C值相差0.08‰,SD<0.100,不能检出,酒精度调节2.0%时,对照组样品与葡萄酒掺糖样品中甘油δ13C值相差0.19‰,SD>0.100,能检出,说明该预测模型至少能够检出酒精度提升2.0%的添加量。
3 讨论
葡萄酒是新鲜葡萄或葡萄汁经发酵后获得的低酒精度饮料产品,酵母菌可以将葡萄浆果中的糖分解为乙醇、甘油、有机酸等其他副产物,反应过程相当复杂,有许多连续反应和中间产物,且需要一系列酶参与。酒精发酵主要分为糖分子、丙酮酸的分解、甘油发酵。因此,在葡萄汁发酵过程中添加外源糖时,外源糖也会参加以上的生化反应,会产生乙醇、甘油等其他副产物。因此可以根据葡萄汁发酵过程中碳的去向,通过测定发酵产物甘油δ13C值有效鉴别外源糖掺入。
江伟等[12]基于不同植物来源糖发酵后乙醇不同位点D/H含量存在差异的原理,采用SNIF-NMR分析了加糖酿造葡萄酒乙醇分子中同位素的变化。结果表明,当葡萄酒在发酵过程中添加蔗糖和甜菜糖时,乙醇分子(D/H)Ⅰ含量和R值都会发生变化,通过测定乙醇分子中甲基位(D/H)Ⅰ的含量,可判断葡萄酒在酿造前是否添加了外源糖。相比之下,本课题的研究是基于对照组与掺糖葡萄酒中甘油δ13C值间的SD建立葡萄酒掺糖鉴别模型,且该模型可以鉴别外源糖的添加,并有效鉴别了葡萄酒征求意见稿中酒精度提升2.0%的外源糖添加量。
4 结论
稳定同位素联用技术与其他化学计量法联合使用对同位素进行分析,能够有效降低葡萄酒掺糖判定误差,提高葡萄酒掺糖的鉴别效率,已成为解决葡萄酒掺糖的强有力手段。本文通过该技术制备了8种不同δ13C值分布的外源糖添加到葡萄汁中进行发酵,获得了国家标准规定最低酒度7.0%、生活中普遍可见酒度13.0%以及普通酵母耐受酒度16.0%的葡萄酒样。测定发酵后葡萄酒样中甘油的δ13C值,与对照组样品进行差异性分析可得,在200 mL的酒样中,掺入δ13C值-12.68‰、-14.64‰、-16.63‰、-18.68‰、 -20.68‰、-22.68‰和-24.64‰外源糖的量调节1.0%酒精度时,都能有效检出外源糖的掺入,且该预测模型外源糖的最小检出限为3.8 g,掺入δ13C值为-26.68‰的外源糖的量调节1.0%酒精度时,由差异性分析可知SD<0.100,无法鉴别外源糖的掺入,当掺入的量调节2.0%酒精度,能有效检出外源糖的掺入,且该预测模型外源糖的最小检出限为7.6 g。针对葡萄酒征求意见稿中提出的发酵过程中允许添加白砂糖作为外源糖提高酒精度的最大添加量不超过产生2.0%酒精,利用本文建立的外源糖鉴别技术可以有效地进行鉴别,这种联用技术为我国葡萄酒掺糖鉴别的深入研究提供了思路,同时也对实现我国葡萄酒市场的有效监管、促进葡萄酒市场向规范化发展具有极其重要的指导意义。

