PEO基Li+-g-C3N4复合固态电解质的制备及其电化学性能
张林森,王士奇,王利霞,宋延华
(1郑州轻工业大学材料与化学工程学院;2郑州轻工业大学陶瓷材料研究中心;3河南省陶瓷基新能源材料国际联合实验室,河南 郑州 450001)
现有商业锂离子电池主要使用液体电解质,容易发生泄漏、燃烧等安全问题。有效解决方案之一是采用固态电解质锂离子电池。固态电解质主要可以分为三类:无机固态电解质、聚合物固态电解质和复合固态电解质。
复合固态电解质有力学性能和柔韧性良好,且离子电导率高、能量密度高、循环性能和安全性能较好等优点[1]。其中PEO基聚合物被认为是最有前景的也是研究较广泛的。在室温下,PEO 的结晶度比较高,在结晶过程中聚合物的动力学速度减慢,导致离子电导率低,无法满足使用要求,因此,需要抑制PEO 的结晶度,增加PEO 的非晶相[2]。添加增塑剂或填料等策略可以提高PEO基电解质的离子导电性,其中对混合无机填料和聚合物有机基质的研究较多[3-5]。氮化碳(g-C3N4)是一种具有类似石墨烯二维平面结构的材料,具有比表面积大、导热率高、热稳定和化学稳定性好等特点,且g-C3N4特有的多孔片状结构更有利于Li+的嵌入与脱出[6]。Li 等[7]将g-C3N4当作无机填料添加到PEO 基固态电解质中,组装的全固态电池在60 ℃循环100次后容量仍有155 mA/g。
本工作首次提出利用g-C3N4表面丰富官能团对其进行锂化处理,并将锂化后的g-C3N4采用流延-热压法制备PEO 基Li+-g-C3N4(L-g-C3N4)复合固态电解质。L-g-C3N4可为固态电解质提供较多的Li+,PEO基L-g-C3N4复合固态电解质具有更高离子电导率和锂离子迁移数。以复合固态电解质组装的Li/LiFePO4电池具有优异的电化学性能。
1 实 验
1.1 锂化氮化碳(L-g-C3N4)的制备
称取10 g 三聚氰胺(Melamine)于带盖坩埚中,置于马弗炉以5 ℃/min的升温速率,升温至550 ℃,保温4 h,自然冷却降温,得到淡黄色材料g-C3N4。
分别取10 g K2Cr2O7与50 mL H2SO4(98%,质量分数)加入烧杯混合,得到棕色溶液;将0.5 g g-C3N4加入上述溶液中,搅拌反应2 h,然后过滤、洗涤干净。将处理过的g-C3N4加入0.1 mol/L 100 mL LiCl溶液中,水浴加热80 ℃,搅拌反应6 h,然后离心、洗涤、冷冻干燥得到白色粉末L-g-C3N4。
1.2 复合固态电解质的制备
称取一定量PEO(上海产,AR)和L-g-C3N4(在PEO-LiTFSΙ 体系中的质量分数分别为5%、10%和15%),将上述两种材料一起研磨半小时,用量筒量取15 mL的乙腈(天津产,AR),将研磨好的混合物加入到乙腈中,60 ℃加热搅拌12 h,加入LiTFSΙ(上海产,AR)继续搅拌,得到白色胶状物。将得到的白色胶状物倒入模具中,在60 ℃下真空干燥10 h。对干燥好的固态电解质进行热压,75 ℃热压5 min,最后将固态电解质膜裁剪成直径为19 mm的圆片,放入充满氩气的手套箱中备用。
1.3 正极极片的制备和电池的组装
将磷酸铁锂(深圳产,电池级)、乙炔黑(日本产,电池级)与聚偏氟乙烯(日本产,电池级)按质量比9∶0.5∶0.5混匀,加入适量的N-甲基吡咯烷酮(天津产,AR)制成浆料,涂覆于14 μm 厚的铝箔(日本产,电池级)上,先在80 ℃下真空干燥2 h,再在120 ℃下真空干燥12 h,以10 MPa的压力压片,最后冲成直径为14 mm 的圆形极片(3~4 mg/cm2)。以金属锂片(山东产,电池级)为负极,所得复合固态电解质为隔膜和电解质,在手套箱中组装CR2016型扣式电池。
1.4 材料分析
用D8-ADVANCB型X射线衍射仪(德国产)对材料进行物相分析,Cu 靶Kα,λ=0.15406 nm,管压40 kV、管流30 mA,扫描速度为2°/min,步长为0.02°;用JEM-2100 透射电子显微镜(TEM,日本产)观察材料的微观结构;采用红外光谱仪对特征官能团进行检测;采用差示扫描量热仪(DSC,NETZSCH)检测热稳定性。
1.5 电化学性能测试
电化学性能测试在60 ℃下进行,用CT-4008电池测试系统(广州产)进行恒流充放电测试,电压为2.5~4.0 V,电流为0.5 C。用CHΙ660E型电化学工作站(上海产)进行LSV、直流极化曲线和交流阻抗谱测试。LSV测试的电位为2~6 V,扫描速度为0.1 mV/s;直流极化曲线测试的电压为10 mV,时间为6000 s;交流阻抗谱测试的频率为10-2~106Hz,振幅为5 mV。离子电导率测试的频率为10-2~106Hz,交流信号振幅Z为10-2V 的条件下进行交流阻抗测试。测试结构为不锈钢片/复合物电解质膜/不锈钢片。锂离子电导率计算公式为
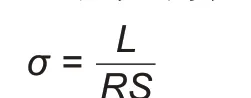
式中,σ为电导率;L为复合物电解质膜厚度;S为不锈钢片和复合物电解质膜的接触面积(不锈钢直径D=15.9 mm);R为交流阻抗值。
2 结果与讨论
2.1 形貌和结构分析
制备的g-C3N4、L-g-C3N4材料和固态电解质膜的图像见图1。其中图1(a)为g-C3N4和L-g-C3N4粉体,可以看出锂化前后的颜色发生了变化,从淡黄色变成白色;图1(b)为复合固态电解质膜的图像,可以看出膜的透明度较高;图1(c)为g-C3N4的TEM图,可以看出g-C3N4材料为片层状,且片层较薄。

图1 (a)g-C3N4、L-g-C3N4材料;(b)固态电解质膜;(c)g-C3N4的TEM图Fig.1 (a)Images of g-C3N4 and L-g-C3N4 materials,(b)solid electrolyte and(c)TEM images of g-C3N4
对制备的g-C3N4和L-g-C3N4进行XRD 分析,结果见图2。图中13.03°、27.62°的衍射峰对应的是g-C3N4的(100)和(110)晶面,对g-C3N4进行锂化改性后峰位置发生偏移,从27.62°偏移到27.72°,且峰强明显降低,说明Li+修饰后的g-C3N4样品有着较小的层间距,这可能是由于金属离子的嵌入使层间相互作用力增强而引起的[8]。

图2 g-C3N4和L-g-C3N4的XRD图Fig.2 XRD patterns of g-C3N4 and L-g-C3N4
图3 为g-C3N4和L-g-C3N4的红外谱图。在804 cm-1处的锐吸收峰对应于典型的三嗪环的代表性呼吸振动模式。1230、1314、1395以及1539 cm-1处存在明显的吸收峰,这些对应于C—N 杂环的典型拉伸振动,为g-C3N4的基本单元;由L-g-C3N4的红外谱图可知,在1235 cm-1和1405 cm-1处的峰分别向高频区偏移了5 cm-1和10 cm-1,对应于C—N杂环的典型拉伸振动,说明Li+与N原子之间的相互作用力使红外特征峰发生偏移[9]。
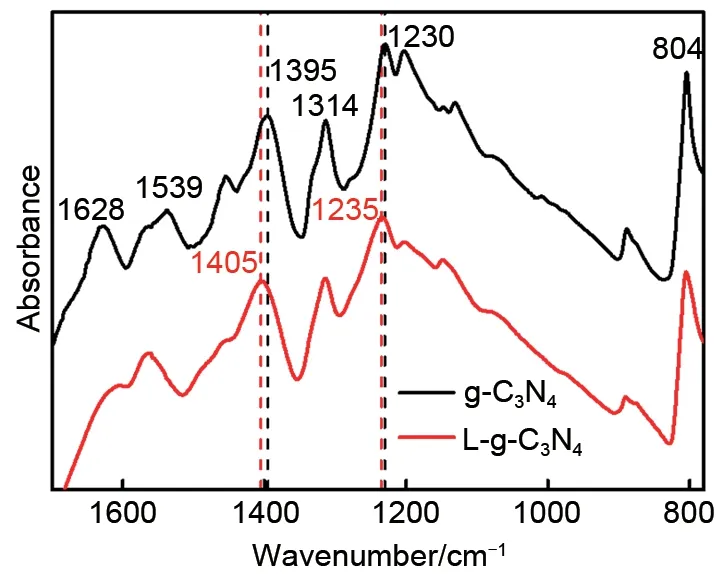
图3 g-C3N4和L-g-C3N4的FT-IR图Fig.3 FT-IR patterns of g-C3N4 and L-g-C3N4
图4为PEO基固态电解质膜的XRD图。不同质量分数L-g-C3N4制成的复合固态电解质,在15°~30°均有两个明显的衍射峰。在不同L-g-C3N4含量下,PEO/L-g-C3N4复合电解质的峰值强度都有下降,说明L-g-C3N4降低了PEO 基体的结晶度,增加了非晶相[10-11]。这一现象可以解释为L-g-C3N4材料对聚合物侧链有序排列的破坏作用,非晶态相比例增加,有利于提高离子电导率[12-13]。

图4 PEO基固态电解质的XRD图Fig.4 XRD patterns of PEO-based solid electrolyte
图5 为LiTFSΙ、PEO 和PEO 基固态电解质的FT-ΙR 图。LiTFSΙ 中—CF3的对称和非对称伸缩振动峰分别对应于1059和1188 cm-1处;LiTFSΙ中—SO2—的对称和非对称伸缩峰的峰位置则位于1131和1326 cm-1处。在PEO中,1279、1341、1464和2880 cm-1处的峰则对应于PEO 中C—H 键的伸缩振动;而PEO中醚键(—O—C—O—)的伸缩振动峰在1093 cm-1处。在纯PEO-LiTFSΙ体系中,1143和1340 cm-1对应于—SO2—的对称和非对称伸缩峰;在加入g-C3N4后,峰位置为1144和1341 cm-1,红外峰发生偏移,说明g-C3N4和LiTFSΙ 中的—SO2—存在着相互作用,使Li+处于游离态从而提升离子电导率。g-C3N4的表面富含氮原子,可视为路易斯碱,锂离子可在聚合物和填料之间的界面快速迁移[7]。然而,当加入L-g-C3N4后,峰位置偏移至1145和1342 cm-1位置,相较添加g-C3N4的红外峰偏移更多,说明L-g-C3N4与LiTFSΙ中的—SO2—具有更大的作用力,可使更多的Li+处于游离态进一步提升离子电导率。

图5 (a)LiTFSI、PEO和PEO基固态电解质的FT-IR图;(b)LiTFSI、PEO和PEO基固态电解质的1500~800 cm-1的FT-IR图Fig.5 (a)FT-IR patterns of LiTFSI、PEO and PEO-based solid electrolytes.(b)1500~800 cm-1 FT-IR patterns of LiTFSI、PEO and PEO-based solid electrolytes
图6 为PEO 基固态电解质的DSC 图。添加g-C3N4和L-g-C3N4复合固态电解质的DSC 曲线在50 ℃到80 ℃之间都出现了一个比较尖锐的吸热峰;相较于纯PEO-LiTFSΙ 体系的温度要低,表明加入g-C3N4和L-g-C3N4可以使得结晶熔融温度降低,非晶态相比例的增加,使得离子电导率增加。
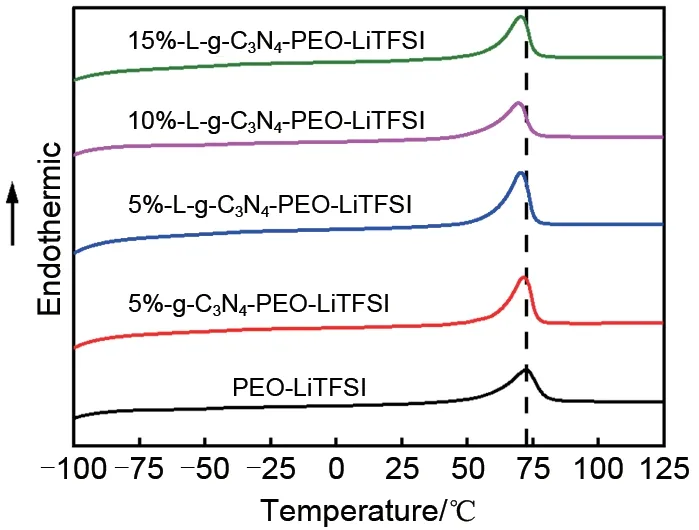
图6 PEO基固态电解质DSC图Fig.6 DSC diagrams of PEO-based solid electrolytes
2.2 电化学性能分析
图7 为60 ℃下PEO 基固态电解质的离子电导率。由图7计算得到,纯PEO-LiTFSΙ的离子电导率为5.14×10-6S/cm,g-C3N4质量分数为5%的复合固态电解质离子电导率为9.81×10-5S/cm;而L-g-C3N4质量分数为5%、10%和15%的复合固态电解质,离子电导率依次为2.17×10-4S/cm、3.95×10-4S/cm、2.16×10-4S/cm。这说明,相较于纯PEOLiTFSΙ 体系和g-C3N4复合固态电解质,添加L-g-C3N4对离子电导率有显著提高;不同质量分数的Lg-C3N4复合固态电解质比较可知,当L-g-C3N4质量分数为10%时,复合固态电解质的离子电导率最高,当L-g-C3N4的添加量达到15%时电导率降低,这是因为过量的L-g-C3N4部分会发生团聚,导致Li+的迁移受到阻碍,反而造成电导率下降[14-17]。

图7 PEO基固态电解质的交流阻抗谱Fig.7 EIS impedance plots of PEO-based solid electrolyte
对阻抗谱进行拟合,结果如表1所示,等效电路中的参数分别为测试电路中固态电解质的电阻Rb、恒相元件CPE 以及固态电解质与电极之间的耦合电容Cg[18]。

表1 PEO基固态电解质交流阻抗谱的拟合结果Table 1 Fitting results of AC impedance spectrum of PEO-based solid electrolyte
图8为质量分数为10%的L-g-C3N4复合固态电解质的直流极化曲线和交流阻抗谱。由计算可得其离子迁移数为0.639;而未锂化的复合固态电解质离子迁移数只有0.220,说明对g-C3N4进行锂化有利于提高复合固态电解质的离子迁移数[19-23]。

图8 质量分数为10%的L-g-C3N4复合固态电解质极化前后阻抗图谱和直流极化曲线Fig.8 Impedance and DC polarization curves of composite solid electrolytes with 10%L-g-C3N4
图9为PEO基固态电解质在60 ℃下的线性循环伏安曲线。如图9所示,纯PEO-LiTFSΙ电解质膜的电化学窗口为2.5~4.0 V;不管添加g-C3N4还是Lg-C3N4,制成的固态电解质膜电化学窗口均可达到2.5~4.5 V,复合固态电解质的电化学窗口明显拓宽,能匹配以磷酸铁锂为正极材料的电池[24-28]。
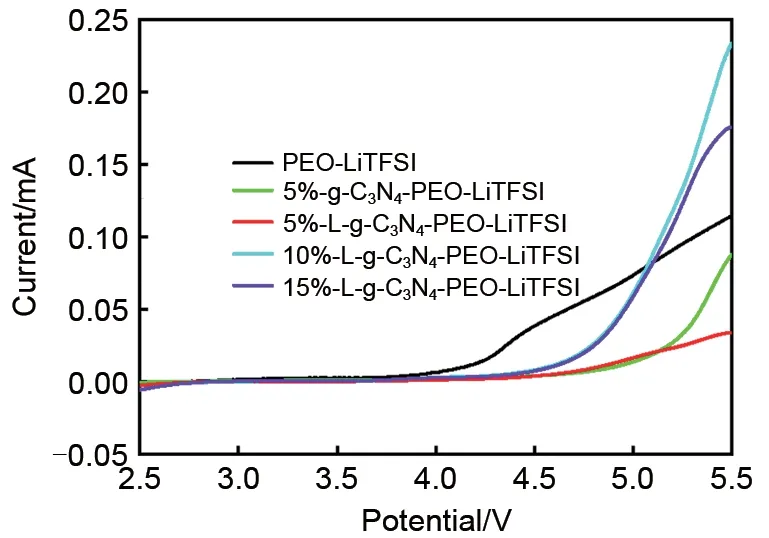
图9 PEO基固态电解质的LSV曲线Fig.9 LSV curves of PEO-based solid electrolytes
图10(a)为不同质量分数L-g-C3N4复合固态电解质组装的全固态电池在60 ℃、0.5 C条件下的首次充放电曲线。L-g-C3N4质量分数为5%、10%和15%的复合固态电解质组装的电池,首次放电比容量分别为149.13 mAh/g、163.76 mAh/g和153.95 mAh/g;图10(b)为不同质量分数L-g-C3N4复合固态电解质组装的全固态电池在0.5 C下的循环性能。从图10(b)可知,L-g-C3N4质量分数5%、10%、15%的复合物固态电解质所组装的全固态电池在循环80圈以后,放电比容量依次为144.46 mAh/g、160.10 mAh/g、146.90 mAh/g,容量保持率为97.8%。电池循环稳定在一定程度上说明复合固态电解质与电极之间建立了较稳定的固-固接触界面,二者的兼容性较好。

图10 (a)全固态电池的0.5 C首次充放电曲线;(b)全固态电池的0.5 C循环性能Fig.10 (a)Initial charge-discharge curves of all-solid-state batteries at 0.5 C;(b)0.5 C cycle performance of all-solid-state batteries
3 结 论
本工作首次提出对g-C3N4进行锂化,并制备了含有L-g-C3N4、PEO聚合物和LiTFSΙ 锂盐的复合固态电解质。在60 ℃条件下,复合固态电解质的离子导电率为3.95×10-4S/cm,锂离子迁移数为0.639,电化学窗口为4.5 V 以上。研究结果表明锂化后的g-C3N4能显著提高离子迁移数和离子电导率。组装的磷酸铁锂全固态电池以0.5 C 在2.5~4.0 V 充放电,首次放电比容量高达163.76 mAh/g,循环80次,容量仍有160.10 mAh/g,容量保持率为97.8%,具有较好的循环稳定性。

