饲粮精粗比对牦牛瘤胃菌群结构的影响
庞凯悦,柴沙驼,王 迅,孙 璐,崔占鸿,刘书杰,王书祥,杨英魁
(青海大学畜牧兽医科学院 / 青海省高原放牧家畜营养与饲料科学重点实验室 / 青海省牦牛工程技术研究中心, 青海 西宁 810016)
反刍动物的瘤胃内栖息着细菌、真菌和原虫等多种微生物[1]。瘤胃微生物可降解饲料产生挥发性脂肪酸(volatile fatty acid, VFA)和氨态氮(NH3-N),并合成微生物蛋白(microbial protein, MCP)为反刍动物提供主要蛋白质来源,对动物生产性能及健康至关重要[2-3]。瘤胃微生物菌群是反刍动物消化系统的重要组成部分,影响瘤胃菌群结构的因素有饲粮组成、动物年龄及健康状况等,其中饲粮组成是调控瘤胃菌群结构及发酵活动的主要因素[4]。研究表明,提高饲粮的精料水平显著提高了荷斯坦犊牛瘤胃液中丙酸、丁酸和氨态氮的浓度,但显著降低了纤维分解菌(纤维杆菌属、琥珀酸单胞菌属)的丰度[5]。Li 等[6]研究发现,随着饲粮中精料水平的提高,绵羊瘤胃中淀粉降解菌和蛋白质降解菌的相对丰度呈线性下降趋势。因此,饲粮中适宜的精料水平可以提高反刍动物对营养物质的吸收和利用[7],但在实际生产中,饲粮精粗比过高或过低均会改变反刍动物瘤胃微生物的结构与功能,进而影响养殖的经济效益。目前,饲粮精粗比对奶牛、山羊及其他反刍动物瘤胃微生物的调控研究已有大量的报道[8-11];但是,有关饲粮精粗比对牦牛瘤胃微生物影响的研究报道较少,在早期阶段,青海省高原放牧家畜动物营养与饲料科学重点实验室动物营养课题组研究了饲粮精粗比对育肥牦牛生长性能的影响,结果表明,适宜的饲粮精粗比能提高牦牛的生长性能和养殖收益[12],这可能与不同精粗比饲粮对牦牛瘤胃菌群结构的影响有关,因此,本研究旨在通过16s rDNA高通量测序技术,探讨饲粮精粗比对牦牛瘤胃菌群结构的影响,为牦牛的合理饲养提供理论依据。
1 材料与方法
1.1 试验设计与饲养管理
试验于2019 年9 月在青海省贵南县老扎西养殖基地进行。选择体重(164.9 ± 12.9) kg、体况良好的雄性牦牛36 头,随机分为3 组,每组12 头,饲粮精粗比分别为50 ∶ 50 (A 组)、65 ∶ 35 (B 组)和80 ∶ 20(C 组)的全混合日粮。试验期共105 d,其中预试期15 d,正试期90 d。每日08:00 和17:00 饲喂,饲草自由采食,自由饮水,各组间饲养方式及环境一致。试验饲粮设计参考《肉牛饲养标准》(NY/T 815-2004)[13],试验饲粮的组成及营养成分如表1 所列。
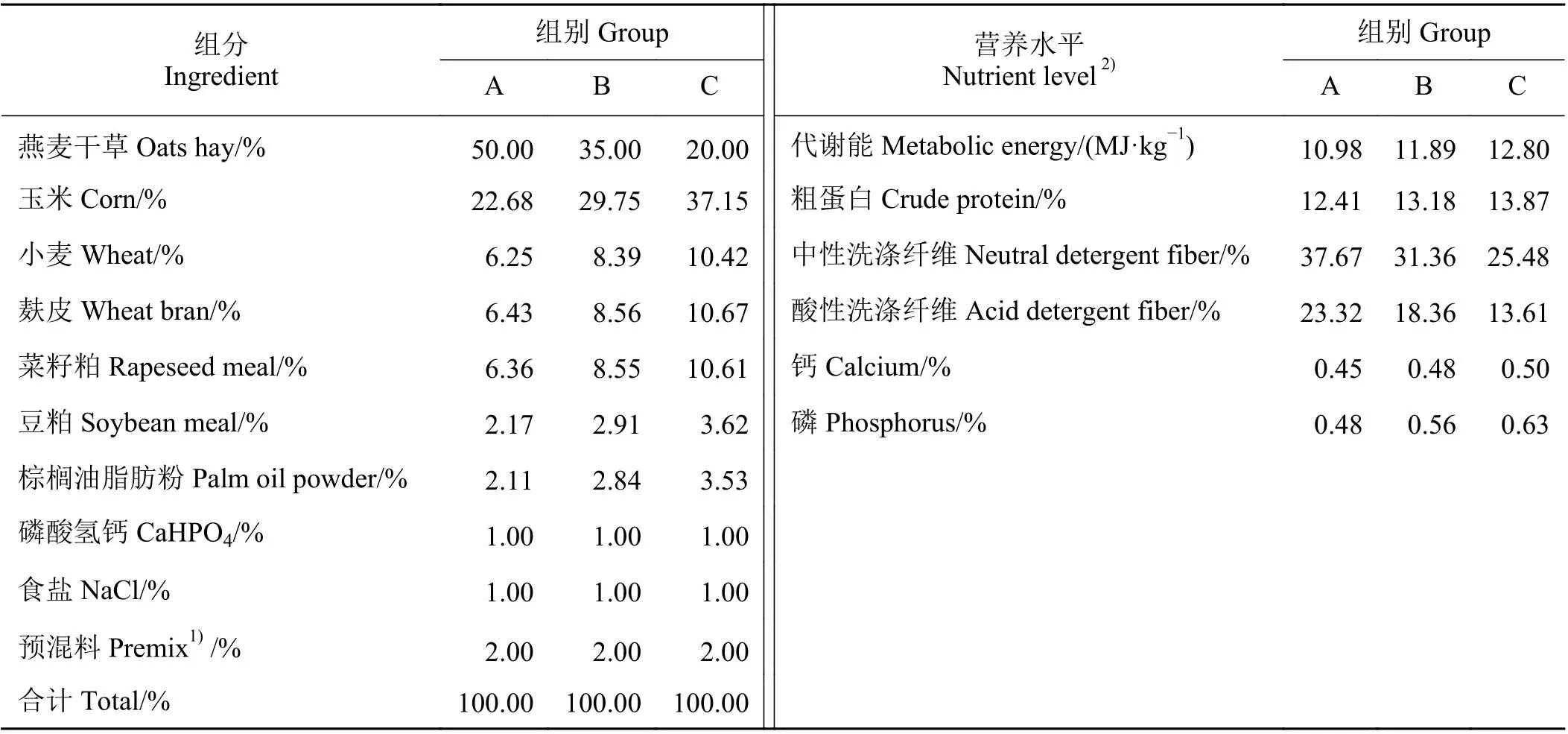
表1 试验饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of the experimental diets (dry matter basis)
1.2 样品采集
在试验期间,每30 d 收集一次试验饲粮,装于密封袋中,并在-20 ℃下储存以供测试。在试验最后1 d,每组随机选取6 头牦牛,于晨饲前,使用胃管式采样器采集每头牦牛150 mL 瘤胃液,4 层无菌纱布过滤后测定pH,剩余样品分装至15 mL 离心管中,放入液氮中,带回实验室并置于-80 ℃超低温冰箱保存待测。
1.3 指标测定及方法
1.3.1 试验饲粮营养成分的测定
干物质(dry matter, DM)、粗蛋白质(crude protein,CP)、钙(calcium, Ca)、磷(phosphorus, P)含量分别采用GB/T 6435-2014[14]、GB/T 6432-2018[15]、GB/T 6436-2002[16]和GB/T 6437-2002[17]中 的 方 法 测定。中性洗涤纤维 (neutral detergent fibres, NDF) 、酸性洗涤纤维 (acid detergent fibres, ADF) 含量采用Van 等[18]的方法测定。
1.3.2 DNA 提取、测序和分析
使用十六烷基三甲基溴化铵法(cetyl trimethyl ammonium bromide, CTAB)方法从瘤胃液样本中提取细菌DNA,通过1.0%琼脂糖凝胶电泳评估DNA的质量。PCR 采用25 μL 扩增体系。用QIAquickPCR纯化试剂盒(德国Qiagen 公司)纯化回收,瘤胃液样品送至北京奥维森基因科技有限公司分析,测序平台Mixed PE 300。
测序平台得到的原始数据采用trimmomatic(Version 0.36)软件进行处理和低质量数据过滤,通过vsearch 软件去除嵌合体,得到有效序列。对相似性大于97% 以上的序列进行筛选,生成OUTs 序列,并对OTU 聚类与注释进行统计分析。通过QIIME 2 (version 1.9.0)计算α 多样性,Bray-Curtis 相异矩阵和QIIME 2 的主坐标分析(PCoA)用于分析各处理组细菌群落的差异。线性判别分析效应大小(LEfSe,LDA > 3)用于识别两组中的重要细菌。
1.4 数据分析
用SAS 9.2 统计软件的正交多项式分析和Duncan’s多重比较,对各处理组的α 多样性指数、瘤胃细菌门和属水平菌群的相对丰度进行单因素方差分析、线性和二次趋势拟合,P< 0.05 表示差异显著。
2 结果与分析
2.1 饲粮精粗比对牦牛瘤胃细菌丰富度和多样性的影响
3 个试验组牦牛瘤胃液细菌测序共获得操作分类单元(OTU) 3 354 个(图1),其中共有的OTU 是1 851 个,占总OTU 数目的55.19%,试验A、B 和C 组的OTU 数目分别为2 817、2 590 和2 437 个,相对应的独有OTU数目分别为369、161 和185 个。通过α 多样性分析(表2)可知,随着饲粮精粗比的提高,牦牛瘤胃液细菌的物种数、Chao1 指数、Shannon指数及谱系多样性显著线性降低(P< 0.05),各组的覆盖率均大于99.5%,这表明测序程度覆盖了样品中99.5% 以上的细菌种类。基于UniFrac 的未加权的PCoA 分析可知第一成分和第二主成分的贡献率分别为28.29% 和16.76%,各处理组细菌结构能够明显分开(图2)。

图1 OTU 韦恩图Figure 1 OTU Venn diagram
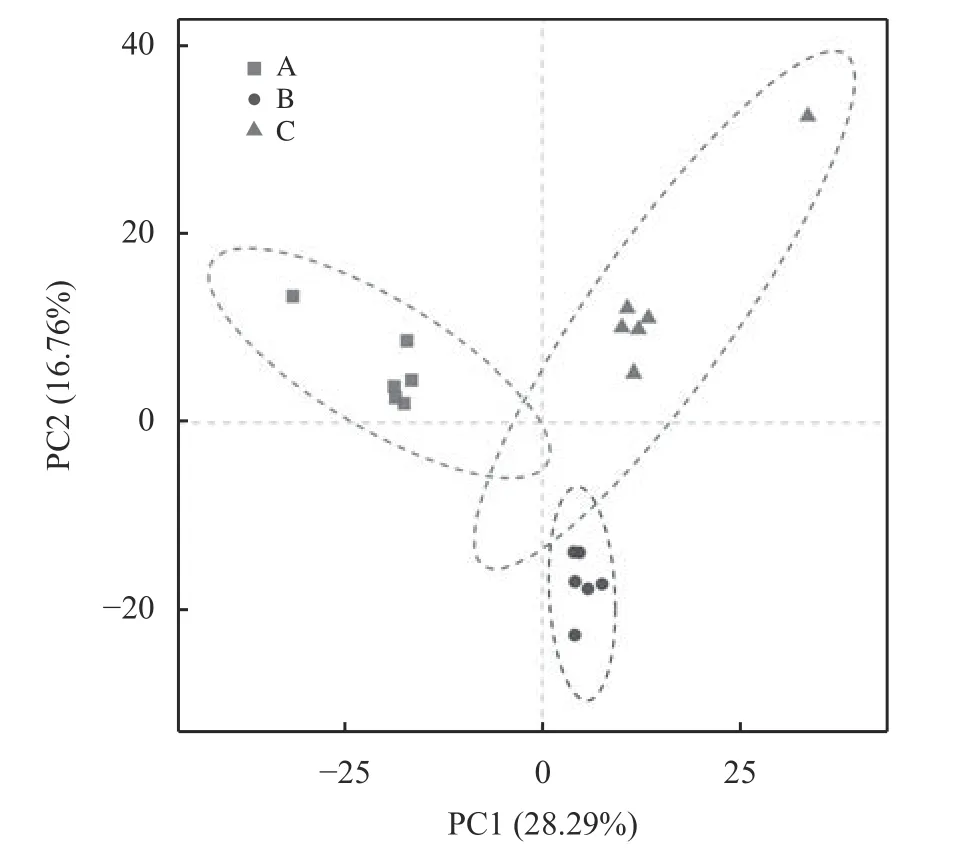
图2 PCoA 分析Figure 2 Principal coordinate analysis
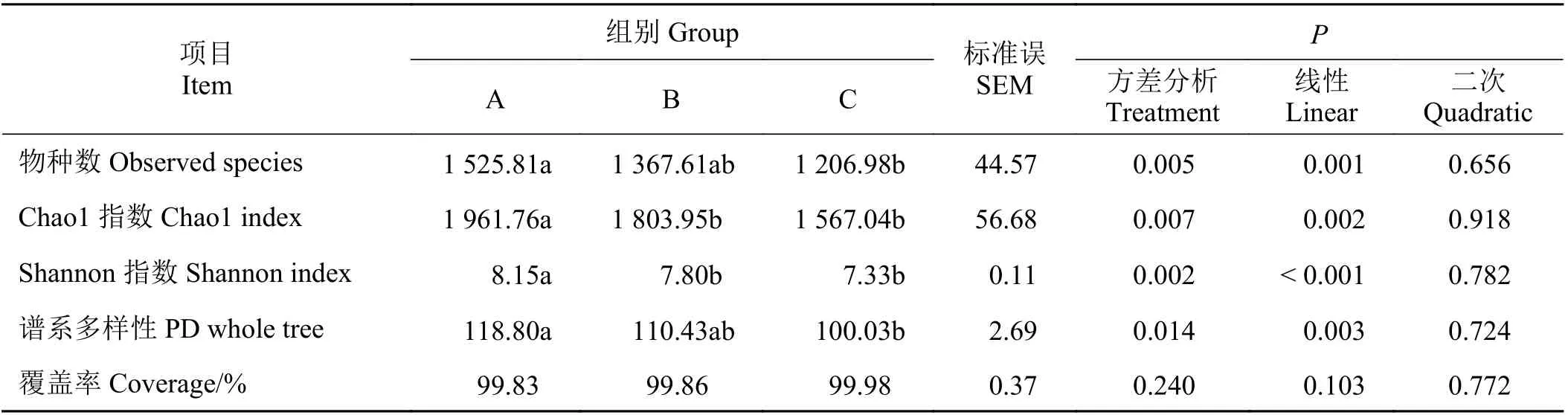
表2 饲粮精粗比对牦牛瘤胃细菌alpha 多样性的影响Table 2 Effect of ration concentrate to roughage ratios on the alpha diversity of rumen bacteria in yaks
2.2 饲粮精粗比对牦牛瘤胃细菌结构组成的影响
在门水平上,牦牛瘤胃优势菌为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes) 和放线菌门(Actinobacteria) (表3)。牦牛瘤胃的厚壁菌门和放线菌门相对丰度随着饲粮精粗比的增加呈显著线性提高(P< 0.05),而拟杆菌门的相对丰度显著线性下降(P< 0.05)。试验B 组的疣微菌门(Verrucomicrobia)相对丰度显著高于其他两组(P< 0.05)。在属水平上,牦牛瘤胃优势菌属为普雷沃菌属_1 (Prevotella_1)、理研菌科RC9 属 (Rikenellaceae_RC9_ gut_group)、克里斯滕森菌科R-7 菌属 (Christensenellaceae_R-7_group)和 瘤 胃 球 菌 科NK4A214 菌属(Ruminococcaceae_NK4A214_group) 等(表4)。随着饲粮精粗比的提高,牦牛瘤胃中普雷沃菌属_1、瘤胃球菌科NK4A214 菌属(Ruminococcaceae_NK4A214_group)和聚乙酸菌属(Acetitomaculum)的相对丰度呈显著线性提高(P< 0.05),而瘤胃球菌属_2 (Ruminococcus_2)和毛螺菌科NK3A20 菌属(Lachnospiraceae_NK3A20_group)的相对丰度呈显著线性降低(P< 0.05)。

表3 门水平下饲粮精粗比对牦牛瘤胃细菌群落组成(相对丰度)的影响Table 3 Effect of ration concentrate to roughage ratio on the composition of rumen bacterial communities(relative abundance) in yaks, phylum level%

表4 属水平下饲粮精粗比对牦牛瘤胃细菌群落组成(相对丰度)的影响Table 4 Effect of ration concentrate to roughage ratio on the composition of rumen bacterial communities(relative abundance) in yaks, genus level%
2.3 饲粮精粗比对牦牛组间差异LEFse 分析
瘤胃球菌科NK4A214 菌属(Ruminococcaceae_NK4A214_group)、聚乙酸菌属(Acetitomaculum)、消化链球菌科(Peptostreptococcaceae)、罗姆布茨菌属(Romboutsia)、Paeniclostridium、疣微菌门下的LD1-PB3在C 组中相对丰度较高。WCHB1-41、厌氧棍状菌属(Anaerotruncus)、疣微菌门(Verrucomicrobia)、艰难杆菌属(Mogibacterium) 在B 组中相对丰度最高。瘤胃球菌属_2、奎因氏菌属(Quinella)、酸氨基球菌科(Acidaminococcaceae) 在A 组中相对丰度较高(图3、图4)。
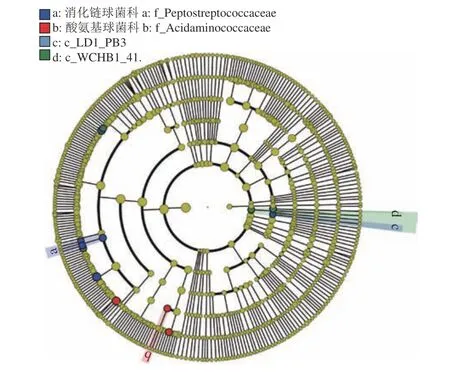
图3 基于分类信息的线性判别分析效应大小分类图Figure 3 Linear discriminant analysis effect size cladogram based on classification information

图4 基于分类信息的线性判别分析得分直方图Figure 4 Histogram of linear discriminant analysis scores based on classification information
3 讨论
3.1 饲粮精粗比对牦牛瘤胃细菌丰富度和多样性的影响
16S rDNA 高通量测序技术可以深入了解饲粮精粗比对牦牛瘤胃菌群的影响[19]。Kumar 等[20]研究表明,饲粮精料水平由20%提高至50%显著降低了产后荷斯坦奶牛瘤胃细菌的丰富度与多样性。刘玉洁[21]研究了高精料饲粮对山羊瘤胃微生物的影响,结果表明:低精料组山羊瘤胃微生物的多样性显著高于高精料组。本研究中,随着饲粮精粗比的提高,牦牛瘤胃细菌的物种数、Chao1 指数、Shannon指数及谱系多样性呈显著线性降低,与上述研究结果一致。这可能与瘤胃液pH 的降低有关。精料中的碳水化合物含量较粗料高,高比例精料会导致瘤胃乳酸含量升高,并导致pH 降低[22],进而会抑制瘤胃内相关纤维降解菌的生长与定殖[5,23],从而降低了细菌的丰富度。以上结果说明,瘤胃液pH 与瘤胃细菌的多样性和丰富度息息相关[24],过多提高饲粮精粗比会降低瘤胃细菌的多样性与丰富度。
3.2 饲粮精粗比对牦牛瘤胃细菌结构组成的影响
饲粮组成是影响反刍动物瘤胃细菌结构与多样性的主要因素之一。研究发现,肉牛瘤胃细菌的主要菌门是厚壁菌门和拟杆菌门,其数量占整个细菌门水平的80%以上[25-26]。据报道,厚壁菌门主要参与结构性碳水化合物的降解,而拟杆菌门主要参与非纤维物质的降解,两者对反刍动物瘤胃发酵至关重要[27]。本研究中,不同精粗比饲粮处理下,牦牛瘤胃内的厚壁菌门和拟杆菌门相对丰度最高,为优势菌,与以上研究结果一致。林波等[28]研究表明,0 ∶ 100、35 ∶ 65 和50 ∶ 50 3 种 精 粗 比 饲 粮 饲 喂 泌 乳 期 水 牛,全粗料组水牛瘤胃内拟杆菌门的相对丰度显著高于其他两组,而厚壁菌门的相对丰度显著低于其他两组。Fernando 等[29]研究发现,瘤胃内拟杆菌门的相对丰度与饲粮精料水平成反比,与厚壁菌门的相对丰度成正比。本研究结果与以上研究结果相似,原因可能是拟杆菌门大部分细菌属于革兰氏阴性菌,瘤胃液pH 降低会导致革兰氏阴性菌死亡或裂解,最终导致拟杆菌门的相对丰度下降,而厚壁菌门相对丰度则相应上升[30]。放线菌门属于类革兰氏阳性菌,大多数为腐生菌和寄生菌,可引起疾病[31]。本研究中,80%精料饲粮组牦牛瘤胃内放线菌门的相对丰度高于其他两组,这与王书祥等[32]和占今舜等[9]的研究结果相似,表明牦牛饲粮精粗比不宜过高。疣微菌门含有多种糖苷水解酶,在动物机体的胃肠道消化屏障作用、代谢炎症和免疫耐受方面发挥着重要作用[33-34]。本研究中,随着饲粮精粗比的提高,牦牛瘤胃的疣微菌门先增加后减少,且80%精料饲粮组牦牛瘤胃的疣微菌门丰富度低于50%精料饲粮组,这表明80%精料饲粮组的牦牛可能处于一种亚健康状态。
本研究表明,在属水平上,普雷沃菌属_1、理研菌科RC9 属和克里斯滕森菌科R-7 菌属是牦牛瘤胃细菌的优势菌群,这与Anderson 等[35]研究结果相一致。普雷沃菌属对半纤维素、果胶、淀粉和蛋白质降解至关重要[36-37]。Zhang 等[38]研究发现高精料组山羊瘤胃内细菌相对丰度较高的是普雷沃菌属。高雨飞[39]研究表明,提高饲粮中精料比例显著促进了锦江牛瘤胃普雷沃菌属的生长与定殖。本研究中,牦牛瘤胃普雷沃菌属_1 的丰度与饲粮精粗比呈正相关,这可能与高精料饲粮中淀粉含量较高有关。瘤胃球菌科NK4A214 菌属是厚壁菌门中的一种革兰氏阴性菌,能够利用或降解饲粮中不易降解的纤维和多糖[40]。有研究表明,瘤胃球菌科NK4A214 菌属丰度与宿主饲料利用率和瘤胃液VFA的代谢呈正相关关系[41]。本研究中,随着饲粮精粗比的提高,牦牛瘤胃中瘤胃球菌科NK4A214 菌属丰度呈显著线性提高,这与Cui 等[42]研究一致。张雪娇和王立志[43]研究发现,山羊瘤胃中瘤胃球菌属_2的丰度随饲粮NDF 水平提高而升高,本研究结果与其相似,表明提高精饲料摄入量可抑制牦牛瘤胃中某些纤维降解菌的生长。有研究表明,毛螺菌科具有很强的纤维素分解活性,能够降解宿主难以消化的植物纤维素和半纤维素,其丰度与饲粮中纤维的含量正相关[44-45]。本研究中,65% 精料饲粮和80%精料饲粮的毛螺菌科NK3A20 菌属的丰度显著低于50%精料饲粮组的,表明提高饲粮精粗比抑制了其在牦牛瘤胃中的生长,与Li 等[46]的研究结果一致。Koike 和Kobayashi[47]研究发现,瘤胃聚乙酸菌属可以利用单糖产生丙酸,当饲喂高精料饲粮时,有助于合成更多的丙酸。本研究中,80%精料饲粮组的聚乙酸菌属丰度显著高于50%精料饲粮,青海省高原放牧家畜动物营养与饲料科学重点实验室动物营养课题组前期研究瘤胃液发酵参数中丙酸的变化趋势也侧面验证这一点[12]。
4 结论
在本研究条件下,随着饲粮精粗比的提高,瘤胃细菌的多样性与丰富度降低,降低了部分纤维相关降解菌的丰度;并且过高比例(80%)的精料饲粮,会抑制部分瘤胃微生物活性,不利于牦牛健康生长。

