利用CRISPR-Cas9 编辑蒺藜苜蓿串联重复基因
李宇赫,裴 悦,沈怡彤,张 锐,王宜宜,王劭学,姚莉琦,李力涵,康明明,李登耀,陈玉辉
(兰州大学生命科学学院, 甘肃 兰州 730000)
CRISPR-Cas9 是近几年发展起来的一类基因编辑技术,它能对基因组中特定的位点进行编辑,技术门槛低、操作简单、试验周期短且成本低廉[1-2]。随着CRISPR-Cas9 技术的不断完善和成熟,该技术已经在微生物[3]、动物[4-6]和植物[7-9]等领域被广泛应用。利用CRISPR-Cas9 技术,科研工作者已经在水稻(Oryza sativa)[8-10]、拟南芥(Arabidopsis thaliana)[11]、 烟 草(Nicotiana tabacum)[11-12]、 玉 米(Zea mays)[13]、小 麦(Triticum aestivum)[9,14]、高粱(Sorghum bicolor)[7]、大豆(Glycine max)[15-16]等植物上成功的实现了基因编辑。2013 年Shan 等[9]利用CRISPR-Cas9 技术成功编辑了水稻OsPDS-P1和OsBADH2基因,首次实现了CRISPR-Cas9 在水稻基因组中的编辑。2015 年,Michno 等[17]研究实现了CRISPR-Cas9 系统通过毛根转化,编辑大豆和蒺藜苜蓿(Medicago truncatula)体细胞基因,表明CRISPR-Cas9 技术在豆科植物基因功能研究中具有很大的应用潜力。2016 年,Meng 等[18]开发了一种优化的CRISPR-Cas9系统,该系统通过农杆菌(Agrobacterium) 介导成功地诱导了蒺藜苜蓿MtPDS基因的编辑,并利获得了纯合突变体,基因编辑效率达到10.35%,证明了CRISPR-Cas9 系统在蒺藜苜蓿中的可行性,开创了CRISPR-Cas9 技术在蒺藜苜蓿基因编辑的先例。2017 年Curtin 等[19]同样利用开发的CRISPR-Cas9 系统成功的对蒺藜苜蓿Medtr4g020620和Medtr2g013650基因进行了编辑。如今CRISPR-Cas9 系统已经被广泛应用于蒺藜苜蓿的基因功能研究,极大地推进了共生固氮、植物发育和植物抗逆等方面的研究。进一步研究将使CRISPR-Cas9 系统在紫花苜蓿(Medicago sativa)等基因组更复杂、更庞大的栽培豆科牧草中的应用范围扩大,有利于加快豆科牧草的遗传改良。
串联重复基因是植物基因组的重要组成部分,为植物基因组增加了基因拷贝数和同源基因变异,对植物基因家族的扩展贡献显著,在植物进化和适应环境变化中起着重要作用[20-21]。蒺藜苜蓿是豆科模式植物,其基因组中 33% 的基因以串联重复形式存在[22],这些基因在功能上冗余,是研究豆科植物基因功能的一大瓶颈。
DWF7基因编码Δ7甾醇C5去饱和酶,参与植物油菜素甾醇的合成。在模式植物拟南芥中该基因只有一个拷贝(AT3G02580),AtDWF7 蛋白定位于细胞内质网和脂质颗粒,在植物油菜素内酯和甾醇合成途径发挥作用。atdwf7表现出明显的矮化、育性降低或丧失的表型[23]。在蒺藜苜蓿基因组中,DWF7基因定位于6 号染色体,有3 个串联重复的拷贝:Medtr6g018820.1(GENE1)、Medtr6g018860.1(GENE2)、Medtr6g018900.1(GENE3) (图1)。由于基因功能的冗余,在豆科植物中对于DWF7基因的研究没有相关报道。为了研究DWF7基因在豆科植物发育中的功能,本研究利用CRISPR-Cas9 技术,针对蒺藜苜蓿DWF7基因的3 个拷贝,通过序列比对在3 个基因外显子的同源区段设计了两个靶点,构建基因表达载体,转化野生型蒺藜苜蓿产生毛根,提取转基因毛根DNA 进行基因编辑的分析鉴定。本研究在毛根中成功实现了对蒺藜苜蓿DWF7基因3 个拷贝的同时编辑,证明CRISPR-Cas9 系统同时编辑含有同源区段的串联重复基因的可能性,为进一步通过稳定遗传转化方法获得dwf7突变体植株提供理论依据,有利于进一步研究豆科植物中DWF7的基因功能。同时该方法也为今后通过CRISPR-Cas9 技术对串联重复基因的编辑提供参考。

图1 MtDWF7 在6 号染色体上位置示意图Figure 1 Schematic of MtDWF7 position on chromosome 6 in Medicago truncatula
1 材料与方法
1.1 植物材料、载体和菌株
根毛转化受体材料为本试验保存的蒺藜苜蓿野生型‘Jemalong A17’。
本研究所用CRISPR-Cas9 系统载体:pAH595、pNJB184-4 Cas9、pSC218GG 均由美国明尼苏达大学Nevin D.Young 实验室提供。
本研究所用菌株:大肠杆菌DH5α、DB3.1和发根农杆菌Arqual1 均由细胞活动与逆境适应教育部重点实验室植物分子遗传学实验室保存。
1.2 主要试剂
限制性内切酶Esp3Ⅰ、BsaⅠ及T4 DNA 连接酶购自New England BioLabs (NEB) 公司;LR Clonase购自赛默飞公司;DNA 抽提试剂盒、壮观霉素、卡那霉素等购自天根生化科技公司;氯化锰、硼酸、氢氧化钾等化学试剂购自上海生工和国药公司,均为国产分析纯。
1.3 MtDWF7 基因的序列比对和靶点选择
从https://phytozome.jgi.doe.gov/pz/portal.html网站下载MtDWF7基因序列,通过生物信息学的方法对基因序列分析比对发现:GENE1和GENE2的基因组序列含有3 个外显子区段,而GENE3只含有2 个外显子区段。本研究进一步对3 个基因的外显子区进行序列比对发现:GENE1的第2 个外显子区与GENE2的第2 个外显子区、GENE3的第1 个外显子区序列高度同源;GENE1的第3 个外显子区与GENE2的第3 个外显子区、GENE3的第2 个外显子区序列高度同源(图2)。因此,拟在3 个基因同源的两个外显子区段设计CRISPR-Cas9 的编辑靶点,达到同时编辑3 个基因的目的。
利用http://crispr.hzau.edu.cn/cgi-bin/CRISPR2/CRI SPR 网站设计CRISPR-Cas9 编辑靶点。在3 个基因同源的两个外显子区分别设计能够同时敲除3 个基因的两个靶位点Target1 和Target2 (图2)。

图2 MtDWF7 串联重复基因结构及所选靶点位置Figure 2 Structure of MtDWF7 tandem repeat genes and the location of targets
1.4 表达载体构建
1.4.1 靶点引物设计
对选择的两个靶点进行引物设计,在引物序列上添加相应的酶切位点,末尾加G,最终引物序列如下:
T1-F-Esp3Ⅰ:GATTGGCTTGAAGTATTCCATC AAGG
T1-R:AAAACCTTGATGGAATACTTCAAGCC
T2-F-BsaⅠ:GTACGGCATGAAGATATTTGTAA AGG
T2-R:AAAACCTTTACAAATATCTTCATGCCC
1.4.2 引物退火反应合成双链DNA
分别将合成的两对引物通过退火反应形成双链DNA,反 应 体 系 如 下:Primer-F (100 μmol·L-1)3 μL,Primer-R (100 μmol·L-1) 3 μL,10 × T4 Buffer 3 μL,T4 PNK 2 μL,ddH2O 19 μL。将PCR 管置于37 ℃下孵育90 min 后,加入4 μL 0.5 mol·L-1NaCl,煮沸 5 min,冷却至室温,用ddH2O 按照1 ∶ 500 稀释。
1.4.3 pAH595/Target 1 入门载体的构建
通过Golden Gate 技术将靶点1 (Target1)退火后的引物双链DNA 产物插入载体pAH595 中的BsmBⅠ(Esp3Ⅰ)位点(图3),反应体系如下:10 × T4 Buffer 2 μL,pAH595 Construct 1 μL,Primer/Target1 Annealing sequence 1 μL,Esp3I 1 μL,T4 Ligase 1 μL,ddH2O 14 μL。Golden Gate 循 环 反 应 程 序:37 ℃下 反 应5 min, 再于16 ℃条件下反应10 min,经过10 个循环后,在37 ℃条件下反应15 min,之后在80 ℃条件下反应5 min。 将反应产物转化大肠杆菌DH5α感受态细胞,壮观霉素筛选。对插入靶点1 后的载体进行PCR检测,鉴定引物U6-F1:AGAACAATAGTA TTTCTTATATAGG。

图3 Target1 插入载体pAH595 中BsmBⅠ位点示意图Figure 3 Schematic of Target1 BsmBⅠ site insertion vector pAH595
1.4.4 构建pAH595/Target1/Target2 入门载体
将靶点2 (Target2)引物双链DNA 插入pAH595/Target1 的BsaⅠ位点(图4)。反应体系如下:10 × T4 Buffer 2 μL,pAH595/Target1 Construct 1 μL,Primer/Target2 Annealing sequence 1 μL,BsaⅠ 1 μL,T4 Ligase 1 μL,ddH2O 14 μL。Golden Gate 循环反应体系同上。对插入靶点2 后的载体进行PCR 鉴定并测序,鉴定引物At7SL F1:CTATAATGGGACTCAAAATAAGG。
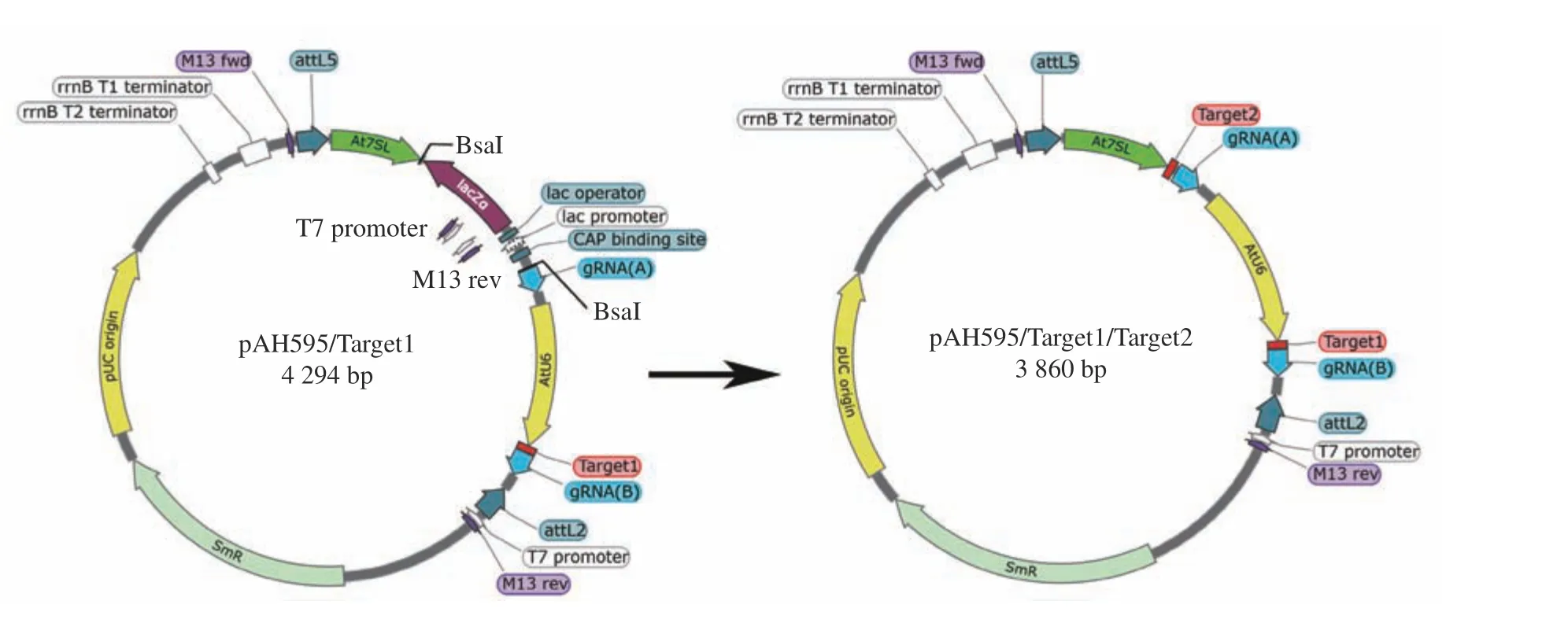
图4 Target2 插入载体pAH595/Target 1 中的BsaⅠ位点示意图Figure 4 Schematic of BsaⅠ site of Target2 inserted into vector pAH595/Target 1
1.4.5 pSC218GG-Cas9/Target1/Target2 目的表达载体的构建
通过Gateway 多位点LR 克隆技术,将pAH595/Target 1/Target 2 载体和pNJB184-4 Cas9 载体重组到目的载体pSC218GG 中,LR 克隆反应体系如下:
pNJB184-4-Cas9-Intron 1 μL,pAH595/Target1/Target2 Target 1 μL,pSC218GG 1 μL,LR recombinase 2 μL,TE buffer (pH 8.0) 5 μL。将反应体系在室温条件下孵育1 h,转化大肠杆菌DH5α 感受态细胞, Kana 抗生素筛选,PCR 鉴定并测序,构建好的载体中同时含有靶点1 和靶点2 及Cas9 表达元件(图5)。

图5 目的载体pSC218GG-Cas9-Target1/Target2 的构建示意图Figure 5 Schematic of construction of target vector pSC218GG-Cas9- Target1/Target2
将构建好的载体转入发根农杆菌Arqual 1 中,保存转化阳性的菌种用于毛根转化。
1.5 蒺藜苜蓿毛根转化和转基因毛根鉴定
1.5.1 蒺藜苜蓿种子的消毒处理和发芽
挑选饱满的蒺藜苜蓿野生型A17 种子50 粒左右,用刀片在种皮表面轻轻划一下产生划痕后,放入50 mL 离心管中;在无菌超净台中加入30 mL 左右的30% 的次氯酸钠(加0.1% Tween-20)溶液,水平摇床上轻轻晃动5 min;倒掉溶液,用灭菌蒸馏水清洗种子5 次;离心管中加入无菌的去离子水30 mL,用锡箔纸包住避光,放在水平摇床上摇动过夜;将种子放到带有润湿灭菌滤纸的培养皿上,放到冰箱中2~3 d 进行发芽处理。
1.5.2 生根农杆菌的侵染
取-80 ℃冻存的菌株pSC218GG-Cas9/Target1/Target2,接种到5 mL 含有MES 和乙酰丁香酮及相应的抗生素(卡那霉素和链霉素,各100 mg·L-1)的液体培养基里,28 ℃振荡培养2 d 后,取400 μL 菌液,均匀涂抹在含有MES 和乙酰丁香酮及相应抗生素的固体平板培养基上;将平板放置在28 ℃恒温培养箱中培养过夜,第2 天可以进行侵染,一个平板可以接种100 棵植物左右;将发芽的种子取出,放在盛有去离子水的培养皿里(避免植物失水),从距离根尖3 mm 的地方,用刀片轻轻切一刀,斜切出一个角度;将植物的伤口在培养好的生根农杆菌上轻轻地裹一下,使农杆菌均匀地布满整个伤口处;将植物摆放在灭菌的低氮固体培养基上,低氮培养基配方如表1 所列,用封口膜将培养皿封好;将培养皿倾斜45°放置在培养架上,25 ℃条件下培养7 d 左右,可以清晰地看到毛根从伤口处长出来;对长出的毛根拍照,并取样提取基因组DNA。
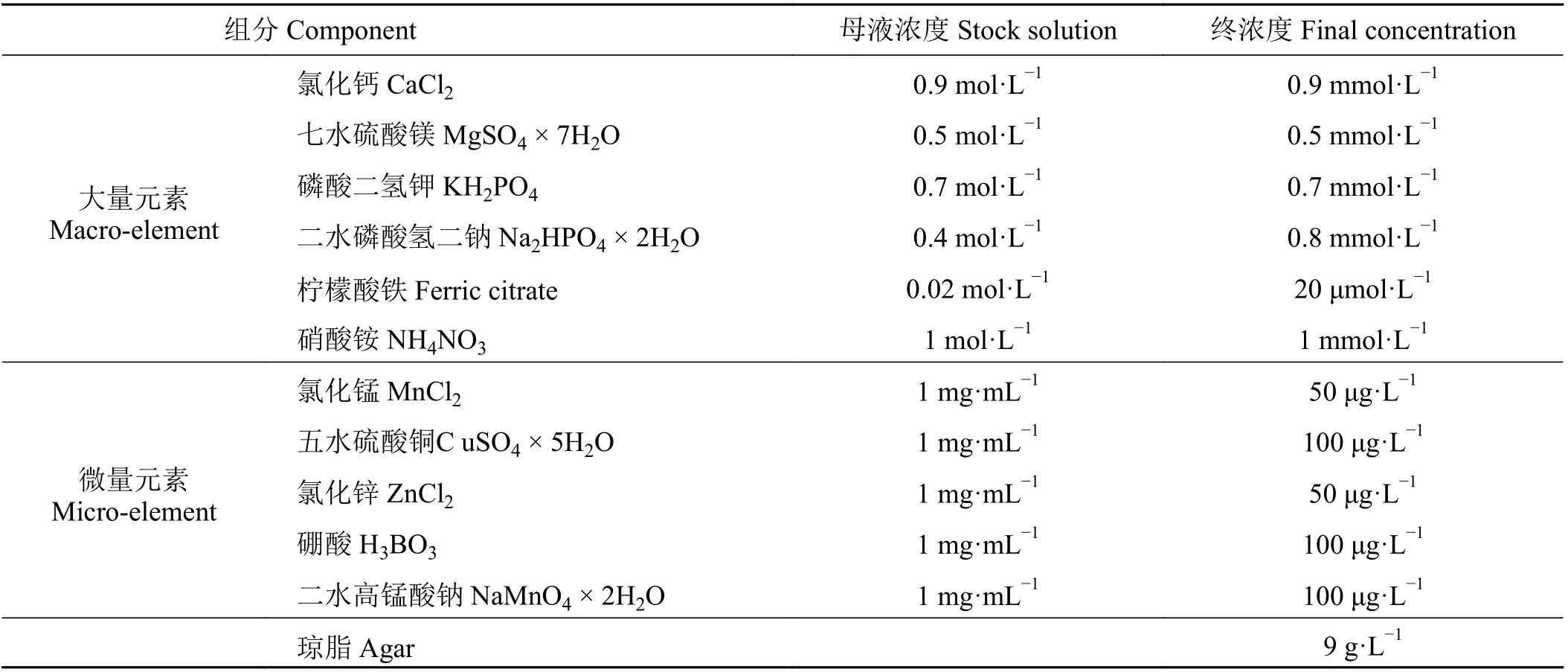
表1 低氮培养基配方表Table 1 Formula table of low nitrogen medium
1.5.3 转基因毛根DNA 的提取
转基因毛根DNA 的提取按照天根公司DNA 抽提试剂盒的说明进行标准操作。DNA 提取后利用Nanodrop 检测DNA 纯度和浓度。
1.5.4 测序检测靶位点和基因编辑效率
根据载体所带Cas9 序列设计一对引物用于检测载体是否转入植物细胞;在3 个基因的靶点附近分别设计引物,用于检测是否发生基因编辑,引物序列如表2 所列。以提取到的毛根DNA 为模板进行PCR 扩增,若能够扩增出Cas9 序列即为转基因毛根,将转基因毛根靶位点引物的扩增条带切胶回收后送公司测序,分析测序结果,并统计基因编辑效率。

表2 转基因毛根检测所用引物Table 2 Primer sequences for transgenic hair roots detection
2 结果与分析
2.1 表达载体的构建及根毛转化
采用1.4.2-1.4.5 的方法构建表达载体,构建成功的最终载体pSC218GG-Cas9/Target1/Target2 结构示意图(图5),Targrt1-gRNA 由AtU6 启动子驱动,Target2-gRNA 由At7SL 启动子驱动,将经过PCR 检测、测序验证正确的载体转入生根农杆菌Arqual 1 中。用Target2-F 和Target1-R 作为引物,PCR 检测阳性农杆菌菌株,电泳结果如图6 所示,5 个单克隆均有明显条带,说明转化成功。

图6 pSC218GG-Cas9/target1/target2 在Arqual 1 菌株Figure 6 pSC218GG-Cas9/target1/target2 in Arqual 1 strains
以阳性Arqual 1 农杆菌为介体转化蒺藜苜蓿野生型A17 毛根(图7、图8)。接种3 周后植物的根生长明显,可见植物生长出的具有向地性的侧根之间,生长出了不具有向地性的毛根。

图7 发芽种子于低氮培养基摆放图Figure 7 Placement of germinated seeds in low nitrogen medium
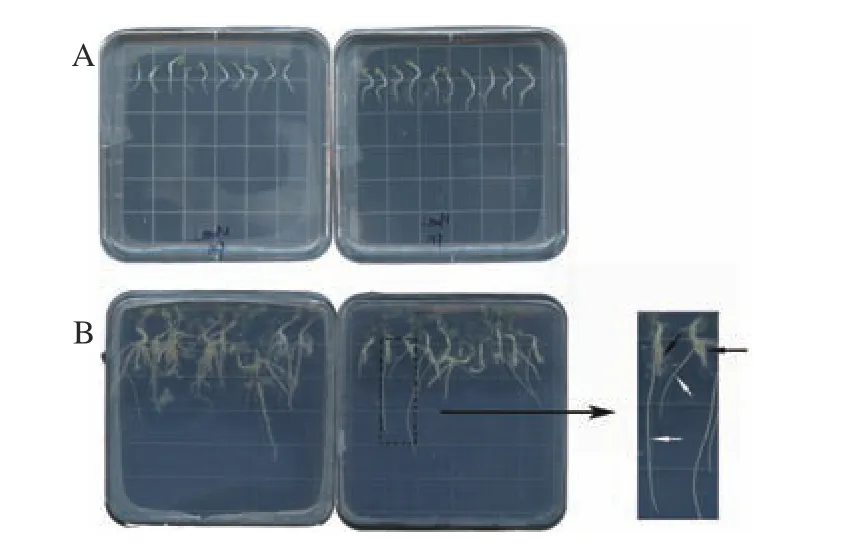
图8 接种后植物生根状况Figure 8 Rooting status of plants after inoculation
2.2 基因编辑效率检测
为了检测生长出的毛根是否为转基因毛根以及转基因毛根的基因编辑效率,首先以1.5.6 的方法提取毛根的DNA。本研究共提取得到了35 份毛根的DNA 样本,编号为1~20、37~51,用Nanodrop 检测DNA 纯度和浓度。
选择Cas9 基因引物进行PCR 检测,得到的35 份转基因毛根,编号为1~20、37~51。电泳结果表明,除了4 号由于操作问题没有明显条带以外,其余样品均检测出Cas9 基因的转入(图9)。4 号后又重新电泳检测,得到结果也有明显条带。

图9 Cas9 基因PCR 产物的凝胶电泳结果图Figure 9 Gel electrophoresis of Cas9 gene PCR products
对转基因阳性的毛根样品,分别用3 个基因的两个靶点附近的引物(共6 对)检测是否发生基因编辑。以GENE1为例,GENE1的两个靶点附近片段扩增结果表明(图10),几乎所有的样品都检测出了靶点附近片段。

图10 GENE1 的靶点电泳鉴定结果Figure 10 Electrophoretic identification results of Gene1 targets
将PCR 产物送公司测序,分析测序结果确定是否发生基因编辑。在3 个基因的Target1 附近均检测到若干份转基因毛根样品的测序结果出现重叠峰,即发生了基因编辑。其中转基因毛根1、2、3、4 样品的GENE1-Target1 处发生编辑;转基因毛根1、2 在GENE3-Target1 处发生编辑。转基因毛根1、2 样品在3 个基因的Target1 处同时发生编辑。但是在3 个基因的Target2 附近,所有转基因毛根样品的测序结果均未发现类似Target1 处的重叠峰,即没有基因编辑发生(图11、图12)。

图11 Target1 测序结果Figure 11 Target1 sequencing results

图12 Target2 测序结果Figure 12 Target2 sequencing results
3 讨论与展望
CRISPR-Cas9 技术是近年来发展起来的一种基因定点编辑技术,具有简单、快速、高效等特点,目前已经在微生物、动物和植物中获得了广泛应用。本研究利用CRISPR-Cas9 技术,针对蒺藜苜蓿基因组中3 个串联重复基因DWF7设计两个靶位点,在转化的毛根中实现了对3 个串联重复基因的同时编辑。
根据串联重复基因高度同源的特点,尤其是外显子编码区含有碱基序列相同的片段。本研究通过序列比对在3 个基因同源的两个外显子中选取了两处靶位点。虽然本研究设计的两个靶位点是针对相同基因,但是两个靶点的基因编辑效率存在差异。在对得到的35 份转基因毛根样品的测序分析中,有4 份样品的GENE1-Target1 处发生编辑,有2 份样品的GENE2-Target1 处发生编辑,有12 份样品的GENE3-Target1 处发生编辑,3 个基因在靶点1 (Target1)处的编辑率分别为44.43%、5.71%和34.29%,3 个基因在靶点1 (Target1)处同时发生编辑的概率为5.71%。然而所有样品都未检测到在靶点2 (Target2)处发生基因编辑,分析其原因可能是因为样本量不够大,且在Target2 处编辑效率较低。
在PCR 扩增靶位点附近片段时,出现个别样品未扩增出片段的情况。因为CRISPR-Cas9 系统基因编辑后产生的突变情况较为复杂,导致PCR 反应不成功,这其中可能也有发生了基因编辑的样品,所以实际发生基因编辑的概率可能更高。
本研究针对蒺藜苜蓿DWF7基因,通过CRISPRCas9 系统,利用串联重复基因高度同源的特点,在3 个基因外显子中的同源区段设计靶位点,在毛根中实现了对3 个基因的同时编辑,证明了本研究设计的靶点可同时编辑3 个基因,为串联重复基因的功能研究提供了新的思路。通过稳定遗传转化获得的蒺藜苜蓿dwf7突变体植株是否具有拟南芥突变体的相似表型,以及DWF7串联重复基因在蒺藜苜蓿中的基因功能与拟南芥中的单基因是否保守,还有待进一步研究。

