棉铃虫V-ATPase亚基B是Cry1Ac的功能受体
段云鹏,姚 雪,李 品,王萌涵,胡守印,胡恩静,刘永刚,杨淑芳,魏纪珍
(河南农业大学植物保护学院/河南省害虫绿色防控国际联合实验室,郑州 450002)
转基因作物表达苏云金芽胞杆菌Bacillus thuringiensis(Bt)杀虫基因是迄今为止生物技术对农业害虫防治的最重要贡献。Bt作物已在29个国家广泛种植,全球面积超过1亿公顷,占全球转基因作物种植面积的53%[1]。尽管转Bt作物在全球得到了广泛的种植,但是有关Bt杀虫蛋白的作用机制和昆虫对Bt杀虫蛋白的抗性机制还没有被完全解析。更为严重的是,抗性问题日益突出,近年来报道的昆虫抗性和田间防治失败的案例也在持续增加[2-4]。Cry1Ac作为最重要的Bt杀虫基因之一,最先在作物中表达,用于防治棉铃虫等鳞翅目害虫。目前,第一代转Cry1Ac基因棉花已在我国种植了26年,尽管有“天然庇护所”的保护,田间棉铃虫种群对Cry1Ac的抗性也在显著增加[5-7]。因此,需要对Bt杀虫蛋白的作用机制和抗性机理进行更加深入的研究。
前期对Bt杀虫蛋白,尤其Cry1类蛋白受体和昆虫对Cry1类蛋白的抗性机制研究表明,其主要功能受体包括钙黏蛋白(cadherin)、碱性磷酸酶(alkaline phosphatase)、氨肽酶(aminopeptidases-N)、三磷酸腺苷结合盒转运蛋白C2(ATP binding cassette subfamily C member 2,ABCC2)和三磷酸腺苷结合盒转运蛋白 C3(ABCC3)等[8-12]。近些年来的研究通过双向电泳等方法也表明 V-ATPase亚基蛋白可以与Bt蛋白结合[13-15],而且V-ATPase参与Bt的作用过程[16],甚至改变V-ATPase的表达能够引起昆虫对Bt的耐性[17]。这说明V-ATPase亚基蛋白可能作为Bt的作用靶标正在逐步的被我们认识。
V-ATPase是一种在真核生物中进化古老的,高度保守的酶,存在于许多细胞器的膜中,如核内体、溶酶体和分泌囊泡,它们在这些细胞器的功能中发挥着各种重要作用[18]。它可以使细胞内的很多细胞器酸化,偶联ATP水解的能量,通过细胞内和真核细胞的质膜质子运输。这类酶的研究目前在其结构、功能、规律以及体外机制的阐述方面取得了巨大的进步,很多贡献归因于在昆虫中的研究[19]。在昆虫中V-ATPase是一种多亚基组成的膜结合复合酶体[15],是昆虫中肠上皮细胞 H+离子转运体[16]。大量的证据表明昆虫的V-ATPase在Cry蛋白毒性中发挥作用[13,15,20-23]。鉴于其分布和功能的多样化,以及与Bt的作用关系,迫切地需要发现和验证V-ATPase亚基蛋白在Bt的作用机制和抗性机制中的作用。
我们在前期的研究中通过构建棉铃虫的中肠酵母文库筛选 Cry1Ac的结合蛋白中发现,棉铃虫 VATPase B可以与Cry1Ac结合,这与邹朗云等[24]报道的V-ATPase B可以与Cry1Ac结合的结果一致。VATPase B作为Cry1Ac的结合蛋白是否参与Cry1Ac的毒力过程还没有得到证实。本研究首先采用实时荧光定量PCR技术分析该基因在抗感Cry1Ac棉铃虫幼虫及其受到Cry1Ac诱导时的表达情况;通过配体杂交 Ligand blot进一步地证实了其与 Cry1Ac的结合特性;通过在昆虫细胞中过表达该基因验证了其对Cry1Ac毒理的影响。本研究证实了V-ATPase B是Cry1Ac的功能受体,这为进一步研究V-ATPase B的Bt作用方式和在抗性机制中的作用,以及昆虫对Bt的抗性治理等提供重要线索。
1 材料与方法
1.1 材料
1.1.1 供试昆虫 敏感品系(JY)棉铃虫购于河南省济源白云实业公司,抗性品系(LF60)棉铃虫由中国农业科学院植物保护研究所馈赠,该品系对Cry1Ac的抗性高于1000倍[25],两种品系棉铃虫均在培养箱中使用人工饲料饲养,饲养条件为温度(26±1)℃、相对湿度(60±10)%、光周期16L∶8D。
1.1.2 细胞系及细胞培养基 草地贪夜蛾Spodoptera frugiperda卵母细胞系(Sf9)为美国亚利桑那大学馈赠,培养在(28±1)℃的培养箱中[26]。Sf-900TMⅡ SFM培养基,含10%热激失活牛血清、50 U/mL青霉素和50 μg/mL链霉素,购自赛默飞世尔科技(中国)有限公司。
1.1.3 试剂与仪器 Cry1Ac原毒素与活化毒素均购于北京绽诺思特生物科技有限公司;RNA提取试剂盒、反转录试剂盒HiScript®RT SuperMix for qPCRⅢ(+gDNA wiper)、DNA聚合酶(2×Taq Master Mix)、PCR产物回收试剂盒(FastPure Gel DNA Extraction Mini Kit)、荧光定量PCR反应试剂盒(ChamQTM Universal SYBR®qPCR Master Mix)、质粒DNA小量提取试剂盒,购于南京诺唯赞生物科技股份有限公司;大肠杆菌Escherichia coli感受态细胞DH5α,购于北京擎科生物有限公司;大肠杆菌Rosetta(DE3)感受态细胞,购于北京庄盟国际生物基因科技有限公司;氨苄青霉素、台盼蓝染色液、20×PBS缓冲液、高效RIPA裂解液(含一支PMSF)、PAGE胶蛋白微量回收试剂盒、牛血清白蛋白V(BSA)、5×蛋白上样缓冲液,购于北京索莱宝科技有限公司;限制性内切酶EcoRⅠ、XhoⅠ、SacⅠ、BagⅡ酶,购于宝日医生物技术(北京)有限公司;超敏型ECL发光液,购于亚科因(武汉)生物技术有限公司;蛋白电泳凝胶制备试剂盒,购于陕西中晖赫彩生物医药科技有限公司;转染试剂,购于普洛麦格(北京)生物技术有限公司;鼠抗His-Tag单克隆抗体、HRP标记的羊抗兔IgG抗体,购于亚科因(武汉)生物技术有限公司;His标签的pIEx-RFP载体由山东大学馈赠;增强绿色荧光蛋白EGFP,其序列参考[27]方法设计合成并由本实验室保存;其他化学试剂均为国产分析纯。NANODROP 1000全波长微量扫描分光光度计,赛默飞世尔科技(中国)有限公司生产;Tanon 4600化学发光成像分析系统,上海天能科技有限公司生产;DYY-3C电泳仪,北京六一仪器厂生产;SHP-250生化培养箱,上海精宏实验设备有限公司生产;Mastercycle Pro S型PCR仪,Centrifuge5417R型台式离心机,德国Eppendorf公司生产;ABI 7500 Fast实时荧光定量PCR仪,美国ABI公司生产。
1.2 样品制备和cDNA合成
分别选取龄期及大小一致的敏感与抗性棉铃虫,收集3~5龄幼虫各5~10头,比较其不同发育时期不同品系中肠V-ATPase B的表达量。选取大小一致的4龄末期棉铃虫,独立置于24孔养虫盒中饥饿处理12 h后,饲喂含50 mmol/L Na2CO3缓冲液的人工饲料[27]作为对照组,同时饲喂含25 μg/mL Cry1Ac原毒素(LC30)[26]的人工饲料,在样品取食3、6、12、24和36 h时,每个重复取4~5头样品,解剖取其中肠,共3个生物学重复,Cry1Ac诱导后,比较不同时间点V-ATPase B基因的表达量。
利用RNA提取试剂盒在冰上分别提取各处理样品总RNA,使用DEPC水调整浓度并使用反转录试剂盒合成cDNA模板用于后续试验。
1.3 载体构建
以棉铃虫cDNA为模板,利用特异性引物V-ATPase B-CDS-F/R(表1)对V-ATPase B基因编码区(sequence coding for aminoacids in protein,CDS)(登录号:XM_021331943.1)扩增,本试验中所有引物均由北京擎科生物科技有限公司合成。50 μL PCR反应体系和扩增条件参考[27]。用1%琼脂糖凝胶电泳检测5 μL PCR产物,纯化产物并将片段连接至克隆载体。用热激法将5 μL重组产物转入DH5α大肠杆菌感受态细胞,经氨苄青霉素的抗性筛选,获得阳性重组子并进行菌落PCR验证。PCR扩增条件参考[27]。经1%琼脂糖凝胶电泳检测5 μL产物后,将阳性克隆菌液注入5 mL含氨苄青霉素的LB培养基,37 ℃、200 r/min振荡培养14 h,提取质粒并由北京擎科生物科技有限公司测序。
以克隆载体为模板,利用两对特异性引物 V-ATPase B-SacⅠ和 V-ATPase B-BagⅡ;V-ATPase BEcoRⅠ和V-ATPase B-XhoⅠ对V-ATPase B基因编码区扩增,50 μL PCR反应体系与扩增条件参考文献[27]。用5×Loading Buffer和1%琼脂糖凝胶电泳检测5 μL PCR产物,纯化产物并将片段分别连接至表达载体pIEx-RFP与pGEX-6P-1。用热激法将5 μL重组产物转入50 μL DH5α大肠杆菌感受态细胞,经氨苄青霉素的抗性筛选,获得阳性重组子并进行菌落PCR验证。PCR扩增条件同上。经1%琼脂糖凝胶电泳检测5 μL产物后,将阳性克隆菌液注入5 mL含氨苄青霉素的LB培养基,37 ℃、200 r/min振荡培养16 h,提取质粒并由北京擎科生物科技有限公司测序。
1.4 荧光定量RT-PCR反应
用特异性引物q-V-ATPase B-F/R对不同品系、不同龄期、不同处理后组织的V-ATP-B基因表达量检测,以EF-1α(U20129.1)和β-actin(HM629442.1)为内参基因设计内参引物 EF-1α-F/R和β-Actin-F/R(表1)。20 μL PCR反应体系与程序参考文献[27]。每组处理有3组生物学重复,每组生物学重复设置3组技术重复。用扩增效率和循环数的平均数计算所有基因的表达水平,采用2―△△Ct方法分析试验结果[28]。

表1 本研究所用引物信息Table 1 List of primers in this study
1.5 细胞转染和毒理测定
Sf9细胞系使用Sf-900TMⅡ SFM培养基进行培养。转染细胞并在转入24 h后观察转入pIEx-RFP和V-ATPase B-pIEx-RFP细胞并拍照[27]。转染48 h后收集细胞并用细胞计数板计数,使用96孔细胞培养板每孔接种100 μL(含1×104个细胞),置于(28±1)℃培养箱中贴壁生长2 h;在倒置显微镜200倍视野下,每孔选择两个独立视野,记录Cry1Ac活化毒素处理前的细胞存活数量。去除含抗生素和血清的培养基,加入100 μL含有200 μg/mL Cry1Ac活化毒素且无血清及抗生素的细胞培养基,置于(28±1)℃培养箱中处理5 h;记录存活细胞数[27],收集剩余细胞用于后续试验。每次毒理测定重复3次,每组独立重复转染3次。死亡率的计算采用Abbott公式,死亡率=(处理前细胞数目―处理后细胞数目)/处理前细胞数目×100%[29]。
1.6 V-ATPase B蛋白的提取与Western-blot鉴定
将转染后的细胞收集并500 g/min离心3 min,用1 mL 1×PBS缓冲液清洗沉淀两次,再次离心保留沉淀,加入高效RIPA裂解液100 μL、终浓度为1 mmol/L PMSF、5×蛋白上样缓冲液25 μL并混匀,沸煮5 min,-20 ℃保存备用。
根据蛋白电泳凝胶制备试剂盒说明书配置SDS-PAGE胶,并通过凝胶电泳检测目的蛋白的表达。将目的蛋白转到硝酸纤维素膜上,用5%脱脂奶粉4 ℃封闭过夜;加入1∶2000稀释的His标签小鼠单克隆抗体(一抗),室温孵育1 h;1×PBST缓冲液洗脱5次,加入1∶10000稀释的HRP标记的羊抗鼠IgG抗体(二抗),室温孵育1 h;1×PBST缓冲液洗脱5次,使用化学发光成像分析系统仪器拍照。
1.7 V-ATPase B蛋白的诱导、纯化与Ligand-blot验证结合
将V-ATPase B-pGEX-6P-1质粒转化表达菌株Rosetta(DE3)。通过氨苄青霉素筛选后,挑取单菌落,用含氨苄青霉素的LB培养基扩大培养,当菌液OD600约为0.6时,取1 mL菌液加入终浓度30%的甘油保存,取400 μL诱导前菌液于4 ℃冰箱保存,剩余菌液加入终浓度为1 mmol/L的IPTG,37 ℃,180 r/min诱导4 h。取400 μL诱导后菌液,与诱前菌液6000 r/min离心3 min,弃上清用100 μL 1×PBS重悬,加入25 μL蛋白上样缓冲液,沸煮5 min后于冰上备用。
根据蛋白电泳凝胶制备试剂盒说明书配置 SDS-Page胶,并通过凝胶电泳检测目的蛋白的表达。蛋白胶脱色后,使用胶回收试剂盒,回收纯化蛋白,置于-20 ℃备用。
用纯化后的蛋白加入终体积0.25倍的蛋白上样缓冲液,沸煮5 min,同上配置SDS-Page胶,并通过凝胶电泳展现目的蛋白。将目的蛋白转到硝酸纤维素膜上,用5%脱脂奶粉4 ℃封闭过夜;加入终浓度2 μg/mL Cry1Ac活化毒素,孵育2 h,1×PBST缓冲液洗脱5次,加入1∶10000稀释的Cry1A抗体(一抗),室温孵育1 h;1×PBST缓冲液洗脱5次,加入1∶10000稀释的HRP标记的羊抗兔IgG抗体(二抗),室温孵育1 h;1×PBST缓冲液洗脱5次,使用化学发光成像分析系统仪器拍照。
1.8 数据统计与分析
数据使用Excel 2019软件进行统计分析,不同处理间的比较采用单因素方差分析,采用t检验法进行差异显著性检验。
2 结果与分析
2.1 V-ATPase B基因在Cry1Ac抗感棉铃虫品系中的表达差异
荧光定量PCR检测结果表明,V-ATPase B基因在3、4、5龄棉铃虫各龄期中肠均有表达,并且其在敏感品系JY的表达量均显著高于同龄期抗性品系LF60中的表达量(3龄中P=0.00001,4龄中P=0.02045,5龄中P=0.00531,图1)。

图1 V-ATPase B基因在抗感Cry1Ac棉铃虫中表达差异Fig.1 The expression level of V-ATPase B in Cry1Ac-susceptible and -resistance Helicoverpa amigera
2.2 V-ATPase B基因响应Cry1Ac刺激下调表达
棉铃虫5龄幼虫取食含有亚致死剂量25 μg/mL的Cry1Ac原毒素后,中肠组织中V-ATPase B基因表达量显著降低。从取食3 h后一直到36 h,棉铃虫中肠中V-ATPase B表达量持续显著下降(3 h时P=0.00480,6 h时P=0.00002,12 h时P=0.00013,24 h时P=0.00003,36 h时P=0.00001,图2)。
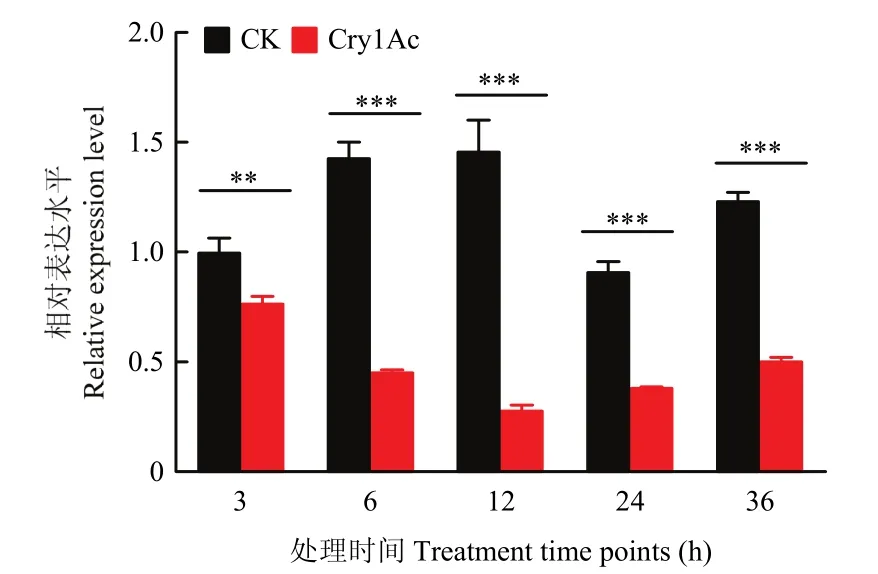
图2 5龄棉铃虫幼虫取食Cry1Ac后的V-ATPase B基因表达量Fig.2 The expression level of V-ATPase B of the 5th-instar Helicoverpa amigera larvae fed with Cry1Ac
2.3 Ligand blot验证V-ATPase B与Cry1Ac结合
通过原核表达V-ATPase B蛋白,经SDS-PAGE梯度胶电泳检测,V-ATPase B蛋白在80.8 kDa处表达(基因54.9 kDa+标签蛋白25.9 kDa),结果表明V-ATPase B被成功诱导表达(图3A)。进一步地对原核表达的V-ATPase B蛋白进行纯化,基本得到一条明显单一的V-ATPase B蛋白(图3B)。然后通过Ligand blot试验证实显示V-ATPase B可以与Cry1Ac活化毒素特异结合(图3C)。说明V-ATPase B可能为Cry1Ac活化毒素受体结合蛋白。

图3 V-ATPase B蛋白的表达纯化及与Cry1Ac的结合特性Fig.3 Expression and purification of V-ATPase B protein and its binding properties with Cry1Ac
2.4 V-ATPase B的亚细胞定位
将V-ATPase B-pIEx-RFP和pIEx-RFP质粒分别转染Sf9细胞。荧光显微镜下观察到红色荧光,说明相应蛋白已成功表达于细胞中,V-ATPase B蛋白主要定位在细胞质中,在细胞核中没有表达(图4)。
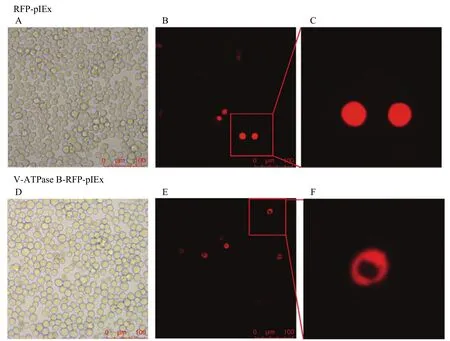
图4 V-ATPase B在细胞内的表达和定位Fig.4 The expressions and localization of V-ATPase B in cells
2.5 表达V-ATPase B蛋白增强了Cry1Ac的细胞毒力
在观察到V-ATPase B蛋白的表达后,进一步通过Western blot确定了V-ATPase B蛋白在细胞内的表达(图5A)。随后,用终浓度为 200 μg/mL Cry1Ac活化毒素处理细胞,Sf9细胞的死亡率显著提高(P=0.03233,图5B)。结果表明,过表达V-ATPase B可以增加细胞对Cry1Ac的敏感性。
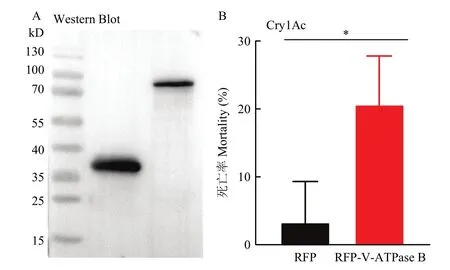
图5 表达V-ATPase B对Sf9细胞毒性的影响Fig.5 Effects of overexpression of V-ATPase B on the cytotoxicity in Sf9 cells
3 讨论
本研究中我们发现V-ATPase B基因在Cry1Ac抗性品系中低表达(图1),尽管本研究中是用LF60的抗性品系跟济源购买的敏感品系(据了解近些年采于田间)相比的,但是V-ATPase B基因在室内筛选的BtR抗性品系中也显著降低表达[24],这进一步说明了V-ATPase B基因在抗性品系中低表达是普遍存在的。此外在受到Cry1Ac诱导时,V-ATPase B基因也下调表达,这跟很多V-ATPase B基因在受到Bt诱导时低表达的结果一致[30-32]。因此V-ATPase B基因可能作为功能受体参与棉铃虫对Cry1Ac的抗性,机体通过降低V-ATPase B基因的表达来减少Cry1Ac对昆虫的伤害。
V-ATPase B作为Bt的结合蛋白已经被广泛报道,例如Qiu等[16]报道甜菜夜蛾Spodoptera exigua的V-ATPase B可以与Cry2Aa结合;Xie等[33]报道小菜蛾Plutella xylostella的V-ATPase B和Cry1Ac具有结合特性。邹朗云等[24]也通过Ligand blot证实棉铃虫的V-ATPase B可以与Cry1Ac、Cry2Ab和Cry1C结合。我们通过构建棉铃虫的中肠酵母文库筛选Cry1Ac的结合蛋白,也筛选到了结合蛋白V-ATPase B(未发表数据),在本研究中也进一步地通过Ligand blot证实棉铃虫V-ATPase B可以与Cry1Ac结合(图3)。上述研究多方证实了V-ATPase B是Cry1Ac的结合蛋白。然而,我们对V-ATPase B的亚细胞定位研究表明其主要分布在细胞质中(图4),这与其他研究报道V-ATPase B基因主要存在于细胞内许多细胞器的膜中的结果一致[18]。但是已报道的Bt蛋白的受体多位于细胞膜上,我们分析尽管V-ATPase B在胞内分布却能与Bt蛋白结合的原因,可能与之前我们推测的ATPs-α与Cry2Ab蛋白互作的方式一样[27]。一方面据报道Cry1Ac的部分结构可以插入膜内[35],这些结构可能与膜内的受体,如V-ATPase B结合。此外,整个活化的Cry蛋白可以透过细胞膜进入细胞质[36,37],进而与细胞质内分布的V-ATPase B结合。总之,综合文献和我们的研究结果表明棉铃虫V-ATPase B是Cry1Ac的一个结合蛋白。
V-ATPase B蛋白不但是Bt杀虫蛋白的结合蛋白,它也参与Bt的毒力过程。Qiu等[16]报道了甜菜夜蛾的V-ATPase B不仅与Cry2Aa结合,而且通过RNAi干扰V-ATPase B能显著降低甜菜夜蛾对Cry2Aa的敏感度。此外,敲除二化螟Chilo suppressalis幼虫的V-ATPase A基因导致二化螟幼虫对表达Cry2Aa和Cry1Ca水稻的敏感性显著降低[38]。本研究中,我们通过在昆虫细胞系中过表达棉铃虫V-ATPase B基因,发现细胞对Cry1Ac的敏感度增强(图5),这一结果证实棉铃虫V-ATPase B参与了Cry1Ac的毒力过程。这是我们首次报道V-ATPase B在Cry1Ac毒力过程的功能。由于V-ATPase B基因在抗性品系中低表达,同时V-ATPase B蛋白与Cry1Ac结合,我们推测棉铃虫V-ATPase B是Cry1Ac的功能受体。但是关于V-ATPase B在棉铃虫对Cry1Ac的抗性机制中的作用和贡献还有待进一步的研究。

