饲喂法RNAi介导的HvCHS1基因沉默抑制茄二十八星瓢虫的存活和发育
骆旭铭,陈诗敏,潘 广,杨春晓,潘慧鹏*
(1.华南农业大学植物保护学院/广东省生物农药创制与应用重点实验室,广州 510642;2.广州国家现代农业产业科技创新中心,广州 510520;3.华南农业大学亚热带农业生物资源保护与利用国家重点实验室,广州 510642)
茄二十八星瓢虫Henosepilachna vigintioctopunctata(Fabricius)隶属鞘翅目 Coleoptera瓢虫科Coccinellidae,是一种在亚洲国家广泛分布的农业害虫,主要对茄科植物造成为害,尤其是茄子、马铃薯等蔬菜作物[1]。该害虫在我国及其他亚洲国家分布广泛且为害严重[2]。目前,茄二十八星瓢虫的防治主要是以化学防治为主,然而,在我国农作物生产要求农药负增长的背景下,人们迫切需要寻找一种新的、有效的害虫防治方法来应对茄二十八星瓢虫的为害。
RNA干扰(RNA reference,RNAi)作为一种转录后基因沉默现象,是通过导入体外合成的与内源靶基因同源的双链RNA(dsRNA)或 siRNA到生物体内,使其同源mRNA降解,从而引发靶标基因的沉默[3]。目前,RNA干扰被证实为研究基因功能的有效工具,为开发具有靶标特异性、环境友好型的害虫防治新方法提供了新思路[4]。基于RNAi的生物农药预计将以植物表达RNAi产品(植物嵌入式杀虫剂,PIPs)和非PIP产品(可喷洒、茎注射、灌根和种子处理等)的形式进入市场[5]。近十年,RNAi在害虫综合治理中的潜在应用得到了广泛的研究[6-8]。
几丁质是仅次于纤维素的第二大天然多糖,广泛分布于真菌、线虫和节肢动物中[9]。几丁质主要存在于昆虫表皮层中的上表皮以及消化道的围食膜基质中,这种多糖与硬化蛋白结合组成复合体,在增强昆虫的外骨骼结构以及保护昆虫免受环境压力和致病菌感染方面起着关键作用[10]。然而,这种坚硬的外表也限制了昆虫的生长发育。为了避免这种情况,昆虫周期性地降解旧的角质层,生成新的角质层,完成生长发育过程。因此,昆虫的生长发育受到几丁质合成与降解平衡的影响,昆虫的生长和变态发育都依赖于几丁质结构的可塑性[11]。
Cohen等[12]总结提出了从海藻糖到几丁质的合成途径由多种酶催化完成,其中几丁质合成酶(chitin synthase,CHS)在合成的最后一步中起着关键作用。CHS基因的cDNA已被广泛克隆,并在不同昆虫中进行了鉴定[13-15]。经序列分析发现,昆虫物种中只存在两种CHS,分别是CHS1和CHS2,也被称为CHS-A和CHS-B[16,17]。其中CHS1主要在表皮层以及气管等相关的外胚层细胞中表达,CHS2多在肠道上皮细胞中特异表达,并具有参与构成围食膜的功能[11,18]。
因此,本研究选取了茄二十八星瓢虫作为研究对象,对从茄二十八星瓢虫基因组获得的HvCHS1序列进行分析;测定并阐明了HvCHS1在茄二十八星瓢虫生长发育过程中的时空表达模式;使用饲喂法RNAi,探究了沉默该基因对茄二十八星瓢虫中HvCHS1基因表达、存活和生长发育以及表皮形成的影响,以丰富昆虫学领域关于CHS的研究内容,为实现基于HvCHS1的饲喂法RNAi的茄二十八星瓢虫的生物防治奠定基础。
1 材料与方法
1.1 供试昆虫
茄二十八星瓢虫于2018年5月在广州华南农业大学校园内的龙葵上采集[8]。饲养茄二十八星瓢虫的茄子品种为万盛元帅圆茄苗,将瓢虫放在放有滤纸的培养皿中,滤纸用棉球保湿,置于人工气候箱(温度25 ℃±1 ℃,相对湿度70%±80%,光周期14L∶10D)。
1.2 分析HvCHS1在茄二十八星瓢虫中表达样品的制备
收集茄二十八星瓢虫不同发育阶段样品(卵20粒、1~4龄幼虫各3头、蛹2头、雌雄成虫各1头),分别从5头4龄幼虫中收集不同组织样品(中肠、马氏管、脂肪体、表皮)。每个样本分别收集3个生物学重复,用液氮快速冷冻,并在RNA的提取前于-80 ℃保存。
1.3 总RNA提取和第一链cDNA的合成
茄二十八星瓢虫不同发育阶段和不同组织的样品均使用TRIzol法进行RNA提取。所有样品的RNA使用10~100 μL的RNA-free水洗脱,并使用仪器NanoDrop OneC分光光度计(Thermo Fisher Scientific,Waltham,MA,United States)测定RNA浓度,所有样本RNA的OD260/OD230在1.8~2.2。使用试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)(Takara,China),根据说明书进行操作,1.0 μg的总RNA中反转录合成cDNA,cDNA稀释10倍后用于后续的PCR、RT-qPCR和dsRNA的合成试验中。
1.4 HvCHS1序列生物信息学分析
从茄二十八星瓢虫基因组数据中获得茄二十八星瓢虫几丁质合成酶HvCHS1基因序列(GenBank登录号:OK563729),利用OFR Finder(https://www.ncbi.nlm.nih.gov/orffinder/)预测HvCHS1的开放阅读框;利用 ExPASy translate tool(https://web.expasy.org/translate/)预测HvCHS1的氨基酸序列,利用 ExPASy ProtParam(https: //web.expasy.org/protparam/)工具预测蛋白质的理化性质,登陆NCBI网站(https://www.ncbi.nlm.nih.gov/),通过blastn程序比对,获得相似序列。利用Geneious 7.0(https://www.geneious.com/)对氨基酸序列进行剪切比对,并在MEGA 7.0中采用邻接法(neighbor-joining,NJ)构建系统发育树。
1.5 HvCHS1基因在茄二十八星瓢虫的时空表达模式测定
根据1.4中获得的序列设计HvCHS1特异性定量引物(表1),并选取RPS18和RPL13作为内参基因[19],进行相对定量 RT-qPCR分析,基因的相对表达量采用 2―△△Ct法(Ct表示循环数)进行计算[20]。RT-qPCR反应程序参考本课题组已发表的论文[19]。
1.6 dsRNA的体外合成
根据1.4中获得的茄二十八星瓢虫HvCHS1序列,并以绿色荧光蛋白基因GFP序列作为阴性对照,利用E-RNAi网站(https://www.dkfz.de/signaling/e-rnai3//)设计HvCHS1和GFP[8]特异性dsRNA引物(表1)。PCR反应体系及程序参照Pan等[21]发表的论文。利用DNA纯化回收试剂盒(Universal DNA Purification Kit,TIANGEN,China)回收上述得到的两种PCR产物,作为体外合成dsRNA的模版。使用MEGAscriptTMT7试剂盒(Thermo Fisher Scientific,USA),根据说明书步骤来合成dsRNA。合成的dsRNA溶解于ddH2O中,使用NanoDrop OneC分光光度计(Thermo Fisher Scientific,USA)进行浓度测定。此外,使用1.5%的琼脂糖凝胶电泳检测dsRNA的质量。
Based on heat-deficiency model, 40 healthy male SD rats, SPF grade, were housed for a week in an air-conditioned room (temperature, 22 ºC; relative humidity, 55%) and were randomly divided into 4 groups (n = 10 per group): blank, model, ZM, and WDF (water decoction of Poria) groups.
1.7 饲喂体外合成dsHvCHS1对茄二十八星瓢虫的影响
所有试验均在温度25 ℃±1 ℃,湿度70%~80%,光周期14L∶10D的人工气候箱中进行。
为探究 dsHvCHS1对幼虫发育的潜在影响,我们挑取同一日龄的 1龄初幼虫用于生测试验。其中dsHvCHS1处理组和dsGFP对照组各设置5个重复,每个重复10头1龄幼虫,于滤纸和加湿棉球的培养皿中饲养,分别用浓度为50 ng/µL、250 ng/µL和500 ng/µL的 dsHvCHS1溶液浸泡直径为12 mm的圆形茄子叶片1 min,风干后饲喂幼虫,每隔24 h更换一次叶片,饲喂dsHvCHS1浸泡的叶片两天后,用未经处理的茄子叶片饲喂幼虫。对照组采用500 ng/µL的dsGFP溶液饲喂,处理方法同处理组。试验开始后,每天2次记录幼虫死亡率和发育阶段,连续记录10天。
为探究dsHvCHS1对幼虫化蛹的影响,我们挑取同一日龄的4龄初幼虫用于生测试验。在50、100和200 ng/μL浓度的dsHvCHS1处理下,观察其表型表达。以200 ng/μL dsGFP作为对照。新蜕皮的4龄幼虫饥饿处理6 h后,每头幼虫饲喂1 μL dsHvCHS1或dsGFP液滴,幼虫以dsRNA液滴为食后,再用未处理的新鲜叶片为食。每个dsRNA浓度下共观察30只4龄幼虫,每天记录死亡率直到化蛹。
为了探究饲喂dsHvCHS1对茄二十八星瓢虫幼虫HvCHS1基因表达的影响,从饲喂dsRNA开始的第2 d和第4 d,分别收集饲喂50 ng/µL dsHvCHS1和dsGFP的1龄幼虫,每个时间点收集3个生物学重复,每个重复收集3头茄二十八星瓢虫幼虫,用液氮速冻后储存在-80 ℃中,然后提取总RNA并反转录成cDNA,用于分析HvCHS1基因表达的变化。提取总RNA和cDNA合成方法同1.3。稀释10倍的cDNA作为荧光定量PCR的模版。RT-qPCR分析方法同1.5。
1.8 dsRNA的菌液表达合成
选择带有双T7启动子的L4440载体作为菌液表达dsRNA的载体,表1列出了用于构建表达dsHvCHS1和dsGFP的特异性引物,目的片段扩增的PCR程序参考1.4。在L4440载体上选择BamHI和SacI作为酶切位点,用限制性内切酶QuickCut™SacI和QuickCut™BamHI(TaKaRa)酶切L4440载体,利用通用DNA纯化试剂盒(Universal DNA Purification Kit,TIANGEN,China)对PCR产物和线性化的L4440载体进行纯化。然后,纯化后的L4440载体通过使用重组酶,使之与目的片段重组,将含有目的片段的重组载体转化到具有IPTG诱导T7聚合酶活性的RNaseⅢ缺陷型大肠杆菌HT115(DE3)细胞中。在LB琼脂平板上培养后,将含有目的片段的单菌落接种到含有Tet(10 μg/mL)和Amp(100 μg/mL)的4 mL LB液体培养基中,以210 r/min,37 ℃培养12~14 h。将500 μL菌液转移至含有Amp(100 μg/mL)和Tet(10 μg/mL)的50 mL LB液体培养基中,将菌液稀释100倍扩大培养,培养至菌液的OD值在0.5~0.8之间。然后,将IPTG添加至菌液中使其终浓度为1 mmol/L,并在37 ℃,120 r/min下振荡培养5 h诱导dsRNA。为了检测在HT115(DE3)细胞中是否诱导出dsRNA,以5000 r/min离心10 min收集菌丝,使用HiPure总RNA微型试剂盒(Magen)从菌丝中提取总RNA,用TURBO-DNase(Thermo-Fisher-Scientific,USA)处理RNA以去除DNA。并使用由GoldViewⅠ染色的1.5%琼脂糖凝胶来检测dsRNA条带。100 mL表达dsRNA的菌液以5000 r/min离心10 min收集菌丝,用10 mL无菌水悬浮菌丝,进行饲喂法RNAi试验。

表1 本研究所用的引物Table 1 Primers used in this study
1.9 饲喂菌液表达合成dsHvCHS1对茄二十八星瓢虫存活的影响
试验中所使用的1龄、3龄幼虫和成虫在经过饥饿处理3 h以上后,分龄期放入放有湿润滤纸和棉球的培养皿中,每个龄期设置5个生物学重复,每个生物学重复含有10头昆虫。将直径为12 mm的圆形茄子叶片浸入菌液表达的dsRNA溶液中1 min,然后将叶片放在滤纸上风干后饲喂,每个重复的1龄幼虫饲喂2片dsRNA处理的叶片,3龄和成虫饲喂20片。每隔24 h更换一次叶片,在饲喂dsRNA浸泡的叶片2 d后,用未经处理的新鲜茄子叶片饲喂。在此过程中,培养皿置于人工气候箱中。每隔24 h统计每个培养皿中茄二十八星瓢虫的死亡数目,并计算对照和不同处理条件下茄二十八星的存活率的差异。使用菌液表达合成的dsRNA分别处理茄二十八星瓢虫1龄、3龄幼虫和成虫,处理的1龄和3龄幼虫持续观察10 d,成虫持续观察了14 d。
1.10 苏木精&伊红(H&E)染色
为了进一步观察dsHvCHS1干扰后对茄二十八星瓢虫4龄幼虫蜕皮的影响,4龄初幼虫在饲喂了200 ng的dsRNAs(dsHvCHS1和dsGFP)后,我们对进入预蛹期的4龄幼虫腹部表皮进行解剖取样,解剖获得的腹部表皮使用4%戊二醛溶液固定后,进行石蜡包埋,将4 μm石蜡切片粘在玻片上,进行H&E染色[22],使用Pannoramic扫描仪(P250,3D HISTECH,Hungary)对玻片进行扫描,并利用Caseviewer C.V 2.3软件查看玻片。
1.11 数据统计与分析
2 结果与分析
2.1 茄二十八星瓢虫HvCHS1基因的序列分析
从茄二十八星瓢虫基因组数据中获得几丁质合成酶1(HvCHS1)基因序列,预测开放阅读框ORF长4680 bp,编码1559个氨基酸残基,蛋白质的相对分子量为177.5 kDa,分子式为C8062H12574N2096O2284S67,理论等电点(pl)为6.97,包含177个带负电荷的氨基酸(Asp+Glu)和174个带正电荷的氨基酸(Arg+Lys),是一种中性蛋白,半衰期为30 h,不稳定系数为45.27,总平均亲水系数为-0.091,为亲水性蛋白。对茄二十八星瓢虫CHS1与部分昆虫CHS1氨基酸序列进行比对,相似度都达到65%以上,表明CHS1在物种进化中具有较高保守性(图 1)。基于氨基酸序列邻接法建立的系统发育树,结果表明,茄二十八星瓢虫HvCHS1与鞘翅目赤拟谷盗Tribolium castaneum的CHS1亲缘关系最近(83.88%)(图2)。
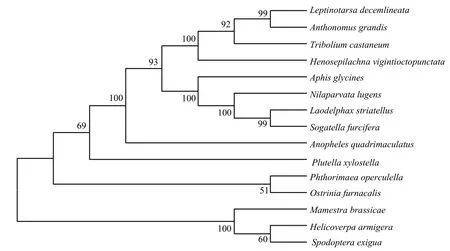
图2 昆虫CHS1氨基酸序列进化树分析(邻接法)Fig.2 Phylogenetic tree analysis of insect CHS1 amino acid sequences (neighbor-joining, NJ)
2.2 HvCHS1基因的时空表达模式
RT-qPCR结果表明,HvCHS1在不同发育阶段的表达量(F7,16=16.195,P<0.0001)和不同组织中的表达量(F3,8=27.196,P<0.0001)均存在差异,其中表达量最高出现在1龄,最低在雌虫阶段(图3A)。不同组织中,HvCHS1在表皮中的表达量明显高于中肠、脂肪体和马氏管(图3B)。

图3 HvCHS1基因在茄二十八星瓢虫不同发育阶段(A)和不同组织(B)的表达模式Fig.3 Expression profiles of HvCHS1 across developmental stages (A) and among different tissues (B) in H.vigintioctopunctata
2.3 饲喂体外合成dsHvCHS1对茄二十八星瓢虫幼虫存活率和生长发育的影响
使用不同浓度的体外合成的dsRNA处理茄二十八星瓢虫1龄幼虫,并持续观察10 d。结果发现与dsGFP对照组相比,dsHvCHS1处理组的死亡率明显升高。在dsHvCHS1处理组中,dsRNA浓度越高,茄二十八星瓢虫的存活率越低。与对照组相比,50 ng/µL dsHvCHS1处理的致死率为42.00%(P=0.0001,Exp (B)=5.542),250 ng/µL dsHvCHS1处理的致死率为 82.00%(P<0.0001,Exp (B)=12.909),而 500 ng/µL dsHvCHS1处理的致死率最高,为94.00%(P<0.0001,Exp (B)=19.369)。与对照组相比,dsHvCHS1处理组幼虫的生长发育受到明显抑制,当dsGFP对照组正常进入2龄后,取食了dsHvCHS1的幼虫仍处于1龄状态且大部分不能完成蜕皮,最终死亡(图4)。

图4 饲喂dsHvCHS1对茄二十八星瓢虫1龄幼虫存活率(A)和发育(B)的影响Fig.4 The effects of ingestion of dsHvCHS1 on the survival rate (A) and development (B) of 1st instar larvae of H.vigintioctopunctata
为了探究dsHvCHS1对茄二十八星瓢虫幼虫化蛹的影响,我们使用不同浓度的dsRNA处理4龄初幼虫。结果显示,dsGFP对照组在7 d后正常化蛹,而dsHvCHS1处理组的个体出现化蛹异常或发育停止在预蛹期。与对照组相比,50、100和500 ng剂量处理下的幼虫,化蛹率分别为68.52%、34.07%和17.04%。这些异常的蛹颜色逐渐加深、干瘪,最终死亡(图5)。
对预蛹期幼虫的腹部表皮进行H&E染色分析发现,dsGFP对照组进入预蛹期后,旧表皮开始从皮细胞层分离的同时,新表皮开始形成。相反,dsHvCHS1处理组结果显示,旧表皮与皮细胞层分离,但新表皮无法形成,最终导致蜕皮失败(图5)。
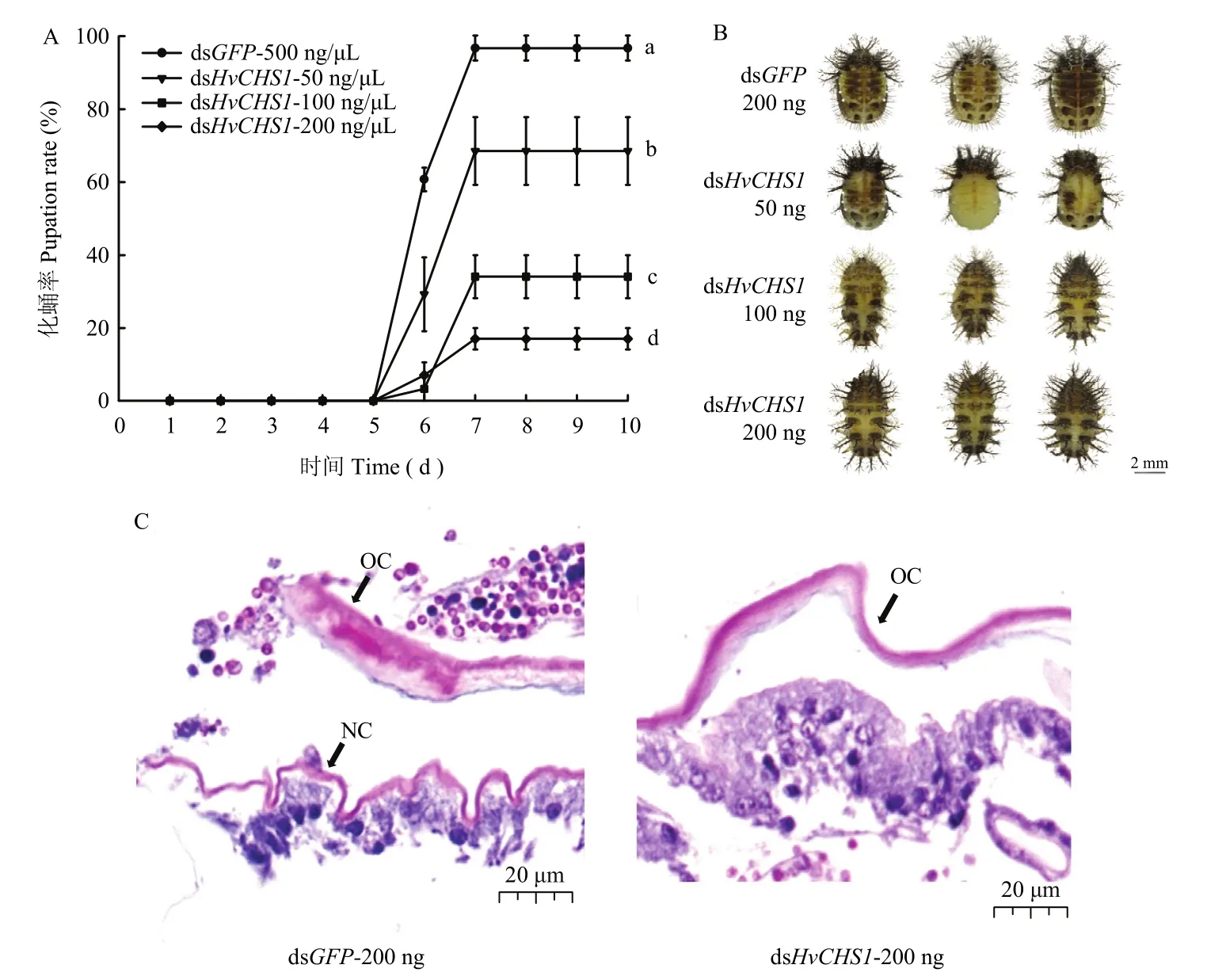
图5 饲喂dsHvCHS1对茄二十八星瓢虫化蛹的影响Fig.5 The effects of dsHvCHS1 on the pupation of H.vigintioctopunctata
2.4 饲喂体外合成dsHvCHS1对茄二十八星瓢虫HvCHS1基因表达的影响
结果表明,1龄幼虫在dsHvCHS1处理下,HvCHS1的相对表达量在第4 d被显著抑制,与对照组相比,显著下降了2.83倍(F1,4=222.698,P<0.0001),而在第2 d的表达量与dsGFP对照组相比没有显著变化(F1,4=0.901,P=0.396)(图6)。
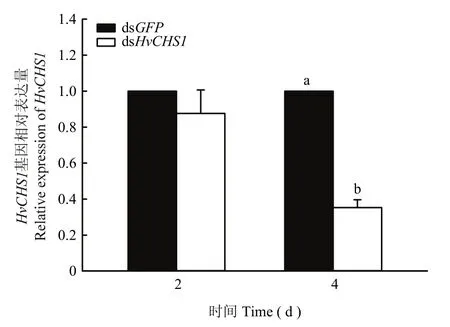
图6 饲喂dsHvCHS1对茄二十八星瓢虫1龄幼虫HvCHS1基因表达的影响Fig.6 The effects of ingestion of dsHvCHS1 on HvCHS1 expression in the 1st instar larvae of H.vigintioctopunctata
2.5 饲喂菌液表达合成dsHvCHS1对茄二十八星瓢虫存活率的影响
结果如图7所示,经菌液表达dsHvCHS1处理后的1龄及3龄幼虫均在第3 d开始出现死亡,而菌液表达dsHvCHS1对成虫的存活率无影响。10 d后,1龄幼虫存活率达36.00%(P<0.0001,Exp (B)=8.967),3龄幼虫存活率达40.00%(P<0.0001,Exp (B)=7.827)。

图7 菌液表达合成dsHvCHS1对茄二十八星瓢虫1龄(A)、3龄(B)幼虫和成虫(C)存活率影响Fig.7 The effects of bacterially expressed dsHvCHS1 on the survival rate of 1st (A), 3rd (B) instar larvae and adults (C) of H.vigintioctopunctata
3 讨论
本研究揭示了饲喂法RNAi对茄二十八星瓢虫幼虫及成虫存活和发育的影响。HvCHS1基因的敲除降低了茄二十八星瓢虫的存活率,抑制了其变态发育,表明HvCHS1基因可以作为茄二十八星瓢虫生物防治的潜在靶标基因。
几丁质是昆虫上表皮和消化道围食膜的重要组成部分。HvCHS1在茄二十八星瓢虫的表皮中高度表达,在增强昆虫的外骨骼结构,保护昆虫免受环境胁迫和病原菌感染方面发挥着关键作用[10]。本研究中,表皮中HvCHS1基因高表达与先前的报道结果类似[23-27],表明CHS1的组织表达模式具有显著的组织特异性,且主要集中在表皮上。但前期研究结果表明,CHS1基因不同发育阶段的表达模式在不同昆虫中存在差异。Zhang等[23]发现东亚飞蝗Locusta migratoria manilensis的CHS1基因在卵期表达量最低,成虫期表达量最高;而在褐飞虱Nilaparvata lugens中,CHS1在若虫阶段表达量最高,成虫阶段表达量最低[28]。在本试验中,采用RT-qPCR方法对茄二十八星瓢虫不同发育阶段中HvCHS1的表达量进行了分析,虽然HvCHS1在茄二十八星瓢虫幼虫至成虫的生长发育的各个阶段都有表达,但是存在明显的发育阶段表达特异性,在1龄中表达量最高,在雌虫中表达量最低。茄二十八星瓢虫是完全变态的昆虫,它经历了卵、幼虫、蛹和成虫4个完整的生命阶段。因此,需要周期性的蜕皮,以保证外骨骼的扩张和个体的正常生长,在此过程中需要几丁质的不断积累,以形成新的外骨骼。且之前的研究已经表明CHS1对于赤拟谷盗T.castaneum的卵壳形成及卵孵化起至关重要的作用[29],而在棉铃象甲Anthonomus grandis和褐飞虱的研究中,经RNAi处理抑制CHS1表达的雌虫可以正常产卵,但显著降低了卵孵化率[30,31]。这些结果表明CHS1在卵巢发育、卵壳形成和卵孵化过程中起重要作用。
RNAi技术近二十年来被有效地用于研究害虫抗药性机制、昆虫变态发育的功能分析,以及通过饲喂法或注射法RNAi挖掘害虫致死基因等[5,8,32]。我们的研究表明,在饲喂了dsHvCHS1第4 d,HvCHS1基因表达量显著下降,并导致死亡率呈剂量效应。用50 ng/µL、250 ng/µL和500 ng/µL dsHvCHS1饲喂1龄幼虫的致死率分别为42.00%、82.00%和94.00%;用50 ng、100 ng和200 ng剂量饲喂4龄幼虫的化蛹率分别为68.52%、34.07%和17.04%。取食dsRNA的剂量越高,幼虫的死亡率越高。本研究发现,dsHvCHS1抑制了茄二十八星瓢虫的生长发育,大多数个体不能完成正常的蜕皮或出现异常的化蛹,最终导致死亡。表皮H&E染色分析表明,dsHvCHS1处理的幼虫出现旧的表皮细胞碎裂并与表皮细胞分离,但无法形成新表皮的现象,导致死亡。推测HvCHS1表达量的下降与几丁质合成的减少有关,导致新的角质层不能正常形成,使幼虫无法完成蜕皮或化蛹。在细菌中大量表达dsRNA是近年来建立起的一种高效、低成本的dsRNA生产方法。本研究提供的证据表明,饲喂菌液表达的dsHvCHS1可有效引起RNAi效应,从而导致较高的幼虫死亡率,1龄幼虫累计达到62%死亡率,3龄幼虫达到60%死亡率;对成虫的影响不大,推测可能是成虫期无需形成新的表皮。先前的研究中,陈静等[33]干扰SfCHS1基因表达后,显著降低了白背飞虱Sogatella furcifera的表达量和存活率;余志涛等[34]干扰OcCHS1基因表达,导致中华稻蝗Oxya chinensis蜕皮困难而死亡,少数存活的若虫腹部新表皮出现皱缩,无法正常羽化;注射 dsOfCHS1的亚洲玉米螟Ostrinia furnacalis幼虫出现畸形,表现为幼虫身体不能完全脱离旧表皮而死亡或新形成的表皮皱缩[35];用细菌表达的dsRNA干扰甜菜夜蛾Spodoptera exigua的CHSA基因后,幼虫出现蜕皮障碍呈现“双头”表型,即仅头部旧表皮开裂,其余身体被旧表皮包裹,无法形成新表皮[36]。此外,在柑橘全爪螨Panonychus citri,棉蚜Aphis gossypii,橘小实蝇Bactrocera dorsalis和东亚飞蝗L.manilensis中也有相似的研究结果[23,37-39]。这些研究证实CHS1对昆虫表皮的形成具有重要作用,沉默CHS1表达会影响昆虫的生长发育。
近几年,茄二十八星瓢虫已成为茄科蔬菜上的重要害虫。由于过量使用化学杀虫剂,导致害虫抗药性增强和环境污染日益严重。基于RNAi技术的害虫防控是一种新型的绿色害虫防控技术,具有广阔的应用前景。通过在作物中表达靶标基因的dsRNA实现对有害生物的控制,是更为高效的dsRNA递送策略。使用表达dsRNA的转基因玉米可以提高防治玉米根萤叶甲Diabrotica virgifera virgifera的效率和持久性[40],棉铃虫Helicoverpa armigera取食表达dsHaHR3的转基因棉花后,导致幼虫死亡率,畸蛹率和成虫畸形率增加[41]。此外,桃蚜Myzus persica和绿盲蝽Apolygus lucorumi在取食表达dsRNA的转基因植物后,靶标基因mRNA水平显著下调[42,43]。这些结果表明,在筛选出与害虫生长发育相关的靶标基因后,可以通过转基因植物表达dsRNA或者直接喷施dsRNA进行抑制目的基因的表达,从而达到防治害虫的目的。几丁质广泛存在于甲壳动物、昆虫和真菌中,但是在高等动物中并不存在,因此HvCHS1可以安全应用于茄二十八星瓢虫的生物防治中。
本研究在茄二十八星瓢虫中鉴定HvCHS1,通过饲喂法验证HvCHS1可以影响幼虫存活和发育,表明HvCHS1可以作为一个潜在的RNAi靶标基因,用于茄二十八星瓢虫生物防治。

