吴茱萸碱对视网膜母细胞瘤细胞增殖、凋亡、细胞周期的影响△
赵 静 杨洪涛 裴存文
视网膜母细胞瘤是儿童中最常见的原发性眼内恶性肿瘤[1]。据统计,在美国视网膜母细胞瘤患者生存率可达到95%,但在有些不发达国家其生存率仍低于5%[2]。吴茱萸碱是一种喹诺酮生物碱,已被用于治疗消化系统疾病[3]。据报道,吴茱萸碱可抑制SW480结肠癌细胞增殖和迁移,并可促进细胞凋亡且阻滞细胞周期[4]。吴茱萸碱能抑制卵巢癌SKOV3细胞、小细胞肺癌H446细胞和H1688细胞增殖,加速其凋亡,并阻滞肝癌HepG2细胞、H446细胞和H1688细胞周期[5-7]。然而,吴茱萸碱对视网膜母细胞瘤的作用目前并不清楚。长链非编码RNA(lncRNA)与肿瘤发生和发展关系密切,可参与肿瘤组织血管生成、增殖、免疫调节、转移等过程[8]。整合素β2-反义RNA1(ITGB2-AS1)位于21q22.3染色体上,在乳腺癌组织中高表达,可上调ITGB2-AS1表达,促进乳腺癌细胞转移和侵袭[9-10]。本研究探讨吴茱萸碱对视网膜母细胞瘤细胞增殖、凋亡和细胞周期的影响,分析ITGB2-AS1在视网膜母细胞瘤中的表达和作用。
1 材料与方法
1.1 实验材料和主要仪器细胞HXO-Rb44购自美国ATCC公司,吴茱萸碱(纯度≥98%)购自美国Sigma-Aldrich公司,RMPI 1640培养基、胎牛血清、Lipofectamine 2000购自美国Thermo Fisher Scientific公司,si-NC、si-ITGB2-AS1、pcDNA、pcDNA-ITGB2-AS1购自上海GenePharma公司,Trizol试剂购自美国Invitrogen公司,SYBR-Green PCR Master Mix试剂盒购自大连TaKaRa公司,溴化噻唑蓝四氮唑(MTT)、结晶紫染料、膜联蛋白-V(Annexin-V)-FITC凋亡检测试剂盒、细胞周期检测试剂盒、碘化丙啶(PI)购自上海Beyotime公司。Varioskan LUX多功能酶标仪、Applied Biosystems PCR热循环仪购自美国Thermo Fisher公司,FACSCalibur流式细胞仪购自美国BD公司。
1.2 方法
1.2.1 细胞培养和分组取吴茱萸碱以0.2 mol·L-1的浓度溶于二甲基亚砜中,制成储备液,用培养基进一步稀释,最终的二甲基亚砜含量不超过体积分数0.1%。
将HXO-Rb44细胞置于37 ℃、体积分数5% CO2培养箱,用含体积分数10%胎牛血清的RMPI1640培养基培养。取对数生长期HXO-Rb44细胞铺在96孔板上(每孔5×103个细胞),用终浓度为1 μmol·L-1、2 μmol·L-1、4 μmol·L-1吴茱萸碱处理细胞24 h(吴茱萸碱浓度选择参照参考文献[5]),记为吴茱萸碱1 μmol·L-1组、吴茱萸碱2 μmol·L-1组、吴茱萸碱4 μmol·L-1组,同时将不经吴茱萸碱处理的细胞设为对照组;按照Lipofectamine 2000试剂盒说明书将si-NC、si-ITGB2-AS1转染细胞,记为si-NC组、si-ITGB2-AS1组;将pcDNA、pcDNA-ITGB2-AS1转染细胞,再用4 μmol·L-1吴茱萸碱处理,记为吴茱萸碱4 μmol·L-1+pcDNA组、吴茱萸碱4 μmol·L-1+pcDNA-ITGB2-AS1组。
1.2.2 采用MTT法测定细胞存活率各组HXO-Rb44细胞培养48 h后,加20 μL MTT(0.5 g·L-1),并在37 ℃下孵育4 h,弃去上清液,加入二甲基亚砜(每孔100 μL)。最后,在酶标仪上于490 nm波长处测量光密度(D490),计算细胞存活率。
1.2.3 平板克隆实验计数克隆形成数将各组HXO-Rb44细胞铺在6孔板中(每孔500个细胞),并在37 ℃的培养基中孵育。两周后,用磷酸盐缓冲液(PBS)洗涤两次,在甲醇中固定30 min,结晶紫染料染色,随后用PBS洗去过量的结晶紫后计数克隆形成数。
1.2.4 流式细胞术检测细胞周期和细胞凋亡情况取各组HXO-Rb44细胞,用冷PBS洗涤3次,在4 ℃用体积分数70%冷乙醇固定过夜;用PBS洗涤后,加入PI和RNaseA在室温下孵育细胞30 min。细胞周期分布通过FACSCalibur流式细胞仪测量。取各组HXO-Rb44细胞,用冷PBS洗涤2次。随后将细胞重悬于100 μL流式细胞术结合缓冲液中,并用Annexin-V-FITC/PI试剂染色。通过FACSCalibur流式细胞仪分析凋亡细胞情况。
1.2.5 qRT-PCR检测ITGB2-AS1表达使用Trizol试剂分离总RNA,将1.0 μg RNA通过逆转录酶PCR合成cDNA,采用qRT-PCR检测cDNA。在94 ℃下预变性30 s后,按以下方式循环反应40次。在94 ℃下变性10 s,59 ℃下退火20 s,72 ℃下延伸20 s。用β-actin作为内源对照,引物序列(5’至3’):ITGB2-AS1正向引物为AGGAGATGGAACGAGGAAA,反向引物为TTAGTGGTCTGCGAAGGTG;β-actin正向引物为CCACGAAACTACCTTCAACTCC,反向引物为 GTGATCTCCTTCTGCATCCTGT。
1.3 统计学分析每个实验独立重复3次,数据采用SPSS 22.0软件进行统计学分析,结果以均数±标准差表示。多组间比较采用单因素方差分析,两组间比较采用t检验。检验水准:α=0.05。
2 结果
2.1 各组HXO-Rb44细胞存活率和克隆形成数吴茱萸碱1 μmol·L-1组与对照组细胞存活率和克隆形成数比较,差异均无统计学意义(均为P>0.05);吴茱萸碱2 μmol·L-1组、吴茱萸碱4 μmol·L-1组细胞存活率和克隆形成数较对照组、吴茱萸碱1 μmol·L-1组减小,差异均有统计学意义(均为P<0.05);吴茱萸碱4 μmol·L-1组细胞存活率和克隆形成数较吴茱萸碱2 μmol·L-1组减小,差异均有统计学意义(均为P<0.05)(图1)。
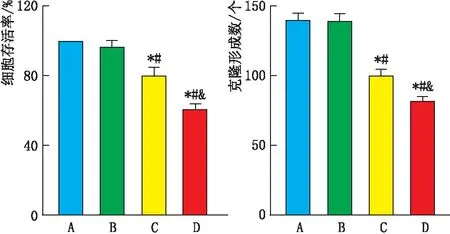
图1 各组细胞存活率和克隆形成数 A、B、C、D分别代表对照组、吴茱萸碱1 μmol·L-1组、吴茱萸碱2 μmol·L-1组、吴茱萸碱4 μmol·L-1组。与对照组相比,*P<0.05;与吴茱萸碱1 μmol·L-1组相比,#P<0.05;与吴茱萸碱2 μmol·L-1组相比,&P<0.05。
2.2 各组HXO-Rb44细胞周期比较情况对照组与吴茱萸碱1 μmol·L-1组G0-G1期、G2-M期细胞比例比较,差异均无统计学意义(均为P>0.05);吴茱萸碱2 μmol·L-1组、吴茱萸碱4 μmol·L-1组G0-G1期细胞比例较对照组、吴茱萸碱1 μmol·L-1组下降,G2-M期细胞比例较对照组、吴茱萸碱1 μmol·L-1组升高,差异均有统计学意义(均为P<0.05);吴茱萸碱4 μmol·L-1组G0-G1期细胞比例较吴茱萸碱2 μmol·L-1组下降,G2-M期细胞比例较吴茱萸碱2 μmol·L-1组升高,差异均有统计学意义(均为P<0.05)。4组细胞的S期细胞比例差异无统计学意义(P>0.05)(图2)。

图2 各组细胞周期比例情况 与对照组相比,*P<0.05;与吴茱萸碱1 μmol·L-1组相比,#P<0.05;与吴茱萸碱2 μmol·L-1组相比,&P<0.05。
2.3 各组HXO-Rb44细胞凋亡及ITGB2-AS1表达情况对照组与吴茱萸碱1 μmol·L-1组细胞凋亡率、ITGB2-AS1表达量比较,差异均无统计学意义(均为P>0.05);吴茱萸碱2 μmol·L-1组、吴茱萸碱4 μmol·L-1组细胞凋亡率较对照组、吴茱萸碱1 μmol·L-1组升高,ITGB2-AS1表达量较对照组、吴茱萸碱1 μmol·L-1组降低,差异均有统计学意义(均为P<0.05);吴茱萸碱4 μmol·L-1组细胞凋亡率较吴茱萸碱2 μmol·L-1组升高,ITGB2-AS1表达量较吴茱萸碱2 μmol·L-1组降低,差异均有统计学意义(均为P<0.05)(图3)。
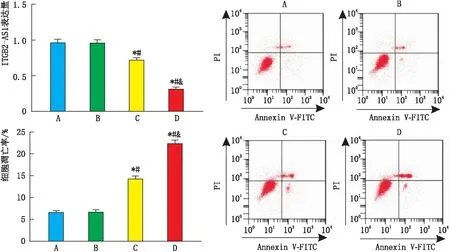
图3 各组细胞ITGB2-AS1表达量和细胞凋亡率 A、B、C、D分别代表对照组、吴茱萸碱1 μmol·L-1组、吴茱萸碱2 μmol·L-1组、吴茱萸碱4 μmol·L-1组。与对照组相比,*P<0.05;与吴茱萸碱1 μmol·L-1组相比,#P<0.05;与吴茱萸碱2 μmol·L-1组相比,&P<0.05。
2.4 干扰ITGB2-AS1表达对HXO-Rb44细胞存活率、克隆形成数、细胞周期和凋亡的影响si-ITGB2-AS1组细胞ITGB2-AS1表达量、细胞存活率、克隆形成数和G0-G1期细胞比例均较si-NC组降低,G2-M期细胞比例、细胞凋亡率均较si-NC组升高,差异均有统计学意义(均为P<0.05);但S期细胞比例差异无统计学意义(P>0.05)(图4)。
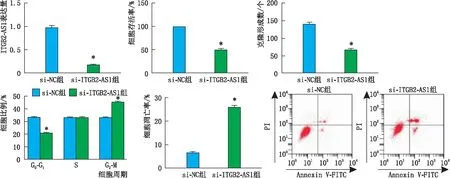
图4 si-NC组、si-ITGB2-AS1组细胞ITGB2-AS1表达量、细胞存活率、克隆形成数和细胞比例和细胞凋亡率 与si-NC组相比,*P<0.05。
2.5 ITGB2-AS1对吴茱萸碱作用的影响吴茱萸碱4 μmol·L-1+pcDNA-ITGB2-AS1组细胞ITGB2-AS1表达量、细胞存活率和克隆形成数均较吴茱萸碱4 μmol·L-1+pcDNA组升高,差异均有统计学意义(均为P<0.05)(图5)。
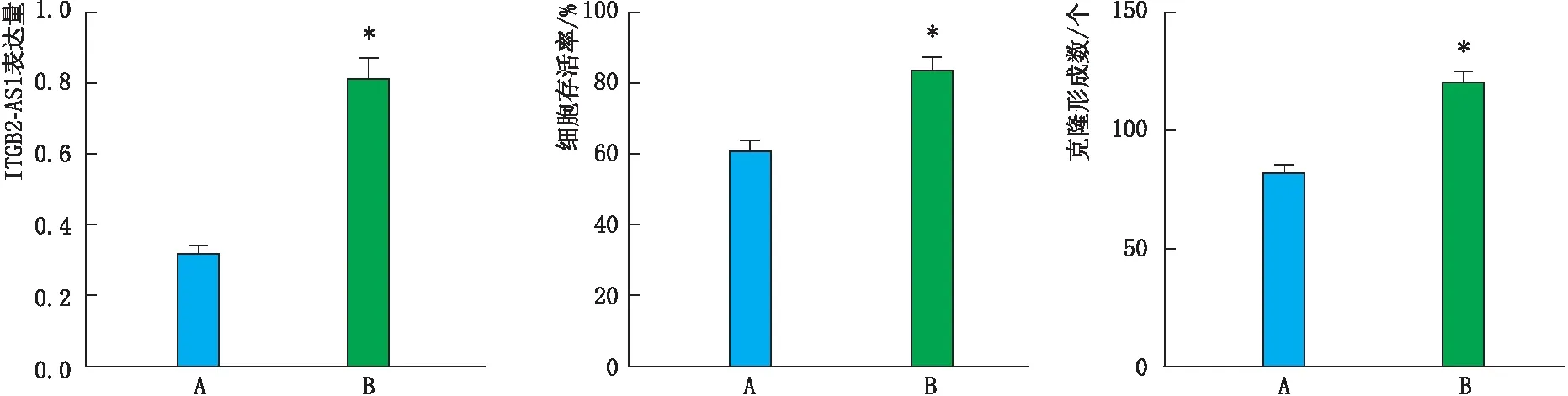
图5 吴茱萸碱4 μmol·L-1+pcDNA组和吴茱萸碱4 μmol·L-1+pcDNA-ITGB2-AS1组细胞ITGB2-AS1表达量、细胞存活率和克隆形成数 A和B分别代表吴茱萸碱4 μmol·L-1+pcDNA组和吴茱萸碱4 μmol·L-1+pcDNA-ITGB2-AS1组。与吴茱萸碱4 μmol·L-1+pcDNA组相比,*P<0.05。
吴茱萸碱4 μmol·L-1+pcDNA-ITGB2-AS1组G0-G1期细胞比例较吴茱萸碱4 μmol·L-1+pcDNA组升高, G2-M期细胞比例、细胞凋亡率较吴茱萸碱4 μmol·L-1+pcDNA组降低,差异均有统计学意义(均为P<0.05)(图6)。
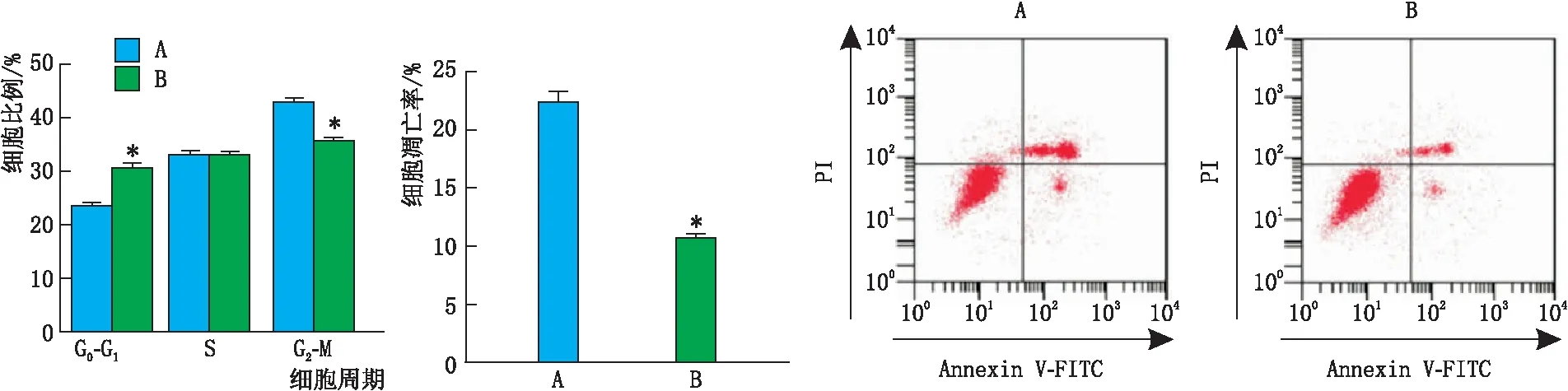
图6 吴茱萸碱4 μmol·L-1+pcDNA组和吴茱萸碱4 μmol·L-1+pcDNA-ITGB2-AS1组细胞比例和细胞凋亡率 A和B分别代表吴茱萸碱4 μmol·L-1+pcDNA组和吴茱萸碱4 μmol·L-1+pcDNA-ITGB2-AS1组。与吴茱萸碱4 μmol·L-1+pcDNA组相比,*P<0.05。
3 讨论
视网膜母细胞瘤是一种侵袭性眼内肿瘤,全世界每18 000名新生儿中就有1例此病患者,占所有儿童期癌症的3%[11-12]。视网膜母细胞瘤早期症状不明显,确诊时多数患者已处于中晚期,若延迟治疗可导致不良预后[13]。吴茱萸碱是天然化合物,可剂量依赖性抑制胰腺癌细胞增殖、迁移,并诱导细胞凋亡和自噬[14]。吴茱萸碱对骨肉瘤细胞具有抗癌作用,可促进其凋亡和G2-M细胞周期停滞[15]。吴茱萸碱能抑制甲状腺癌细胞增殖,诱导细胞凋亡[16]。但在视网膜母细胞瘤中的作用尚未可知。本研究结果显示,用不同浓度吴茱萸碱处理HXO-Rb44细胞24 h后,2 μmol·L-1、4 μmol·L-1吴茱萸碱可降低HXO-Rb44细胞存活率、克隆形成数、G0-G1期细胞比例,并提高G2-M期细胞比例、细胞凋亡率,这与前人研究[6-7]相一致,表明吴茱萸碱能抑制视网膜母细胞瘤细胞增殖,阻滞G2-M期细胞周期,并促进细胞凋亡。
越来越多的证据表明,lncRNA在视网膜母细胞瘤细胞增殖过程中起着关键的调节作用[17]。Giulietti等[18]通过癌症基因组图集分析显示,ITGB2-AS1在胰腺导管腺癌中过表达。Yang等[19]证实ITGB2-AS1在胰腺癌组织和细胞系中表达均升高,下调ITGB2-AS1表达能抑制胰腺导管腺癌细胞增殖、侵袭和迁移,并诱导细胞凋亡。Dai等[20]报道,ITGB2-AS1在骨肉瘤组织中的表达上调,ITGB2-AS1高表达的骨肉瘤患者预后较差,沉默ITGB2-AS1可降低骨肉瘤细胞增殖、迁移和侵袭能力,并诱导其凋亡。本研究用吴茱萸碱处理HXO-Rb44细胞后ITGB2-AS1表达下调,提示吴茱萸碱可调控ITGB2-AS1表达。下调ITGB2-AS1表达可使视网膜母细胞瘤HXO-Rb44细胞存活率、克隆形成数、G0-G1期细胞比例降低,细胞凋亡率和G2-M期细胞比例增加,表明干扰ITGB2-AS1表达可抑制视网膜母细胞瘤细胞增殖,并增强细胞凋亡,阻滞细胞周期进展。上调ITGB2-AS1表达可部分逆转吴茱萸碱对HXO-Rb44细胞的作用,表明吴茱萸碱可通过调控ITGB2-AS1表达影响视网膜母细胞瘤进展。
综上所述,吴茱萸碱能有效抑制视网膜母细胞瘤细胞增殖,阻滞细胞周期,并诱导细胞凋亡,其机制可能与ITGB2-AS1表达下调有关。

