cMRI结合MRS技术诊断颅内高级别胶质瘤与转移瘤的效果
运彩虹,张 颖,陈丽娟,杨建新,陈天虎,王生伟(通信作者)
(酒泉市人民医院放射科 甘肃 酒泉 735000)
颅内高级别胶质瘤(HGG)和实质脑转移瘤(sBM)作为颅内恶性肿瘤在临床中比较常见,会严重损伤患者脑组织功能,需要进行及时准确的诊断,为临床治疗提供依据[1]。该类疾病的组织病变和病理特征存在一定差异性,但均有比较显著的侵袭性生长方式,同时若两类疾病患者均无既往肿瘤病史或典型影像学表现时,会有较大的诊断难度。有研究发现通过cMRI对二者进行诊断,结果显示两类疾病的形态学表现和影像学信号比较相似,易混淆,故误诊率较高,而HGG和sBM的病程、治疗方法和预后存在区别,因此对其进行有效的诊断和鉴别至关重要[2]。磁共振波谱(MRS)技术是当前唯一能够在无创伤条件下对细胞、组织生化代谢情况进行评价的一种磁成像技术,能够初步评估肿瘤恶化程度,明确其浸润范围,进而对脑肿瘤情况进行分析和判断。为探究cMRI和MRS用于HGG、sBM的诊断效果,本次选取2017年7月—2022年5月酒泉市人民医院收治的64例疑似HHG和55例疑似sBM患者开展对照研究,详情报道如下。
1 资料与方法
1.1 一般资料
选取2017年7月—2022年5月酒泉市人民医院收治的64例疑似HHG和55例疑似sBM患者为研究对象。64例疑似HGG患者中男36例,女28例,年龄22~63 岁,均龄(43.65±2.48)岁;55例疑似sBM患者中男30例,女25例,年龄20~67岁,均龄(45.14±2.35) 岁。研究已获得患者及家属的知情同意。
纳入标准:①患者均有不同程度头痛、恶心呕吐、视物模糊、癫痫及记忆力下降、感觉或运动功能障碍等疑似HGG、sBM临床症状表现;②均为单发病变。排除标准:①精神病变患者;②妊娠期和哺乳期病例;③其他系统恶性肿瘤病例。
1.2 方法
所有病例均进行cMRI及MRS检查,选择联影1.5T超导型磁共振扫描仪和标准头颅线圈。
cMRI的常规平扫序列FSE中的T2WI参数设置:TE、TR分别为105 ms、3 500 ms,SE序列中T1WI参数设置:TE和TR分别为20 ms、580 ms,矩阵设置为256×256。磁共振弥散加权成像(diffusion weighted imaging,DWI)扫描中的SE-EPI序列参数设置:TE和TR分别为70 ms、1 800 ms,b值为1 000 s/mm2,矩阵设置为180×180,层距和层厚分别为1 mm、5 mm,FOC为32 cm×32 cm,对病变弥散受限情况进行观察。增强扫描造影剂选择钆喷酸葡胺,应用T1WI序列,剂量0.1 mmol/kg,按照2 mL/s的速率注射。
MRS扫描序列为PROBE,参数设置:层厚10 mm,多体素TE、TR分别为140 ms、1 200 ms,NEX设置为1次,计算不同区域胆碱/肌酸(Cho/Cr)值、N-乙酰天冬氨酸/肌酸(NAA/Cr)值和胆碱/N-乙酰天冬氨酸(Cho/NAA)值。每个区域均需测量15 mm2左右的大小,连续测量3次计算均值。图像传入后处理工作站进行常规后期处理。
1.3 观察指标及评定标准
以病理诊断结果为金标准,比较cMRI和MRS对HGG、sBM的诊断准确率、灵敏度、特异度、阳性预测值和阴性预测值,同时分析总结HGG和sBM的影像学特征,对比两种疾病不同区域(中央坏死区、边缘实质区、周围水肿区)内MRS检查的Cho/Cr值、NAA/Cr值和Cho/NAA值。准确率=(真阳性+真阴性)/总病例×100%;灵敏度=真阳性/(真阳性+假阴性)×100%;特异度=真阴性/(假阳性+真阴性)×100%;阳性预测值=真阳性/(真阳性+假阳性)×100%;阴性预测值=真阴性/(假阴性+真阴性)×100%。
1.4 统计学方法
采用SPSS 26.0统计软件进行数据处理。计量资料以均数±标准差()表示,组间比较采用独立样本t检验;计数资料以频数(n)、百分率(%)表示,组间比较用χ2检验。P<0.05则差异具有统计学意义。
2 结果
2.1 cMRI和MRS技术对HGG、sBM的诊断结果分析
2.1.1 cMRI和MRS技术对HGG的诊断结果分析
病理诊断结果显示HGG阳性50例,阴性14例。cMRI诊断阳性45例,包括真阳性36例和假阳性9例,诊断阴性19例,包括真阴性5例,假阴性14例;MRS诊断阳性49例,包括真阳性47例和假阳性2例,诊断阴性15例,包括真阴性12例,假阴性3例。MRS对HGG的诊断效能均显著高于cMRI诊断(P<0.05),见表1。
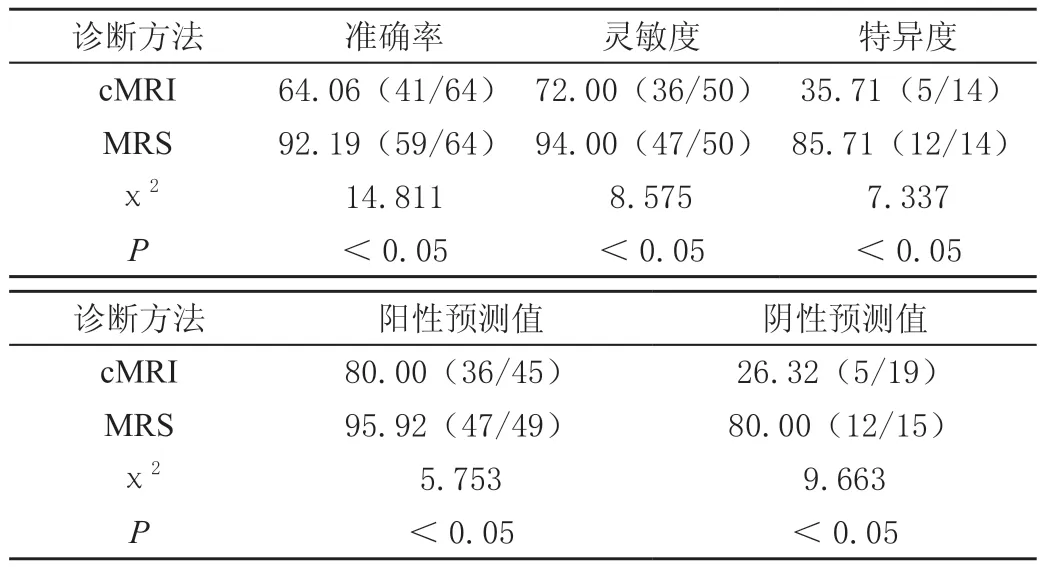
表1 cMRI和MRS对HGG的诊断效能比较[%(n/m)]
2.1.2 cMRI和MRS技术对sBM的诊断结果分析
病理诊断结果显示sBM阳性43例,阴性12例。cMRI诊断阳性40例,包括真阳性31例和假阳性9例,诊断阴性15例,包括真阴性3例,假阴性12例;MRS诊断阳性42例,包括真阳性41例和假阳性1例,诊断阴性13例,包括真阴性11例,假阴性2例。MRS对sBM的诊断效能均显著高于cMRI诊断(P<0.05),见表2。
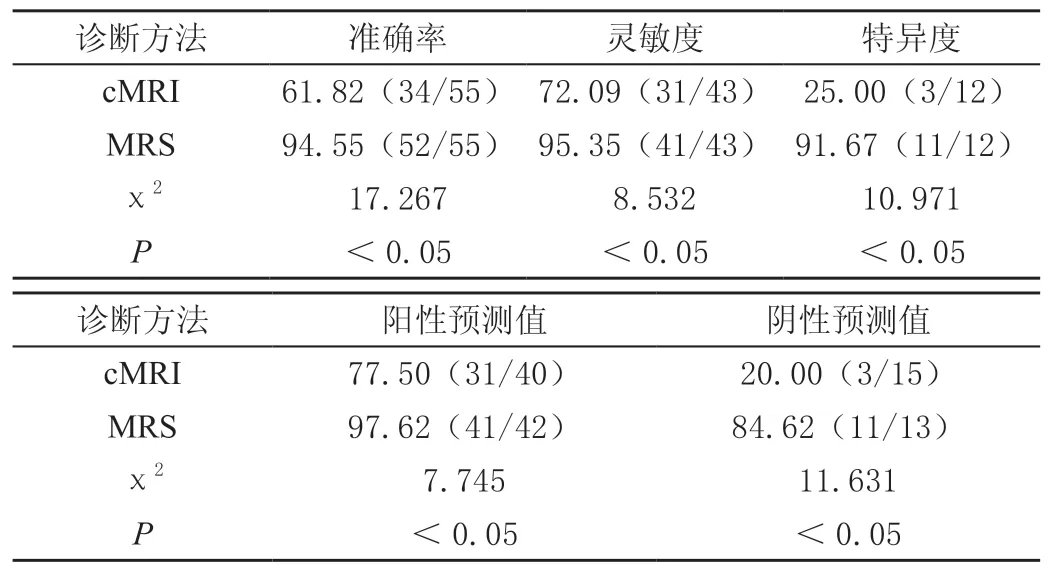
表2 cMRI和MRS对sBM的诊断效能比较[%(n/m)]
2.2 HGG、sBM的影像学特征分析
cMRI下HGG、sBM的表现:在cMRI中HGG的T1WI、T2WI序列分别可见稍低和稍高信号,内外壁厚度不均匀且有毛糙表现,瘤壁弥散轻微受限,在周围水肿组织内T1WI、T2WI序列分别呈低、高信号表现;增强结果显示瘤体环形强化明显,50例HGG患者中周围水肿伴斑片状强化者34例,无强化表现者16例。在cMRI中sBM的T1WI、T2WI序列分别可见稍低和稍高信号,有较为毛糙的内壁,但外壁相对光整,瘤壁轻度增厚,弥散受限,且周围组织有水肿表现,T1WI、T2WI序列分别低、高信号表现;增强结果显示瘤体结节状强化或环形强化显著,但周围水肿组织未见强化表现。
MRS下HGG、sBM的表现:在MRS中HGG瘤体的实质部分和周围水肿区可见Cr和NAA峰下降,而Cho峰呈上升表现,Cho/Cr上升,Cho/NAA值增加;病理结果显示HGG患者均可在水肿区内发现肿瘤侵犯情况。在MRS中sBM瘤体实质区、中央坏死区表现同HGG具有一定相似性,且水肿区内Cho峰、NAA峰无异常表现。
2.3 MRS技术对不同区域内HGG、sBM的测量结果分析
MRS检测结果显示,中央坏死区内HGG和sBM的Cho/Cr、NAA/Cr和Cho/NAA值无显著差异(P>0.05);边缘实质区内HGG的NAA/Cr显著低于sBM(P<0.05),二者Cho/Cr、Cho/NAA值无显著差异(P>0.05);周围水肿区内HGG的Cho/Cr相比sBM更高,Cho/NAA更低,差异均有统计学意义(P<0.05),二者NAA/Cr值无显著差异(P>0.05)。见表3。
表3 MRS技术对不同区域内HGG、sBM的测量结果分析()
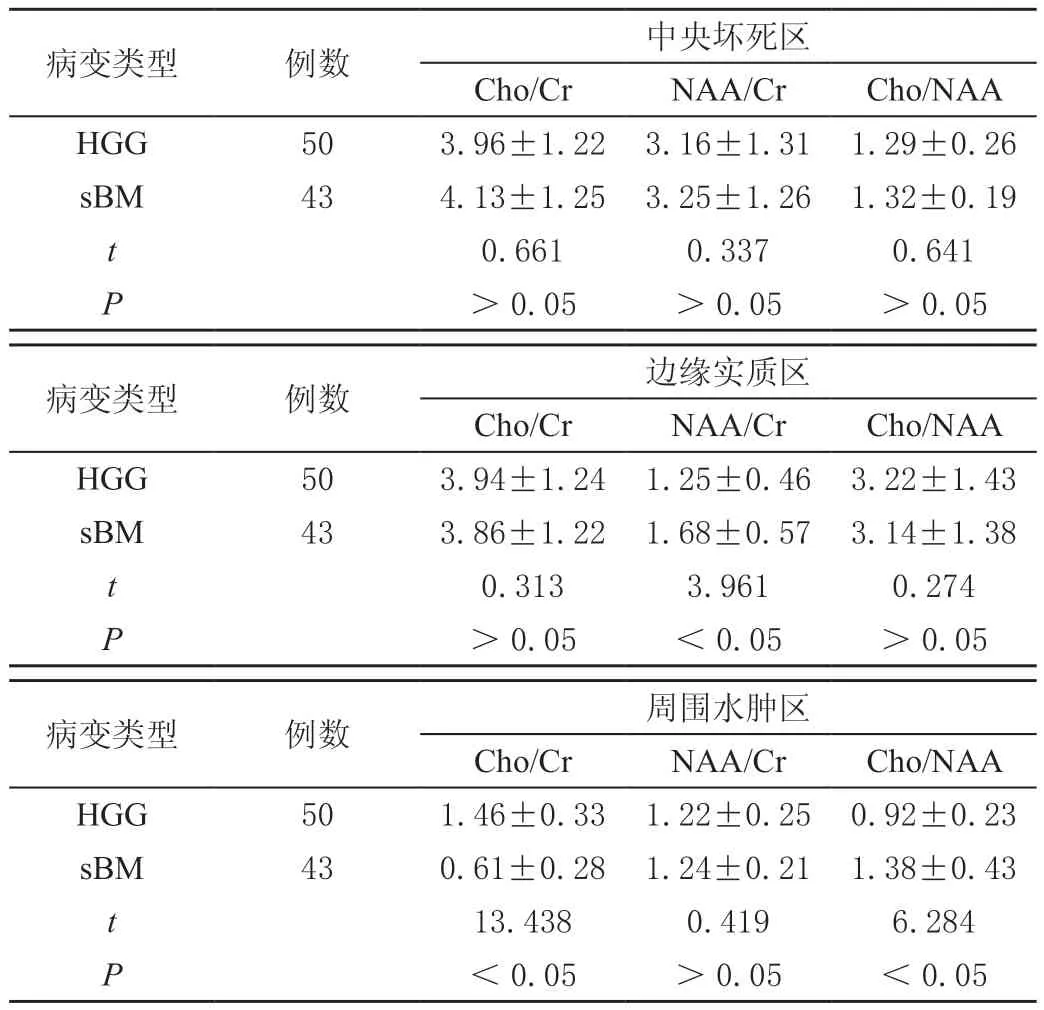
表3 MRS技术对不同区域内HGG、sBM的测量结果分析()
病变类型 例数 中央坏死区Cho/Cr NAA/Cr Cho/NAA HGG 50 3.96±1.22 3.16±1.31 1.29±0.26 sBM 43 4.13±1.25 3.25±1.26 1.32±0.19 t 0.661 0.337 0.641 P>0.05 >0.05 >0.05病变类型 例数 边缘实质区Cho/Cr NAA/Cr Cho/NAA HGG 50 3.94±1.24 1.25±0.46 3.22±1.43 sBM 43 3.86±1.22 1.68±0.57 3.14±1.38 t 0.313 3.961 0.274 P>0.05 <0.05 >0.05病变类型 例数 周围水肿区Cho/Cr NAA/Cr Cho/NAA HGG 50 1.46±0.33 1.22±0.25 0.92±0.23 sBM 43 0.61±0.28 1.24±0.21 1.38±0.43 t 13.438 0.419 6.284 P<0.05 >0.05 <0.05
3 讨论
HGG、sBM均为临床中发病率较高的颅内恶性肿瘤病变,前者来自脑白质深部,主要成分为神经胶质细胞,髓质区常见,复发率较高且有较强侵袭性,主要症状为颅内压上升,也可导致少数患者出现智力下降或癫痫症状;后者通常是其他部位的原发性肿瘤通过血行途径转移到颅内,在皮髓质交界处多见,单发病变以囊性为主,患者可有头晕头痛、恶心呕吐等症状[3]。sBM多发率较高,处于单发病变且无明确原发灶时,在cMRI中的表现和HGG类似,因此鉴别难度较大。而HGG、sBM的治疗方法有差异,故需要对其进行准确诊断和鉴别,及时为患者的临床治疗提供参考依据[4]。MRS属于一种新型影像学技术,无创伤性,可对脑组织化学成分进行检测,主要通过测定脑内代谢物评估肿瘤病变程度和性质。
在cMRI影像中HGG和sBM均有中央坏死区域内信号混乱,瘤壁厚度不均匀,T1WI、T2WI序列分别有稍低、稍高信号表现,同时内壁可见结节状态,增强扫描下环形强化比较明显,可见二者的cMRI表现有很多重叠部分,主要区别在于二者外壁表现中HGG比较毛糙,而sBM比较光整[5]。sBM单发病变以小病灶为主,但相比HGG的水肿范围而言更大,造成这种情况的主要原因是sBM周围水肿仅有血管源性水肿一种情况,故增强扫描后无强化表现,而HGG周围水肿包括血管源性水肿和瘤细胞沿血管周围间隙成像向外浸润状态,故增强扫描后周围水肿区有强化表现[6]。MRS可以补充cMRI对HGG、sBM的诊断结果,除低级别脑胶质瘤、病灶过小的浸润肿瘤以外,多数脑肿瘤的瘤体都会在神经元损伤后出现NAA含量降低,肿瘤恶性程度越严重则Cho含量越高的表现,原因是HGG级别越高则其坏死囊变越明显,神经元残留量越少[7]。但sBM是由脑外肿瘤转移到颅内的,肿瘤细胞自身神经元较少,故通常无NAA或峰值极低。在本次研究中发现,MRS检测结果显示HGG实质区和周围水肿区域内均有Cr、NAA含量偏低,Cho含量较高表现。而在MRS检测结果中sBM的瘤体实质区Cr、NAA、Cho表现类似HGG,在边缘实质区内NAA/Cr相比HGG更高。原因是在sBM生长期内,大部分肿瘤细胞都生长于正常的脑组织,血供也来自于正常脑组织,尚未浸润至瘤外水肿区内,故主要在边缘实质区内聚集。在本次研究发现,MRS对HGG、sBM的诊断准确率、敏感度和特异度等均高于cMRI,提示在cMRI基础上联合应用MRS可弥补前者的不足,进一步提升疾病的诊断效果。
综上所述,临床中常见的颅内恶性肿瘤HGG、sBM进行cMRI检查诊断时表现较为相似,因此单纯cMRI的诊断难度较高,鉴别效果较差,而联合应用MRS可在保证安全性的基础上根据不同的脑内代谢物水平等指标有效区分两种疾病,并提示HGG的侵犯范围和程度,在临床治疗方案的制定中有良好的参考作用,故可进行推广应用。

