CBX4在前列腺癌中的表达及意义*
杜红飞,袁鸿玲,庞雪利,邓兰,阳燕,唐宁,许颖
610500 成都,成都医学院第一附属医院 检验科
前列腺癌是男性泌尿系统最为常见的恶性肿瘤之一。据2021年全球最新癌症数据显示,前列腺癌的新增病例数为248 530例,占26%,居男性癌症的第1位[1];2022年我国癌症中心的数据显示,前列腺癌的发病率居我国第7位,死亡率居第10位[2]。目前大约10%的前列腺癌患者就诊时已处于疾病晚期,且有5%患者已发生远处转移[3],严重影响人类的健康。因此,迫切需要探究前列腺癌发病的病理分子机制,寻找有效的生物学标志物及治疗靶点。
CBX4(chrombox homolog 4,CBX4)为 多 梳 基因蛋白家族(the Polycomb group of protein,PcG)成员之一,是一种SUMO E3链接酶[4]。近年来的研究证实CBX4参与了多种肿瘤的发生发展,为重要的分子靶点,然而CBX4在前列腺癌中的研究仍处于空白。铁死亡是2012年新发现的一种细胞内脂质过氧化物和活性氧过量积累导致的铁依赖性程序性细胞死亡[5],不同于细胞凋亡、坏死及自噬,铁死亡在形态学上表现为线粒体皱缩、线粒体嵴减少、线粒体膜密度增加和细胞核正常[6]。目前的研究表明,铁死亡主要包含两个途径,一是外源性(转运蛋白依赖)途径,即胱氨酸/谷氨酸反向转运体,其中SLC7A11为铁死亡的重要上游调控蛋白;另一途径为内源性(酶调控)途径,脂质过氧化物积累是铁死亡的标志。2021年Ghoochani等[7]最新的研究发现,SLC7A11高表达于去势抵抗性前列腺癌,参与前列腺癌铁死亡的调控。为此,本研究将通过生物信息数据库和细胞水平实验揭示CBX4在前列腺癌的表达,临床意义及CBX4对前列腺癌铁死亡的影响,以期为前列腺癌的临床治疗和诊断提供有效的分子靶点。
1 材料与方法
1.1 材料
转移性激素敏感型前列腺癌细胞系LNCap和22RV1、转移性去势抵抗性前列腺癌细胞系PC3和DU145以及前列腺增生细胞BPH-1为课题组前期保存于液氮;组织芯片从上海芯超生物购买获得,包括100例前列腺癌组织,50例前列腺癌旁组织,相关病理参数见表1(剔除6例信息不全的病例)。CBX4干扰慢病毒载体(LV-shCBX4)购买于上海吉凯基因,保存于-80℃。CBX4抗体购于正能生物有限公司。
1.2 方法
1.2.1 Oncomine数据库分析CBX4基因表达 Onc- omine(www.oncomine.org)为一个在线分析DNA或RNA序列的肿瘤微阵列数据库,可用于基因表达分析的研究。本文利用Oncomine进行CBX4数据集收集,筛选条件为“gene: CBX4; analysis type: cancer vs normal analysis; data type: all; cancer type: prostate cancer; gene summary: P < 0.05,fold change > 2,gene rank = top 10%; order by: over-expression”。对获取的部分数据进行Meta分析,结果用散点图表示。
1.2.2 UALCAN数据库进行病理参数和生存期分析 UALCAN(http://ualcan.path.uab.edu)数 据 库是一个基于TCGA数据集中31种癌症类型的临床数据进行在线分析和挖掘的网站工具,可以对相关基因进行表达谱、临床病理参数等进行分析。在UALCAN数据库中的TCGA数据集的gene symbol(s)检索“CBX4”,TCGA Dataset选择“prostate adenocarcinoma”。分别对CBX4在前列腺癌和前列腺正常组织的表达、CBX4的表达与前列腺癌患者临床病理特征(淋巴结转移、Gleason 分数等)及生存期进行分析。
1.2.3 HPA数据库分析CBX4蛋白表达水平 HPA在线数据库(https://www.proteinatlas.org):该数据库包含大约20 种常见的肿瘤基因表达数据。本项目通过利用该数据库在线评估正常潜前列腺正常组织和前列腺癌中CBX4蛋白表达水平。
1.2.4 String数据库平台构建CBX4蛋白互作网络 String(https://cn.string-db.org/)是一个在线搜索已知蛋白,以及预测蛋白质互作关系(protein-protein interaction,PPI)网络的数据库。本研究运用该数据库分析可能与CBX4基因相互作用的蛋白网络。
1.2.5 免疫组织化学 免疫组化参照课题组前期已发表论文所述方法[8-9]。CBX4抗体按照1∶200的比例稀释用于前列腺癌组织免疫组化检测。将组织芯片进行常规脱蜡,水化,抗原修复,一抗,二抗及三抗孵育等步骤处理后,在光学显微镜下观察并采集图像。CBX4免疫组化染色结果通过半定量计分的方法进行蛋白表达的评价,染色强度评分原则如下:阴性(0分)、弱阳性(1分)、中阳性(2分)、强阳性(3分);阳性染色的百分比评分如下: < 5%(0分)、5% ~ 25%(1分)、26% ~ 50%(2分)、51% ~ 75%(3分)、 > 75%(4分)。CBX4的最终免疫组化染色得分(0 ~ 12分)为组织标本的染色强度评分乘以相对应的阳性染色的百分比评分。
1.2.6 细胞培养 前列腺癌细胞PC3、22RV1、DU145 和LNCap,前列腺增生细胞BPH-1购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞培养基为含10%胎牛血清,100 μg/mL链霉素,100 U/mL青霉素的1640,于37℃、5% CO2条件下静置培养。
1.2.7 实时荧光定量PCR 参照课题组前期已发表论文所述方法[8-9],采用Triol法提取细胞总RNA,经NanoDrop 2000进行定量后,取200 ng总RNA经Bio-Rad逆转录试剂逆转录,后将产物进行qPCR检 测,CBX4的 引物序列为:Forward: 5’-AGTGGAGTATCTGGTGAAATGGA-3;Reverse:5’-TCCTGCCTTTCCCTGTTCTG-3’。每个样本以β-actin为内参。
1.2.8 CBX4干扰慢病毒载体感染 LV-shCBX4和LV-control(LV-ctrl)慢病毒从上海吉凯基因购买。CBX4干扰序列为:GATGAAGATAGTCAAGAACAA;对照序列为:TTCTCCGAACGTGTCACGT。常规培养前列腺癌细胞,待细胞融合度达60% ~ 80%。感染细胞LV-shCBX4和LV-ctrl,并使用嘌呤霉素稳定筛选CBX4沉默细胞,提取细胞总蛋白和总RNA,在蛋白和mRNA水平上验证CBX4干扰效果。
1.2.9 免疫印迹(Western blot) 参照课题组前期已发表论文所述方法[8-9]。采用细胞裂解法提取细胞总蛋白,即加入细胞RIPA裂解液,经匀浆、裂解、离心后,获得总蛋白,后通过Bradford方法检测总蛋白浓度,利用 SDS-PAGE行蛋白电泳,经恒流电转将蛋白转印至PVDF膜上,后将PVDF膜放入含5%脱脂奶粉的TBST封闭液中封闭,加入CBX4一抗4℃孵育过夜,洗膜,加入二抗,37℃孵育1 h,洗膜后加入发光液,显影,拍照。最后,采用ImageJ分析系统软件测定蛋白条带的光密度值,以GAPDH蛋白条带作为内参对照。
1.2.10 透射电镜 常规培养细胞,经LV-shCBX4和LV-ctrl慢病毒感染细胞48 h后,将细胞消化制成细胞悬液,分别两次离心后,吸除细胞上清,缓慢加入戊二醛固定液,将固定好的细胞送成都里来生物科技有限公司完成透射电镜细胞铁死亡观察,即通过固定-脱水-渗透与包埋-超薄切片-双染色法-图像采集(6 000倍观察)。
1.3 统计学方法
本研究涉及的所有数据采用SPSS 26.0统计分析软件。计量资料数据用均值±标准差表示,运用t检验分析组间差异。CBX4的表达和临床病理参数之间的关系采用χ2检验分析。P < 0.05被认为具有统计学意义。
2 结 果
2.1 CBX4在前列腺癌组织的表达分析
在Oncomine数据库中,有327项研究分析了CBX4在癌组织和正常组织的表达差异,结果显示:58项研究提示表达差异有统计学意义,49项为高表达,9项为低表达。其中,有5项研究分析了前列腺癌中CBX4的表达情况,均提示CBX4呈异常高表达(图1A)。对5项研究的数据进行Meta分析,结果提示,与对照组比较,CBX4在所有差异表达基因的中位数值排名为576(P < 0.001),表明CBX4在前列腺癌中高表达(图1B)。
然后,选取Wallace和Grasso等2项前列腺癌芯片的表达研究,对其表达进行了散点图分析。结果显示,CBX4均高表达于前列腺癌组织,差异有统计学意义(P < 0.05;图1C、D)。最后,利用不同来源的UALCAN和HPA数据库验证,发现CBX4明显高表达于前列腺癌(图1E、F)。
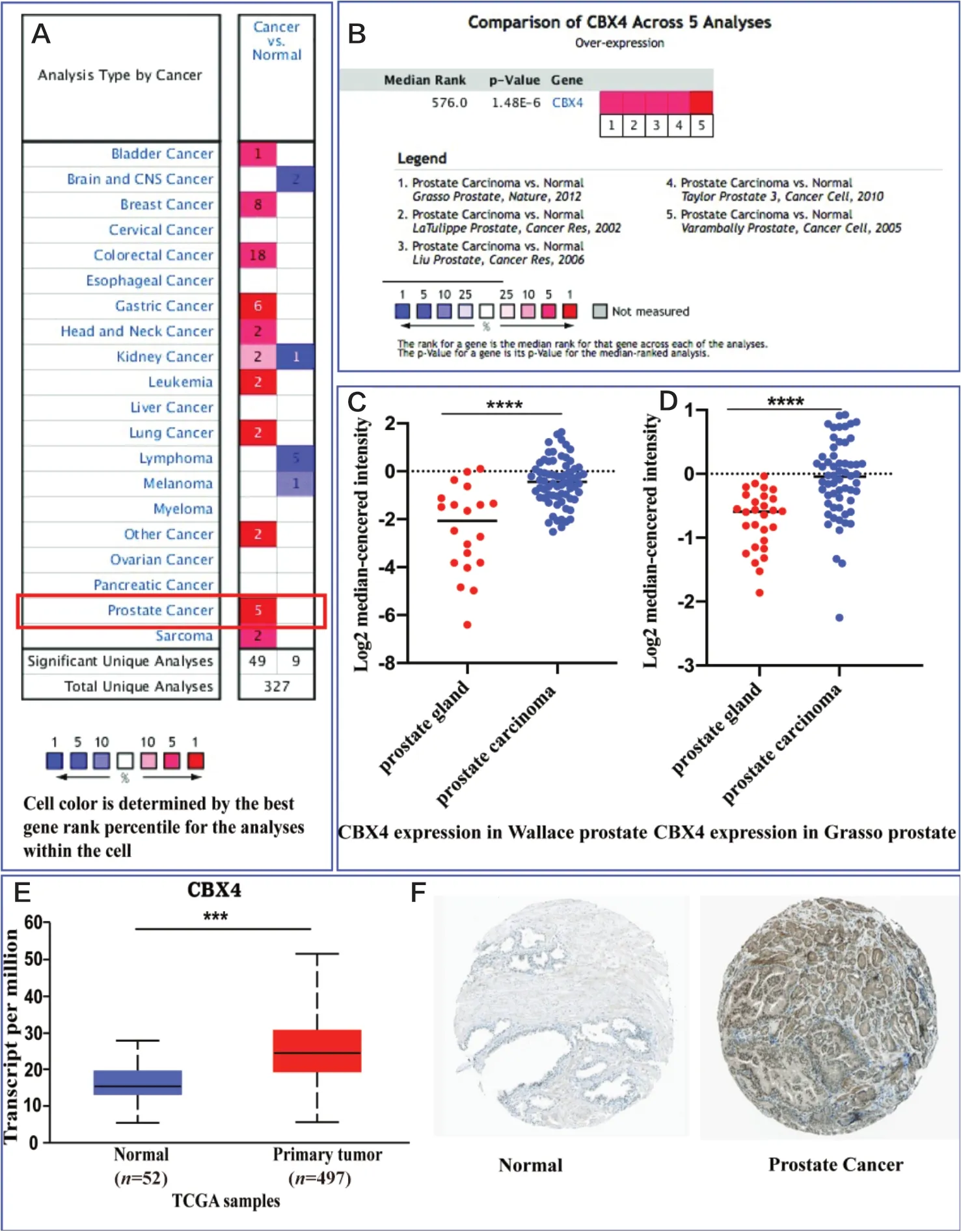
图1 CBX4在前列腺癌中的表达差异Figure 1.Differential Expression of CBX4 in Prostate Cancer
2.2 CBX4的表达与前列腺癌病理参数及生存期的关系
运用UALCAN数据库分析CBX4 mRNA表达水平与前列腺癌患者临床病理特征关系,包括Gleason分数、TP53突变、淋巴结转移等,数据结果表明CBX4的表达与前列腺癌的Gleason分数及淋巴结转移呈正相关,与TP53突变和种族有明显相关性(图2A~D)。同时,对CBX4高、低表达组进行了生存期的分析,揭示前列腺癌患者的不良预后与CBX4的高表达相关(图2E)。
进一步在临床样本组织芯片中利用免疫组织化学分析CBX4蛋白在前列腺癌表达及其与患者临床病理参数的关系。结果提示,CBX4蛋白表达水平明显升高(图2F、G),且与临床Gleason分数相关(P < 0.05),而与前列腺癌患者的年龄、病理分级、TNM分期无关(P > 0.05;表1、2)。

表1 前列腺癌患者的临床参数及CBX4在前列腺癌组织中的表达Table 1.Clinical Characteristics of Prostate Cancer Patients and CBX4 Expression in Prostate Cancer Tissue
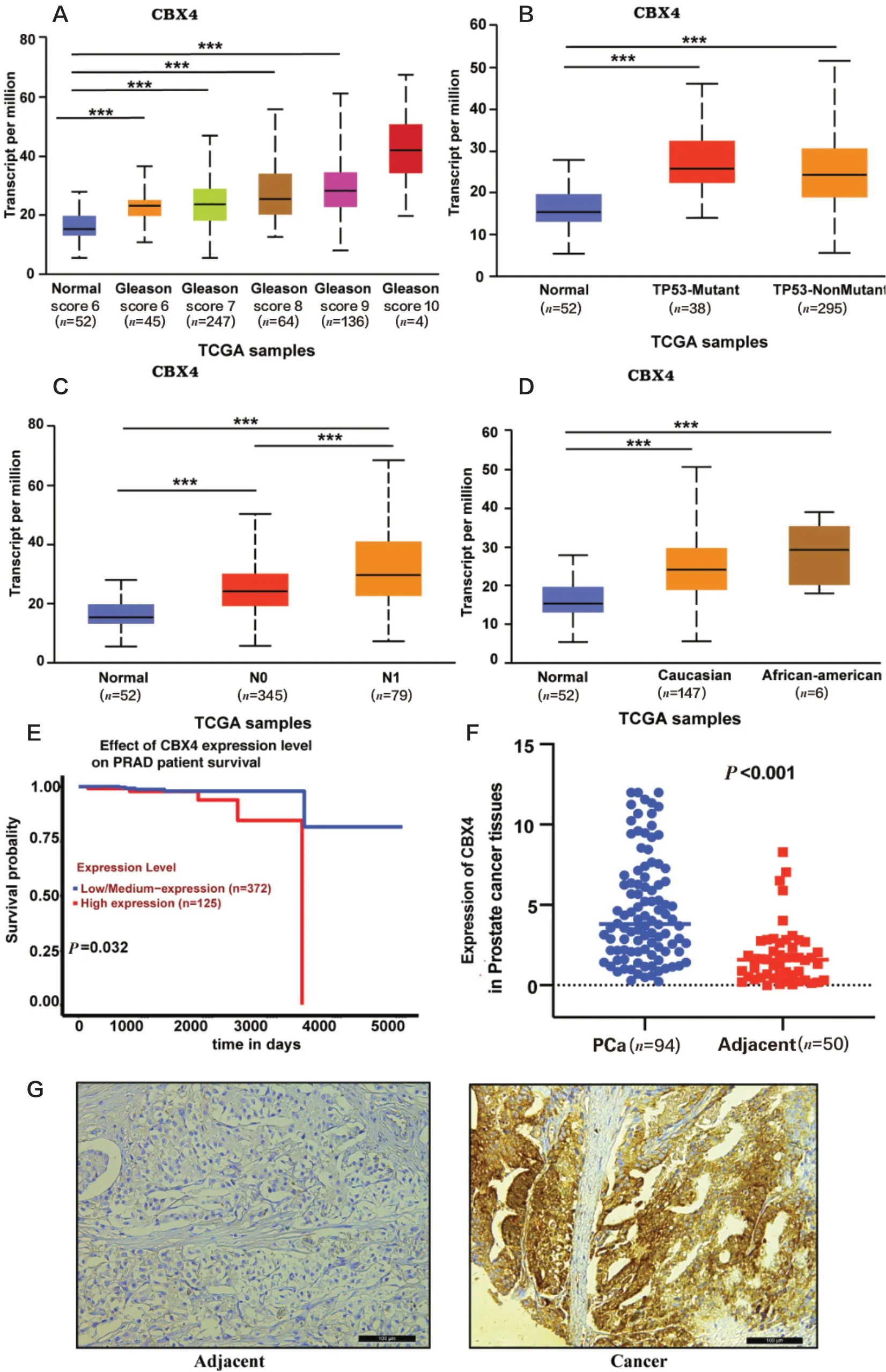
图2 CBX4的表达与前列腺癌病理参数的关系Figure 2.Association between CBX4 Expression and Clinical Characteristics of Prostate Cancer
2.3 CBX4相互作用的蛋白网络分析
通过String平台构建CBX4蛋白互作网络(图3)发现,与CBX4相互作用的蛋白有E3泛素蛋白连接酶RING2和RING1、多梳复核蛋白BMI-1、多梳样蛋白PHC1/PHC2/PHC3、DNA甲基转移酶DNMT3A等。
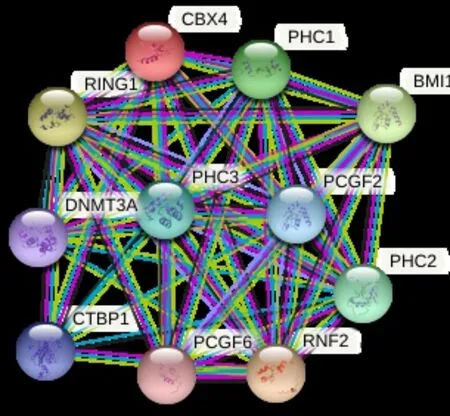
图3 CBX4基因与上下游基因的关系Figure 3.Relationship between CBX4 and Upstream or Downstream Genes
2.4 CBX4在前列腺癌细胞的表达情况
提取前列腺增生细胞与癌细胞的总RNA,进行RT-PCR。结果显示,与前列腺增生细胞BPH-1比较,CBX4在前列腺癌细胞22Rv1和LNcap细胞中的mRNA表达水平显著升高,差异有统计学意义(P < 0.05;图4)。由于22Rv1和LNcap为转移性雄激素敏感型前列腺癌细胞,表明CBX4的高表达可能与雄激素敏感有关系。
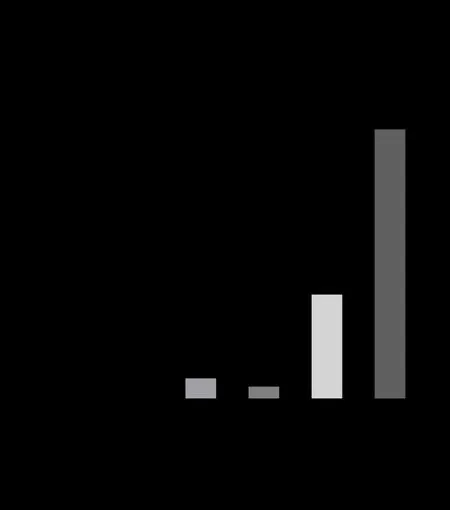
图4 CBX4前列腺增生细胞和癌细胞系的mRNA表达 水平Figure 4.Levels of CBX4 mRNA in Prostate Hyperplasia Cells and Cancer Cell Lines
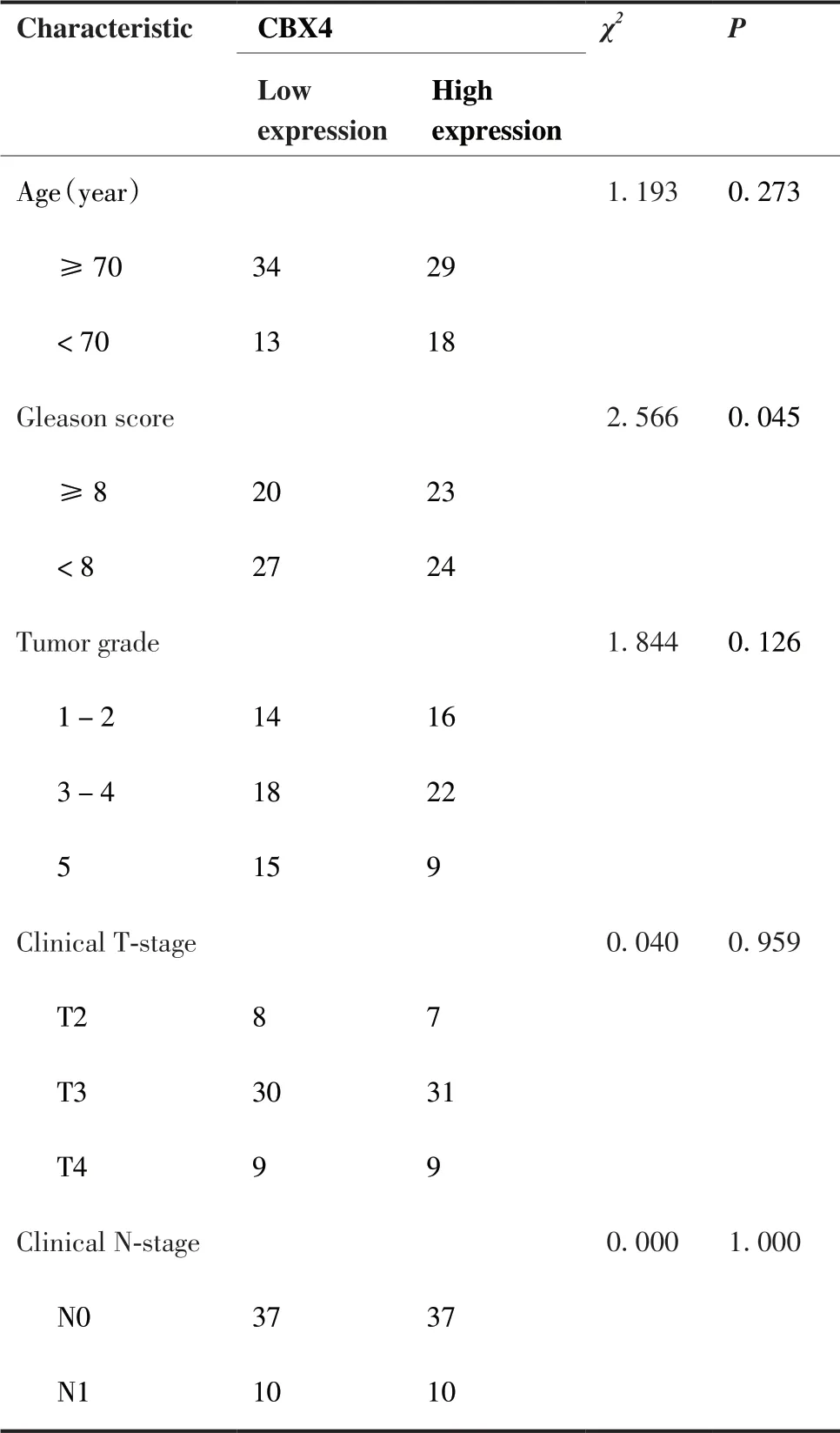
表2 CBX4的表达与前列腺癌临床病理参数的关系Table 2.Correlation between CBX4 Expression and Clinicopathologic Characteristics of Prostate Cancer Patients
2.5 CBX4对前列腺癌细胞线粒体和内质网的影响
基于CBX4在前列腺癌细胞的表达结果,选择22RV1细胞作为细胞水平功能实验的细胞,分别感染CBX4慢病毒载体LV-shCBX4和LV-ctrl,RT-qPCR和Western blot 检测CBX4的干扰效果。如图5A和5B所示,LV-shCBX4能够明显降低22RV1细胞中CBX4的表达水平。透射电镜下的线粒体的变化显示,与LV-ctrl组比较,LV-shCBX4的线粒体皱缩,膜密度增加(图5C)。以上结果表明下调CBX4的表达加剧线粒体的皱缩,揭示CBX4负性调控铁死亡。
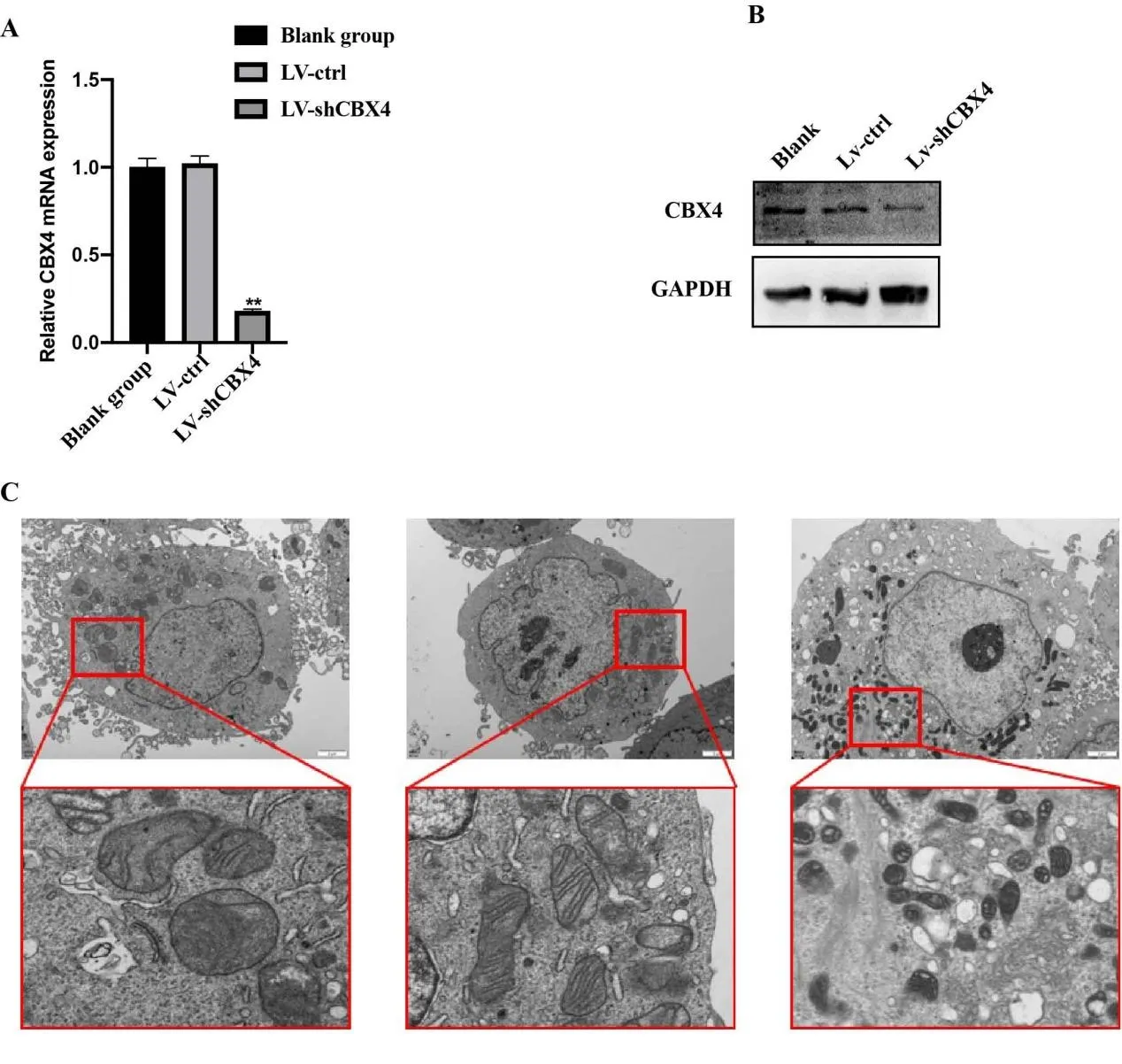
图5 干扰CBX4表达对前列腺癌细胞铁死亡的影响Figure 5. Effect of CBX4 Interference on Ferroptosis of Prostate Cells
2.6 CBX4对铁死亡关键分子SLC7A11表达的影响
由于胱氨酸转运蛋白SLC7A11是铁死亡的关键负性调控蛋白,抑制其表达能够诱发肿瘤细胞发生铁死亡[10]。因此,下调CBX4的表达后,实时荧光定量PCR检测SLC7A11的表达变化。如图6所示,与正常组及LV-ctrl组比较,LV-shCBX4组的SLC7A11表达明显下调,差异有统计学意义(P < 0.01)。
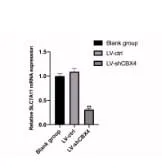
图6 干扰CBX4的表达对SLC7A11表达的影响Figure 6.Effect of CBX4 Interference on the Level of SLC7A11 mRNA Expression
3 讨 论
前列腺癌是危害男性健康的常见肿瘤之一,早期临床症状不典型,确诊时多数患者已是中晚期[11]。目前临床对于前列腺癌的治疗方法为手术切除结合内分泌治疗、放疗、化疗等,能够延长部分患者的生存期,但部分患者会因为肿瘤复发和转移而导致临床结局不理想。因此,深入探究前列腺癌的分子发病机制,对临床的早期诊断和治疗具有关键的临床意义。
CBX4具有重要的SUMO泛素连接酶活性。研究表明CBX4参与促进实体肿瘤发生发展[12-13],且在多种肿瘤中表达异常,如骨肉瘤[14]、肝癌[15]、结直肠癌[16]及食管鳞状细胞癌[17]等。另外,CBX4通过泛素化调节低氧诱导因子1a的转录活性进而调控肿瘤血管生成[18];CBX4可与HDAC3的相互作用来抑制转录因子Runx2的表达,进而调控结直肠癌的迁移和侵袭能力[16];CBX4的异常高表达促使肝癌患者易发生多柔比星耐药[19]。然而,CBX4在前列腺癌中发挥的生物学功能未见报道,有待深入探究。
本研究首先利用Oncomine数据库分析发现,有5项研究显示CBX4在前列腺癌中显著高表达;进一步对这部分研究进行Meta及散点图分析,得到的结果一致。然后,我们运用TCGA来源数据库UALCAN证实,CBX4在前列腺癌的表达明显高于正常前列腺组织,且通过HPA数据库从蛋白水平证实了这一结论。为增加生物信息数据库结论的准确性,我们再次利用免疫组织化学方法检测临床患者组织芯片中CBX4在前列腺癌及前列腺癌旁组织的表达情况,并通过实时荧光定量PCR检测前列腺癌细胞及增生细胞CBX的mRNA水平。结果显示,前列腺癌组织中的CBX4表达高于癌旁组织,并且CBX4高表达于转移性激素敏感型前列腺癌细胞系LNCap和22RV1,而在转移性去势抵抗性前列腺癌细胞PC3和DU145中呈低表达,表明CBX4的表达可能与前列腺癌雄激素治疗敏感性有关,提示CBX4可能为参与前列腺癌发生和发展的重要分子,为后期的进一步实验奠定了基础。为分析CBX4在前列腺癌中可能涉及的临床意义,我们通过UALCAN数据库发现,CBX4的表达与前列腺癌的Gleason分数、淋巴结转移呈正相关,且CBX4的表达与前列腺癌的生存期呈负相关;临床样本组化结果显示,CBX4的表达与前列腺癌的Gleason分数具有密切相关性。以上研究结果表明CBX4可能为前列腺癌诊疗的关键生物学标志物。
近年来的研究证实,铁死亡与多种疾病,如肿瘤、神经系统疾病、缺血再灌注损伤、肾脏损伤、血液病等多种疾病的病理过程密切相关。热休克蛋白β-1过度表达可抑制erastin诱导的前列腺肿瘤细胞的铁死亡[20];前列腺癌中,ZNF217的高表达能导致细胞中转铁蛋白的含量降低,结果是细胞内铁含量增加,促进了前列腺肿瘤细胞的生长[21]。以上研究揭示铁死亡为临床前列腺癌潜在治疗靶点,因此研究铁死亡的调控机制具有重要的临床意义。本研究确定CBX4高表达于前列腺癌细胞后,利用慢病毒干扰技术下调CBX4的表达,运用透射电镜形态学观察线粒体的改变,发现线粒体皱缩,膜密度增加,揭示CBX4调控前列腺癌的铁死亡;进一步检测CBX4调控的铁死亡分子发现,CBX4干扰组的SLC7A11表达明显被抑制。但具体的分子机制待后期进一步探究。以上结果提示CBX4可能通过对外源性胱氨酸/谷氨酸反向转运体的关键蛋白SLC7A11的调控进而抑制前列腺癌的铁死亡。
综上所述,本研究通过生物信息数据库分析和细胞水平实验证实,CBX4在前列腺癌中的表达上调,与前列腺癌的临床病理参数Gleason评分、淋巴结转移密切相关,且影响前列腺癌患者的预后,与生存期呈负相关关系;进一步发现前列腺癌中可能存在CBX4/SLC7A11信号轴调控铁死亡。以上研究或可为前列腺癌患者的早期诊断和靶向治疗提供更为精准的分子标志物和靶点。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

