超声辅助低共熔溶剂提取柴胡皂苷工艺及其抗氧化活性研究
谭天宇冯军军景正义贺锋张帆杜鹏飞王守经王静李腾飞
(1.河北工程大学生命科学与食品工程学院/邯郸市天然产物与功能食品开发重点实验室,河北 邯郸 056038;2.山东省农业科学院农产品加工与营养研究所/山东省农产品精深加工技术重点实验室/农业农村部新食品资源加工重点实验室,山东 济南 250100;3.河北工程大学材料科学与工程学院,河北 邯郸 056038)
柴胡为伞形科植物柴胡(Bupleurum chinenseDC.)或狭叶柴胡(Bupleurum scorzonerifoliumWilld.)的干燥根,别名地熏、山菜、柴草等,味辛、苦,性微寒[1]。柴胡皂苷为柴胡中的有效成分,在药典中规定柴胡中所含柴胡皂苷a(saikosaponin a,SSa)和柴胡皂苷d(saikosaponin d,SSd)的总量不得少于0.30%,并以两者为指标控制柴胡品质[2]。柴胡皂苷具有抗肿瘤、抗炎、抗癫痫和护肝等功效[3]。柴胡皂苷传统提取方法有乙醇加热回流法[4]、水提法[5]、超临界提取法[6]等,存在提取率低、设备成本高、提取时间长及水溶性杂质干扰等问题。因此有必要寻找一种绿色、高效的新型溶剂替代传统溶剂,突破当前柴胡皂苷提取的技术瓶颈。
低共熔溶剂(deep eutectic solvents,DESs)作为一种代替有机溶剂和离子液体的新型溶剂,由Abbott等[7]在2003年首次合成。DESs被定义为至少由两个组分组成的混合物,其中一个组分起氢键受体(HBA)的作用,另一个组分起氢键供体(HBD)的作用[8]。混合物的各组分能够通过氢键相互作用,形成新的共晶相,其特征是沸点低于每一组分的沸点[9]。低共熔溶剂具有制备简单、价格低廉、低挥发性、环境友好等优点,近年来被广泛用于食品及中药活性成分提取、分离[10,11]。Fan等[12]采用疏水性天然醇的DES对奎宁进行提取,DES表现出很高的提取能力,萃取后的DES相可以重复使用,可用1.0%乙酸水溶液作为萃取溶剂,通过反萃取从DES相中回收奎宁;Mankar等[13]用氯化胆碱(ChCl)-羧酸基DESs在微波照射下从椰壳中提取木质素,在合成的DESs中,ChCl∶乳酸(1∶4)的木质素产率最高,为82%,纯度>95%;Chen等[14]使用超声协同天然低共熔溶剂提取芒果皮果胶,与HCl提取的果胶相比,两种DES提取的果胶产率、分子量和粒径显著提高。当前,低共熔溶剂在天然产物活性成分提取方面显示了巨大的优势和潜力,因此将其拓展应用于皂苷类成分的提取值得进一步研究。
为寻求柴胡皂苷绿色高效提取工艺,本研究采用超声辅助-DES法,通过低共熔溶剂筛选以及单因素试验、响应面设计试验探究柴胡皂苷的最佳提取工艺,实现对柴胡皂苷的高效提取,同时对比不同提取方法得到的柴胡皂苷抗氧化活性,为后续柴胡原料品质评价提供技术支撑。
1 材料与方法
1.1 材料与仪器设备
柴胡药材,产自甘肃,购于药材市场,经邯郸学院焦云红副教授鉴定为北柴胡的干燥根。
柴胡皂苷d标准品(HPLC≥98%),上海源叶生物科技有限公司;对二甲氨基苯甲醛、氯化胆碱、乙二醇、木糖醇、苹果酸、乳酸、尿素、无水乙醇、磷酸,分析纯;甲醇,色谱纯;D101大孔吸附树脂,天津百伦斯生物技术有限公司;1,1-二苯基-2-三硝基苯肼、2,2-二氮-双(3-乙基苯并噻唑-6-磺酸),合肥巴斯夫生物科技有限公司。
JA5003电子天平,上海舜宇恒平科学仪器有限公司;FW100高速粉碎机,天津市泰斯特仪器有限公司;SP200-2T智能磁力加热搅拌器,杭州米欧仪器有限公司;UV-2700紫外可见分光光度计,岛津仪器(苏州)有限公司;SB25-12DTD超声波清洗机,宁波新芝生物科技股份有限公司;C-ARE旋转蒸发器,上海舍岩仪器有限公司;TG16高速离心机,上海卢湘仪离心机仪器有限公司;NDJ-8S旋转粘度计,上海昌吉地质仪器有限公司;傅里叶红外光谱仪,天津港东科技股份有限公司;DZF-6050真空干燥箱,上海新苗医疗器械制造有限公司。
1.2 试验方法
1.2.1 DES的制备 采用加热搅拌法制备DES[7]。选用氯化胆碱作为氢键受体,分别与乙二醇、木糖醇、苹果酸、乳酸、尿素5种氢键供体按一定的摩尔比混合(表1),加入一定量去离子水,80℃磁力搅拌直至溶液澄清,冷却至室温,备用。

表1 低共熔溶剂种类及配比
1.2.2 DES表征 粘度:将制备好的5种低共熔溶剂在采用1号转子、30 r/min条件下,使用旋转粘度计进行粘度测定。
傅里叶红外光谱分析(FTIR)[15]:将乳酸、氯化胆碱和DES-4(乳酸∶氯化胆碱=2∶1)三个样品置于真空干燥箱中,70℃干燥24 h除去所有水分,用于FTIR分析。
1.2.3 柴胡皂苷提取液的制备 将柴胡粉碎过80目筛,精确称取柴胡粉末2 g,在料液比1∶40(g/mL)、80℃磁力搅拌120 min、超声15 min条件下分别用5种低共熔溶剂提取柴胡皂苷,8000 r/min离心10 min,吸取上层清液,抽滤过0.45 μm滤膜,得到柴胡皂苷提取液。
1.2.4 柴胡皂苷含量的测定 标准曲线的绘制:精确称取柴胡皂苷d标准品10.0 mg,甲醇定容至5 mL容量瓶内。准确移取2 mg/mL柴胡皂苷d标准溶液0.05、0.25、0.50、0.75、1.00 mL于1 mL容量瓶,甲醇定容至刻度,配制成0.1、0.5、1.0、1.5、2.0 mg/mL的柴胡皂苷d标准溶液。采用对二甲氨基苯甲醛乙醇溶液-磷酸显色[16],在545 nm处测定吸光值。标准曲线见图1。
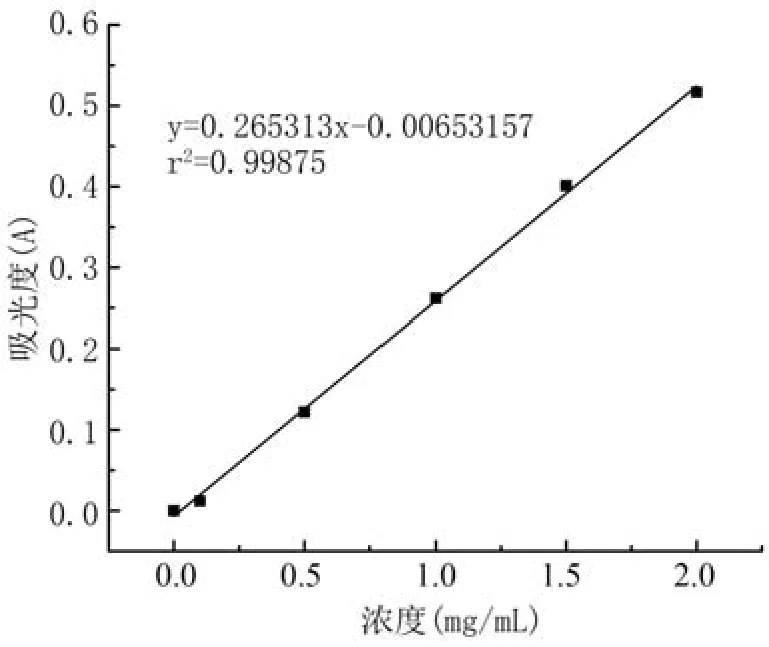
图1 柴胡皂苷d标准曲线
样品中柴胡皂苷提取量测定:取100 μL柴胡皂苷提取液并稀释至标准曲线浓度范围内,按上述方法进行显色反应,根据下式计算提取量。
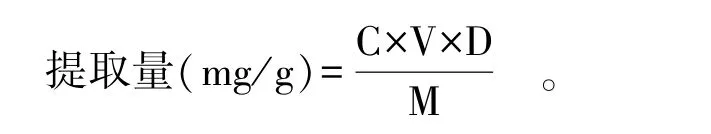
式中:C为回归方程计算得到的柴胡皂苷d浓度,mg/mL;V为上清液体积,mL;D为稀释倍数;M为原材料的质量,g。
1.2.5 超声辅助DES-4提取柴胡皂苷的单因素试验 设置低共熔溶剂体系摩尔比(乳酸∶氯化胆碱=1∶3、1∶2、1∶1、2∶1、3∶1)、料液比(1∶30、1∶40、1∶50、1∶60、1∶70 g/mL)、溶剂体系含 水量(0、10%、20%、30%、40%)、超声时间(10、15、20、25、30 min)、超声功率(60、150、240、330、420 W)5个因素,探究其对柴胡皂苷提取量的影响。
1.2.6 响应曲面法优化柴胡皂苷提取工艺 采用Box-Behnken(BB)3因素试验设计(表2),对柴胡皂苷提取工艺进行优化,确定低共熔溶剂摩尔比(A)、含水量(B)和超声时间(C)对提取量(R)的综合影响。

表2 响应面试验分析因素水平
1.2.7 不同溶剂柴胡皂苷提取效果对比 在相同条件下,用水、70%乙醇[17]与DES同时提取柴胡皂苷,计算柴胡皂苷提取量。
1.2.8 抗氧化活性测定 取不同方法所得柴胡皂苷提取液冻干,配成0.1~0.5 mg/mL样品溶液,进行DPPH·、ABTS+自由基清除试验[18]。
1.3 数据处理与分析
使用Origin 2018作图、Design-Expert V8.0.6进行响应面分析,SPSS 20.0进行显著性分析。本试验每个样品重复3次。
2 结果与分析
2.1 低共熔溶剂的筛选
DES主要通过与目标物形成分子间氢键增加其溶解度。本研究的5种DES均能与皂苷化合物形成分子间氢键,DES-1、DES-2含有大量羟基,DES-3、DES-4含有大量羧基,DES-5含有氨基[19]。如图2所示,5种低共熔溶剂中DES-4即乳酸-氯化胆碱溶剂提取效果最好,柴胡皂苷提取量为12.38±0.49 mg/g,因此采用DES-4进行柴胡皂苷的提取和进一步优化。
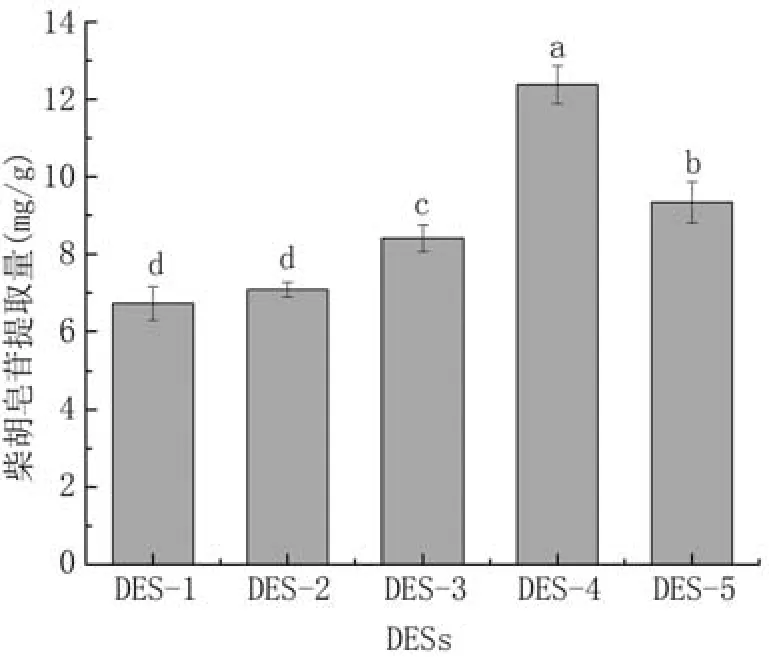
图2 DES类型对柴胡皂苷提取量的影响
2.2 低共熔溶剂表征
2.2.1 粘度 DES由配位的氢键离子和分子组成,具有很强的水相容性和吸湿性[20]。粘度大降低DESs流动性,不利于提取。加水可以降低溶剂粘度。表3表明随着温度升高DES溶剂粘度降低。
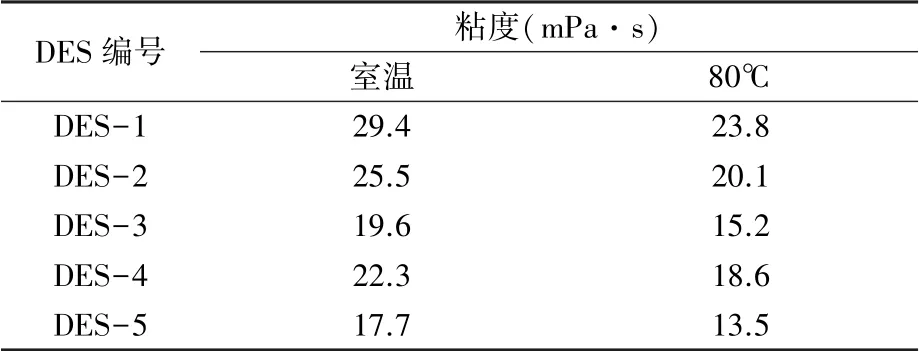
表3 DESs粘度
2.2.2 傅里叶红外光谱分析 如图3所示,氯化胆碱O-H特征峰在3253 cm-1处,3367 cm-1为乳酸O-H特征峰。而在形成DES-4后,氯化胆碱和乳酸的O-H特征峰移动到3403 cm-1,氢键位置发生了蓝移,证明乳酸和氯化胆碱通过氢键作用结合[21]。
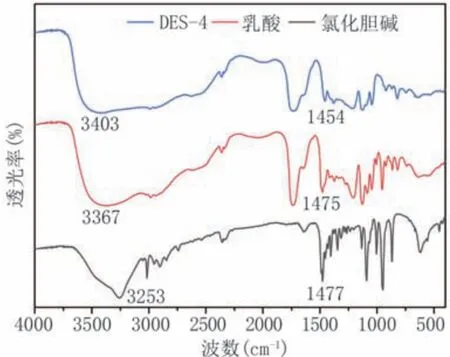
图3 DES-4傅里叶红外光谱图
2.3 单因素试验结果分析
2.3.1 DES-4组分摩尔比对柴胡皂苷提取量的影响 低共熔溶剂组分比例变化会影响粘度、极性、表面张力等物理化学性质,进而影响柴胡皂苷提取量。如图4所示,随着乳酸比例的增加,柴胡皂苷提取量增大,当乳酸-氯化胆碱摩尔比为2∶1时,提取量达到最大值。主要原因是乳酸比例的增加有效调节了乳酸-氯化胆碱体系的粘度,促进了柴胡皂苷的扩散,改善提取效率;但乳酸比例过大会减弱目标物质与低共熔溶剂的相互作用。最终选择乳酸-氯化胆碱摩尔比为2∶1进行后续试验。
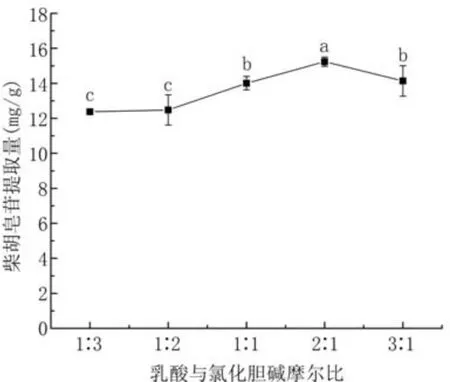
图4 DES-4组分摩尔比对柴胡皂苷提取量的影响
2.3.2 料液比对柴胡皂苷提取量的影响 如图5所示,料液比(g/mL)在1∶30到1∶40柴胡皂苷提取量呈上升趋势,1∶40时提取量最大,为15.36 mg/g,1∶50到1∶70无显著差异(P>0.05)。溶剂体积增大增加了柴胡皂苷与DES-4的接触面积,促进溶质与溶剂的结合;当溶剂体积过大,溶解度趋于平衡。本试验选择料液比1∶40 g/mL进行后续试验。
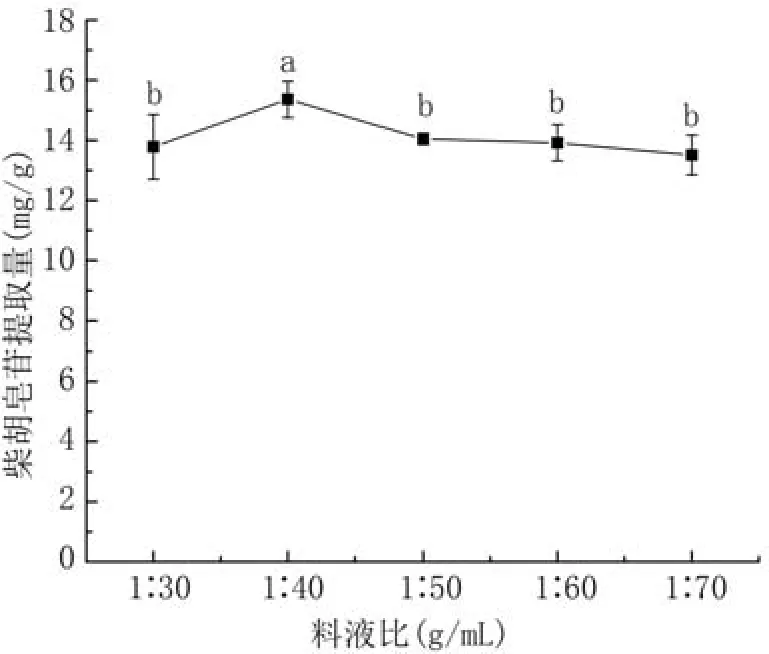
图5 料液比对柴胡皂苷提取量的影响
2.3.3 DES含水量对柴胡皂苷提取量的影响 图6所示,柴胡皂苷提取量随DES含水量加大呈先升后降变化,含水量20%时提取量达最大值,为15.09 mg/g。这是由于水的添加降低了低共熔溶剂体系粘度、增强体系极性;但水的比例过大会破坏低共熔溶剂体系中的氢键结构[17],同时降低低共熔溶剂与目标成分之间的相互作用。因此,选择DES含水量20%进行后续试验。
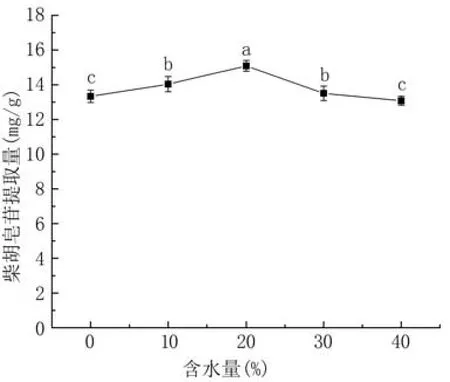
图6 DES-4含水量对柴胡皂苷提取量的影响
2.3.4 超声时间对柴胡皂苷提取量的影响 如图7所示,超声时间为10~20 min时柴胡皂苷提取量呈上升趋势,这是由于超声时间越长,超声波充分作用于柴胡粉末,破坏细胞壁,使柴胡皂苷溶出;20 min时柴胡皂苷提取量最高,为14.39 mg/g,之后有所下降。因此选择超声时间20 min进行后续试验。
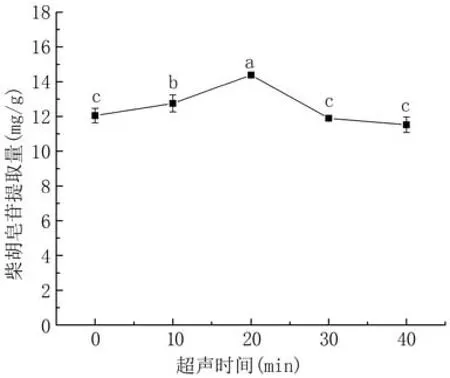
图7 超声时间对柴胡皂苷提取量的影响
2.3.5 超声功率对柴胡皂苷提取量的影响 如图8所示,提取量随着超声功率的增大先升后降,超声功率330 W时提取量达到最大,为15.32 mg/g。因为超声波会促进柴胡皂苷在溶剂体系中的扩散,使柴胡与溶剂充分反应,而功率过高,可能会对柴胡皂苷结构造成破坏,使提取率下降,导致提取量降低。因此,超声功率选择330 W。
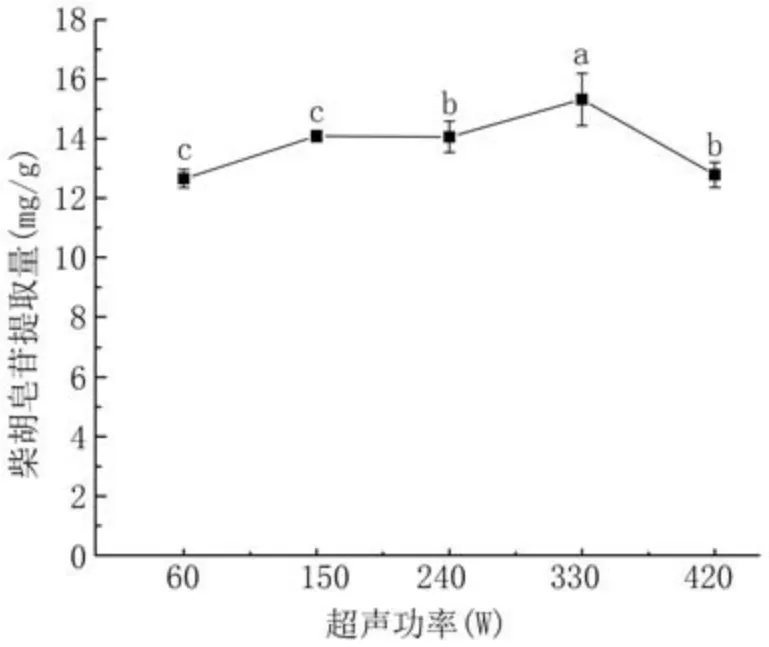
图8 超声功率对柴胡皂苷提取量的影响
2.4 响应面试验结果与分析
2.4.1 BB试验结果及方差分析 基于单因素试验结果设计三因素三水平响应面试验,选择A摩尔比、B含水量、C超声时间三个因素为自变量,以R皂苷提取量作为响应值,采用中心复合试验设计(表4),旨在实现皂苷最高提取量。对17组数据进行多元拟合回归分析,得到柴胡皂苷提取量拟合方程:
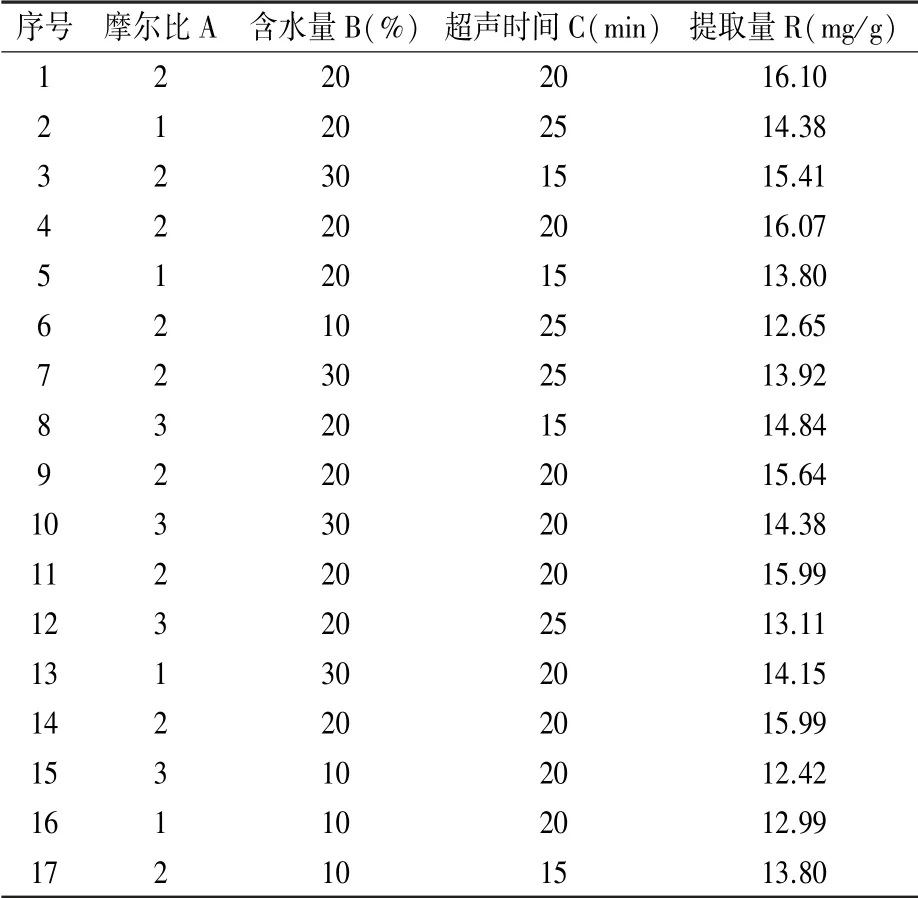
表4 试验设计与结果
提取量(R)=15.96-0.072A+0.75B-0.047C+0.20AB-0.58AC-0.086BC-1.19A2-1.28B2-0.73C2
方差分析结果(表5)显示,工艺条件对提取量影响大小为B>C>A,即含水量>超声时间>摩尔比。模型决定系数R2=0.9831,表示模型具有较高的显著性,而=0.9614,证实模型可解释实验96.14%的响应值变化,说明构建的响应模型合理,与真实数据贴合,可以用于分析柴胡皂苷提取量最优工艺。
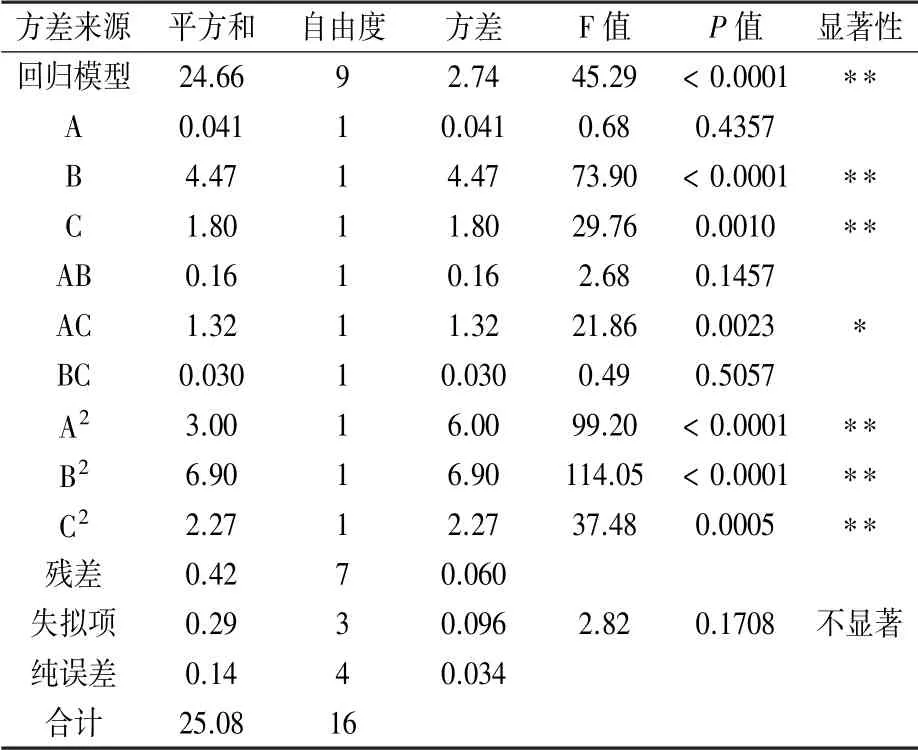
表5 提取量R方差分析
2.4.2 响应面交互分析与结果优化 从图9可以看出,摩尔比和含水量交互作用对提取量的影响呈抛物面,当其中一个因素不变时,提取量随另一因素增加先上升后下降。相较而言,含水量对提取量影响更显著,引起曲面较大幅度波动。摩尔比2∶1、溶剂体系含水量20%~25%是两者交互下的最优提取工艺组合。

图9 摩尔比和含水量交互作用对柴胡皂苷提取量影响的等高线(a)和响应曲面(b)
图10 所示摩尔比和超声时间两因素交互作用中,等高线图呈椭圆形,表明两因素交互对提取量影响显著。提取量随摩尔比和超声时间的增加均呈现先增后减变化,取适中水平即摩尔比2∶1、超声时间17~21 min时,柴胡皂苷提取量较大。
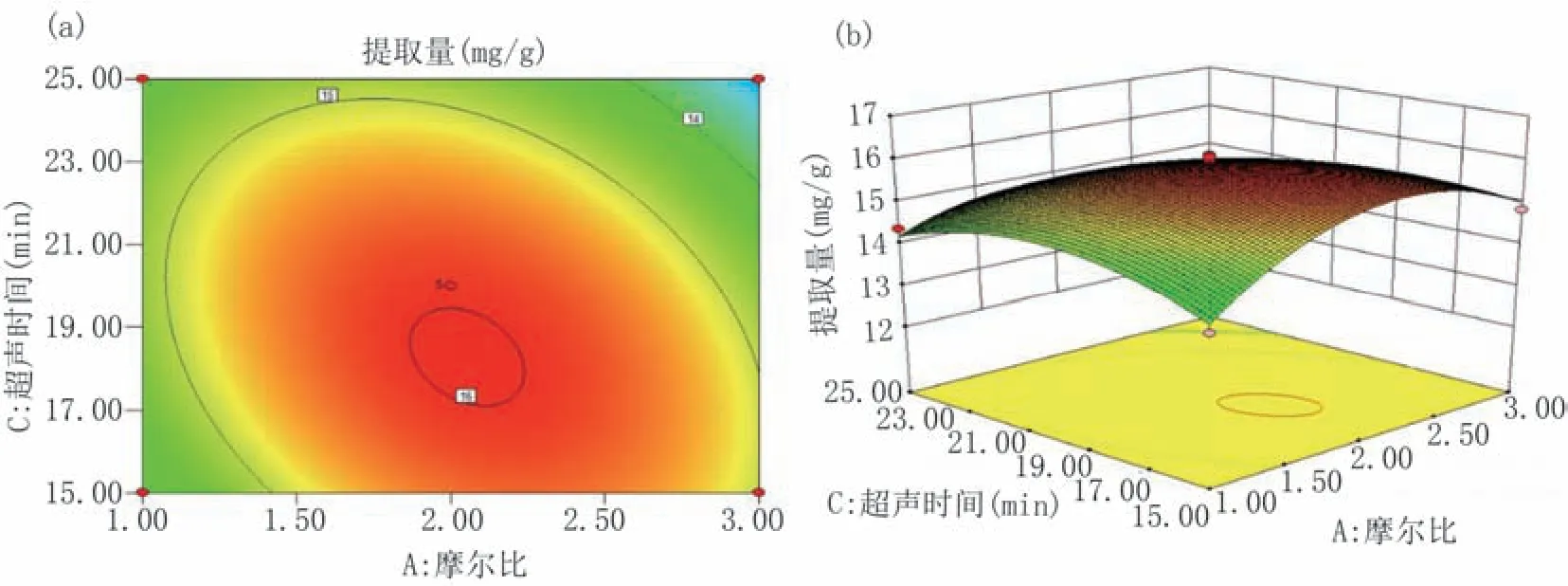
图10 摩尔比和超声时间交互作用对柴胡皂苷提取量影响的等高线(a)和响应曲面(b)
图11显示含水量为敏感影响因子,引起曲面波动较大,当含水量取20%~25%水平、超声时间取17~21 min时,提取量较高。
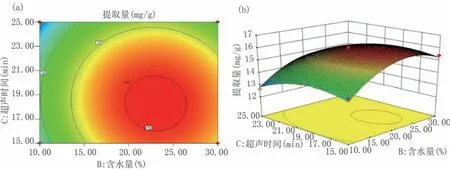
图11 含水量和超声时间交互作用对柴胡皂苷提取量影响的等高线(a)和响应曲面(b)
2.4.3 验证试验 在单因素试验确定料液比1∶40(g/mL)、超声功率330 W基础上,经响应面优化确定提取柴胡皂苷最优工艺为:乳酸∶氯化胆碱(moL/moL)=1.91∶1、含水量22.00%、超声时间17.78 min,在此条件下预测的皂苷最大提取量为16.13 mg/g。为了验证模型预测的准确性,结合实际操作,以溶剂摩尔比2∶1、含水量22%、超声时间18 min为条件进行3次平行试验,柴胡皂苷平均提取量为16.25 mg/g,与模型预估结果接近,表明该模型可用于优化柴胡皂苷提取工艺。
2.5 不同提取方法效果比较
选择水提法和乙醇提取法对比DES的柴胡皂苷提取效果。图12显示,超声辅助DES-4(乳酸∶氯化胆碱=2∶1)的柴胡皂苷提取量显著高于水提法和乙醇提取法。
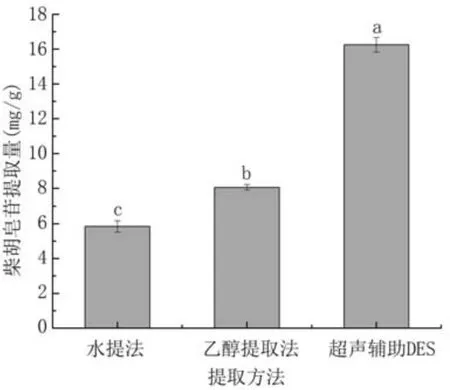
图12 不同提取方法对柴胡皂苷提取量的影响
2.6 不同方法提取的柴胡皂苷抗氧化活性
图13显示,VC在0.1~0.5 mg/mL浓度范围内均表现出较高的自由基清除能力。不同方法得到的柴胡皂苷提取物对DPPH·和ABTS+自由基均表现出一定清除能力,且随浓度升高而增强。其中,柴胡皂苷水提物、乙醇提取物、DES提取物清除DPPH·的IC50值分别为0.40、0.32、0.22 mg/mL,清除ABTS+自由基的IC50值分别为0.30、0.27、0.16 mg/mL。
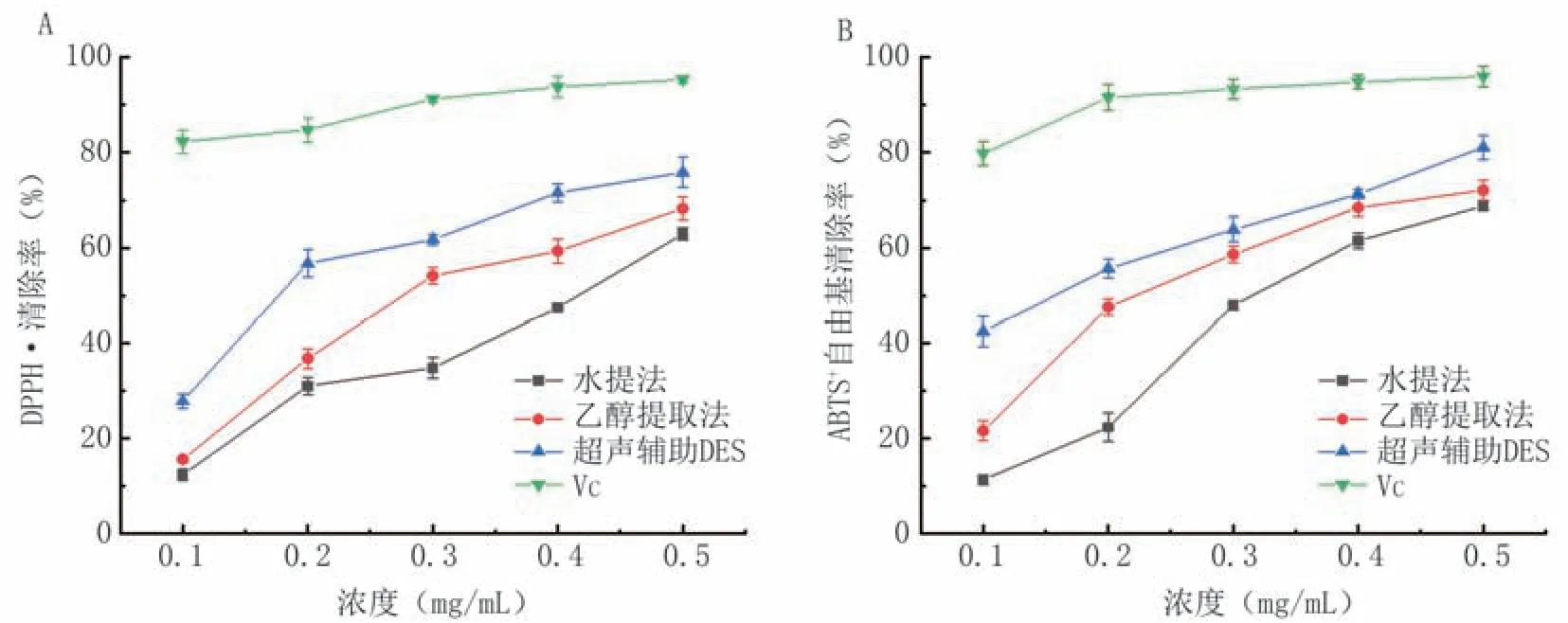
图13 不同方法提取的柴胡皂苷清除DPPH·(A)和ABTS+(B)自由基的能力
3 结论
本研究建立了一种基于低共熔溶剂超声辅助的柴胡皂苷绿色高效提取方法。采用单因素、响应面设计优化提取工艺,确定最佳提取工艺为含22%水的乳酸-氯化胆碱(摩尔比2∶1)、料液比1∶40(g/mL)、超声时间18 min、超声功率330 W,在此条件下柴胡皂苷提取量为16.25±0.42 mg/g,显著高于水提法(5.84±0.33 mg/g)和乙醇提取法(8.06±0.16 mg/g)。超声辅助-DESs柴胡皂苷提取物清除DPPH·和ABTS+自由基的IC50值分别为0.22、0.16 mg/mL,抗氧化能力高于水提物和乙醇提取物。采用DES对柴胡皂苷进行提取,工艺流程操作简便,工艺优化后柴胡皂苷得率较好。DESs的优异性能显示了其作为提取天然产物中生物活性物质溶剂的潜力。

