紫檀芪对糖尿病性白内障大鼠氧化应激和炎症反应的影响及机制
崔翠,赵军波,王敏,韩悠,李佳佳
邯郸市中心医院眼科,河北邯郸056000
糖尿病性白内障(DC)是糖尿病患者极易出现的眼病,其典型病理特征为晶状体上皮细胞异常迁移、增殖,导致囊膜下混浊,是引发视力障碍的首要因素。DC 的发生与高血糖触发的氧自由基大量积聚关系密切,另外高血糖可破坏晶状体和房水中抗氧化系统,还可引发炎症,加剧晶状体氧化损伤,降低血糖并减少氧自由基产生是延缓DC 进展的突破口[1-2]。腺苷酸活化蛋白激酶(AMPK)可调控炎症因子和氧自由基的释放,参与介导糖尿病患者体内炎症和氧化应激反应。激活AMPK 信号,促进沉默信息调节因子1(SIRT1)和过氧化物酶体增殖物激活受体γ 辅激活因子1α(PGC-1α)表达,降低血糖,减少促炎细胞因子IL-8 和活性氧的产生,抵抗肠道过氧化和炎症损伤[3]。糖尿病患者晶状体上皮细胞中AMPK 的磷酸化显著减弱,且抗氧化酶活性降低、晶状体上皮细胞发生迁移,其与DC 形成有关[4],因而激活AMPK/SIRT1/PGC-1α 信号通路可能具有防治DC的潜力。紫檀芪是天然二苯乙烯类产物,具有抗氧化、抗炎与调节糖脂代谢的作用,可升高SIRT1蛋白表达,减轻糖尿病小鼠肾脏炎症[5],抑制氧化应激引起的关节软骨细胞凋亡[6]。但紫檀芪是否通过调节AMPK/SIRT1/PGC-1α 信号通路减轻DC 大鼠氧化应激反应,进而延缓DC 进展,目前尚无明确阐述。2021 年10 月—2022 年1 月,本研究以紫檀芪干预DC 大鼠,探讨其对大鼠氧化应激和炎症反应的影响及可能的机制。
1 材料与方法
1.1 动物、试剂及仪器 SD 雄性大鼠76 只,SPF级,由北京唯尚立德生物科技有限公司提供,体质量264~280 g,10 周龄,动物生产许可证号:SCXK(京)2021-0010。所有大鼠在本院独立动物房中适应性饲养,室温和湿度分别设为23~25 ℃、55%~65%,每天保持通风换气8~10 h,明暗各12 h循环光照,适应性饲养1 周后进行实验。本研究经医院伦理委员会批准,批准号:伦审-2021-093。紫檀芪标准品(纯度≥98%,批号SP9570)、AMPK 抑制剂(Dorsomorphin)(纯度≥98%,批号IB0330)、链脲佐菌素标准品(纯度:HPLC≥98%,批号SS9500)均购自北京索莱宝科技有限公司;高强度RIPA 裂解液(批号W062-1-1)、苏木精-伊红(HE)染色试剂盒(批号D006-1-4)、丙二醛(MDA,批号A003-1-2)、超氧化物歧化酶(SOD,批号A001-3-2)、谷胱甘肽过氧化物酶(GSHPx,批号A005-1-2)、IL-6(批号H007-1-2)、IL-17(批号H014-1)、IL-10(批号H009-1)检测试剂盒、BCA总蛋白定量测定试剂盒(批号A045-4-2)均购自南京建成生物工程研究所有限公司;兔源抗大鼠波形蛋白(Vimentin)一抗(批号AF1975)、N-钙黏蛋白(Ncadherin)一抗(批号AF5237)、E-钙黏蛋白(E-cadherin)一抗(批号AF6759)、AMPK 一抗(批号AF6195)、磷酸化AMPK(p-AMPK)一抗(批号AF5908)、SIRT1 一抗(批号AF5300)、PGC-1α 一抗(批号AF7736)、山羊抗兔二抗(批号A0208)均购自上海碧云天生物技术有限公司;兔源抗大鼠GAPDH一抗(批号ab181602)购自美国Abcam 公司。手持裂隙灯(型号KJ5S3)购自苏州康捷医疗股份有限公司;血糖仪(型号One Touch Ⅱ)购自美国强生公司;倒置双目生物显微镜(型号LW200ET-A)购自上海尖端光电科技有限公司;组织脱水机(型号MTP)、石蜡切片机(型号CUT4062)均购自德国SLEE公司;酶标仪(型号680)、基础电泳仪(型号PowerPacTM)、化学发光成像系统(型号ChemiDoc MP)均购自美国Bio-Rad公司。
1.2 DC 模型构建及药物干预 取64 只大鼠制备DC 模型,方法参照文献[7]:以柠檬酸缓冲液溶解配制质量分数为1%链脲佐菌素溶液,以60 mg/kg 的剂量腹腔内注射,72 h 后通过尾静脉取血测量大鼠空腹血糖,取血糖≥16.7 mmol/L 的糖尿病大鼠继续饲养,6 周后采用裂隙灯观察大鼠晶状体,当出现空泡并有乳白色絮状混浊时表示DC 模型构建成功。共60 只造模成功,将其随机分为模型组及紫檀芪低剂量组、紫檀芪中剂量组、紫檀芪高剂量组[8]、紫檀芪高剂量+Dorsomorphin组各12只,另取12只正常大鼠作为对照组。将紫檀芪和Dorsomorphin 溶于0.9%氯化钠溶液中,分别配制浓度为2、4、8 mg/mL 紫檀芪溶液及0.02 mg/mL Dorsomorphin 溶液。紫檀芪低、中、高剂量组分别给予2、4、8 mg/mL紫檀芪溶液灌胃(10 mL/kg),同时给予0.9%氯化钠溶液尾静脉注射(10 mL/kg);紫檀芪高剂量+Dorsomorphin 组给予8 mg/mL 紫檀芪溶液灌胃(10 mL/kg),同时给予0.02 mg/mL Dorsomorphin 溶液尾静脉注射(10 mL/kg)[8-9];模型组、对照组均给予0.9%氯化钠溶液灌胃(10 mL/kg),同时给予0.9%氯化钠溶液尾静脉注射(10 mL/kg)。各组大鼠均每天按上述方式给予药物干预1次,共干预14 d。
1.3 大鼠空腹血糖检测及晶状体混浊情况评价 第14天给药干预后24 h,采集大鼠尾静脉血,使用血糖仪测量大鼠空腹血糖。然后手持裂隙灯观察各组大鼠晶状体混浊情况,遵照以下标准评分[10]:晶状体清透明亮,无混浊,计1分;晶状体周围出现少量空泡,发生轻度混浊,计2分;晶状体周围空泡扩散至中心区,核区出现雾状混浊,发生中度混浊,计3分;晶状体周围空泡扩散至核区,核区雾状混浊加重,发生高度混浊,计4 分;晶状体核区混浊,形成完全性白内障,计5分。
1.4 大鼠晶状体标本采集及其组织结构变化观察 以上检测结束后,用乙醚气体麻醉大鼠,采集其尾静脉血并在4 ℃下1 500 r/min离心15 min(离心半径10 cm),吸出上清液于-80 ℃保存。脱颈快速杀死大鼠,摘下眼球剥离出双侧晶状体,左侧晶状体称质量后剪碎加入适量高强度RIPA裂解液,冰上充分研磨成浆,在4 ℃下3 000 r/min离心20 min,吸出上清液于-80 ℃保存;右侧晶状体漂洗后浸入4%多聚甲醛溶液中充分固定,运用组织脱水机、基础性石蜡包埋系统、石蜡切片机进行脱水包埋后切片,将所得约5 μm厚的晶状体组织切片脱蜡,以梯度乙醇溶液水化后采用HE染色,最后封片观察晶状体组织结构变化。
1.5 大鼠晶状体组织中氧化应激指标(MDA、SOD、GSH-Px)及血清炎症指标(IL-6、IL-17、IL-10)检测 于4 ℃冰箱中解冻采集的大鼠血清及晶状体组织样品液,各取出0.4 mL,使用比色法测定晶状体组织中MDA、SOD、GSH-Px,采用酶联免疫吸附法检测大鼠血清IL-6、IL-17、IL-10,具体步骤严格按照各自试剂盒操作说明书进行。
1.6 大鼠晶状体组织中上皮间质转化标志蛋白(Vimentin、N-cadherin、E-cadherin)及AMPK/SIRT1/PGC-1α 信号通路蛋白表达检测 取以上检测剩余的晶状体组织样品液,采用BCA 总蛋白定量测定试剂盒测出各组蛋白总浓度,取20 μg 蛋白,以适量上样缓冲液混匀后加热变性,电泳(110 V,90 min)后电转(40 mA,70 min),使蛋白按分子量大小分离开后移至聚偏氟乙烯膜上,5%脱脂奶粉封闭1.5 h,添加Vimentin(1∶300)、N-cadherin(1∶300)、E-cadherin(1∶300)、AMPK(1∶400)、p-AMPK(1:400)、SIRT1(1∶200)、PGC-1α(1∶200)、GAPDH(1∶500)一抗孵育过夜,再加入山羊抗兔二抗(1∶2 000)37 ℃孵育1.5 h,用TBST 溶液清洗3 次,使用化学发光液显色后拍摄图像,用Image J 软件分析图像中各蛋白灰度值。目标蛋白相对表达量=目标蛋白灰度值/内参蛋白灰度值。
1.7 统计学方法 采用SPSS25.0 统计软件。计量资料用表示,多组间比较采用单因素方差分析,进一步两两比较行SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 紫檀芪对大鼠空腹血糖和晶状体混浊的影响 见表1。
表1 各组空腹血糖和晶状体混浊评分比较()
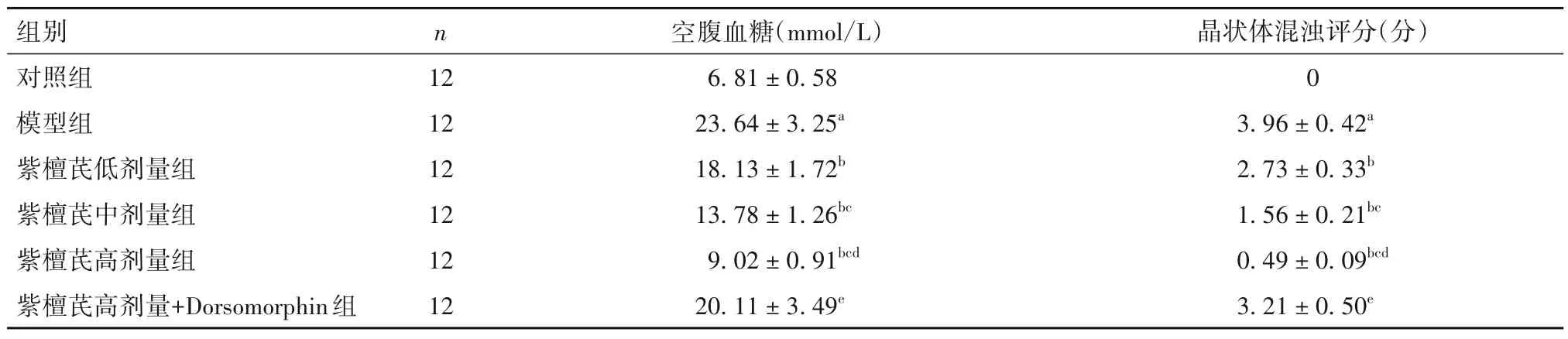
表1 各组空腹血糖和晶状体混浊评分比较()
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与紫檀芪低剂量组比较,cP<0.05;与紫檀芪中剂量组比较,dP<0.05;与紫檀芪高剂量组比较,eP<0.05。
2.2 紫檀芪对大鼠晶状体组织结构的影响 对照组大鼠晶状体上皮细胞形态规则,均匀整齐分布于晶状体前囊和赤道部;模型组大鼠晶状体上皮细胞呈片状、条索状向晶状体成纤维细胞迁移聚集;紫檀芪低、中、高剂量组大鼠晶状体上皮细胞上述形态改变及迁移聚集现象得到改善,且随紫檀芪剂量升高而改善程度增强;紫檀芪高剂量+Dorsomorphin 组大鼠晶状体上皮细胞上述形态改变及迁移聚集现象相比紫檀芪高剂量组加重。见图1。
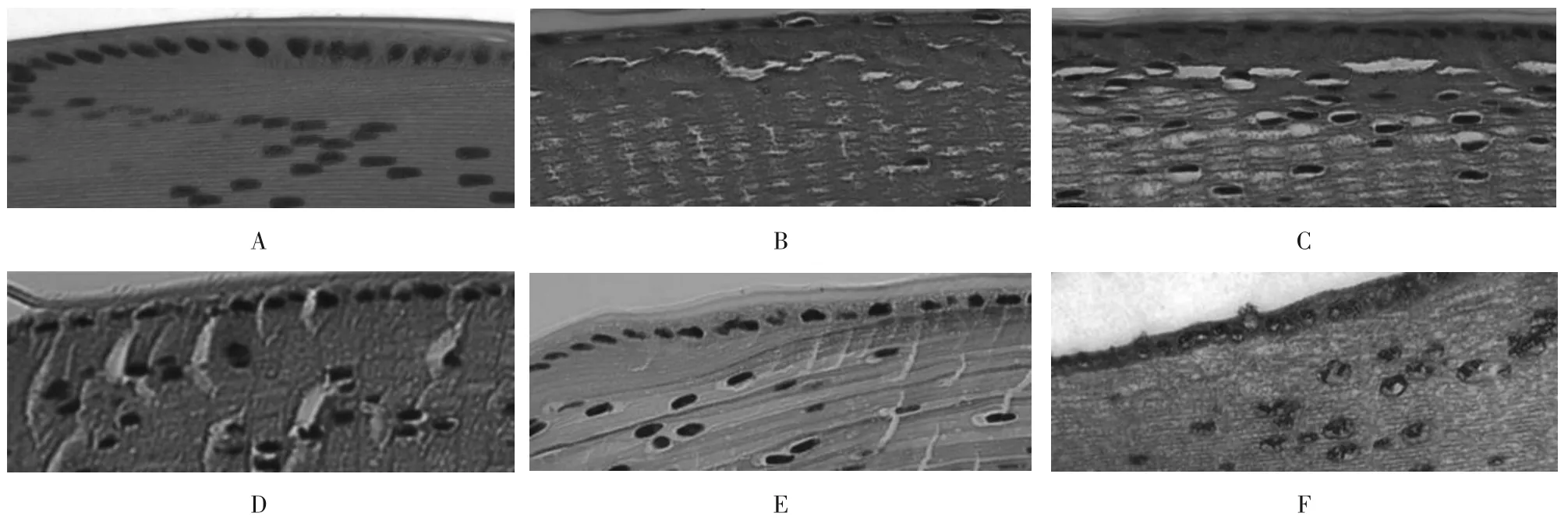
图1 各组大鼠晶状体组织结构变化(HE染色×200)
2.3 紫檀芪对大鼠晶状体组织中氧化应激指标水平的影响 见表2。
表2 各组晶状体组织中氧化应激指标水平比较()

表2 各组晶状体组织中氧化应激指标水平比较()
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与紫檀芪低剂量组比较,cP<0.05;与紫檀芪中剂量组比较,dP<0.05;与紫檀芪高剂量组比较,eP<0.05。
2.4 紫檀芪对大鼠血清炎症指标水平的影响 见表3。
表3 各组血清炎症指标水平比较(pg/mL,)

表3 各组血清炎症指标水平比较(pg/mL,)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与紫檀芪低剂量组比较,cP<0.05;与紫檀芪中剂量组比较,dP<0.05;与紫檀芪高剂量组比较,eP<0.05。
2.5 紫檀芪对大鼠晶状体组织中上皮间质转化标志蛋白表达的影响 见表4。
表4 各组晶状体组织中上皮间质转化标志蛋白表达比较()

表4 各组晶状体组织中上皮间质转化标志蛋白表达比较()
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与紫檀芪低剂量组比较,cP<0.05;与紫檀芪中剂量组比较,dP<0.05;与紫檀芪高剂量组比较,eP<0.05。
2.6 紫檀芪对大鼠晶状体组织中AMPK/SIRT1/PGC-1α信号通路蛋白表达的影响 见表5。
表5 各组晶状体组织中p-AMPK/AMPK、SIRT1、PGC-1α蛋白表达比较()
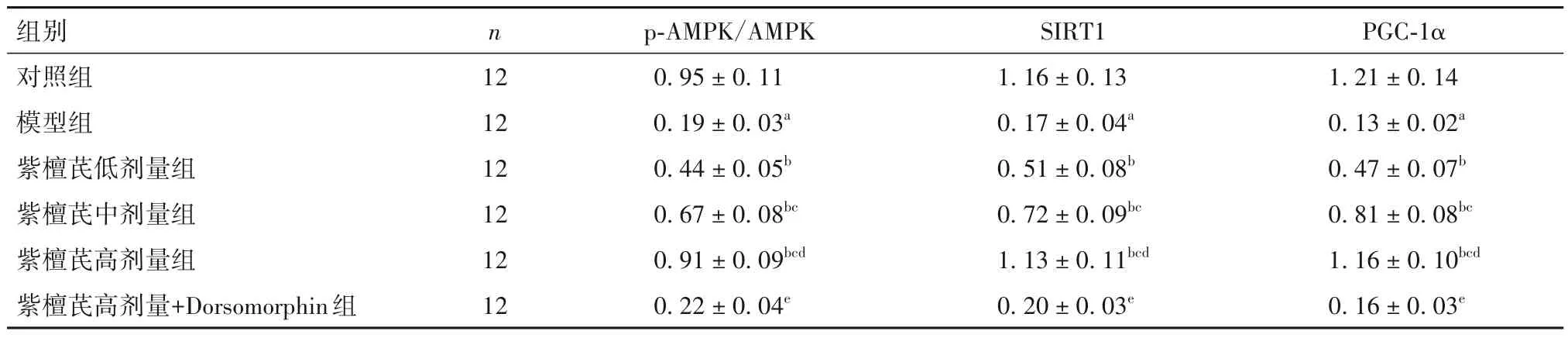
表5 各组晶状体组织中p-AMPK/AMPK、SIRT1、PGC-1α蛋白表达比较()
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与紫檀芪低剂量组比较,cP<0.05;与紫檀芪中剂量组比较,dP<0.05;与紫檀芪高剂量组比较,eP<0.05。
3 讨论
预防和控制DC 发生及进展是目前临床面临的严峻挑战。手术是DC 最主要的治疗手段,但存在出血、感染、视网膜病变等风险,因此探寻有效药物控制血糖、延缓白内障进展意义重大[11]。本研究向大鼠腹腔内注射链脲佐菌素构建DC 模型,结果显示,链脲佐菌素可显著升高大鼠空腹血糖,促使炎症因子IL-6 与IL-17 大量生成,减少抗炎因子IL-10 产生,损害大鼠晶状体组织抗氧化功能,导致其脂质过氧化产物MDA 大量形成,增强晶状体上皮细胞上皮间质转化,引发其呈片状、条索状向晶状体成纤维细胞迁移聚集,导致晶状体混浊,最终引起DC 发生发展,模型建立成功。
DC 发病机制复杂,氧自由基产生、降解失衡导致的应激反应和氧化损伤是其主要致病原因。糖尿病患者的高血糖不仅诱导氧自由基和促炎因子过量生成,还损害机体抗氧化和抗炎功能,导致并加重晶状体炎症和氧化损伤,引起晶状体浑浊,拮抗炎症和氧化应激反应是防治DC 的主要病理学基础[12]。紫檀芪是能降脂、抑炎抗菌及抗氧化的天然化合物,能通过上调SIRT1表达而减轻糖尿病小鼠肾脏炎症损伤[5],并通过阻止氧化应激抑制关节软骨细胞凋亡[6],还可通过促进SIRT1 表达而减轻高糖缺氧复氧引起的肾近曲小管细胞损伤[13]。本研究以不同剂量紫檀芪干预DC 模型大鼠,可降低其空腹血糖、晶状体混浊情况评分、血清IL-6 与IL-17 水平、晶状体组织中MDA 与Vimentin、N-cadherin 蛋白表达水平,升高晶状体组织中SOD 与GSH-Px 水平、血清IL-10水平、晶状体组织中E-cadherin 蛋白表达水平,改善大鼠晶状体上皮细胞片状、条索状形态改变及迁移聚集现象。表明紫檀芪可降低促炎因子表达,增强抗炎因子表达和抗氧化酶活性,减弱DC 大鼠体内炎症和氧化应激,缓解晶状体上皮细胞片状、条索状形态改变及迁移聚集,改善晶状体混浊症状,延缓DC进展,并随剂量升高而作用增强。
AMPK/SIRT1/PGC-1α 信号通路通过调控炎症和氧化应激在细胞凋亡、衰老及线粒体功能维持中起着关键作用。激活该信号,可减少炎症介质、活性氧和脂质过氧化产物生成,消除神经炎症和氧化应激,改善乳酸脱氢酶-B 敲除小鼠神经退行性病变[14],并可通过抗氧化及抗炎作用改善衰老相关的肾功能损伤[15];另外通过激活AMPK 可减轻氧化应激诱导的人晶状体上皮细胞衰老,缓解年龄相关性白内障形成和发展[16]。本研究结果显示,DC大鼠晶状体组织中p-AMPK/AMPK 及SIRT1、PGC-1α 蛋白表达水平显著降低,以紫檀芪干预DC 大鼠,可升高其晶状体组织中AMPK 磷酸化及SIRT1、PGC-1α 蛋白表达,表明AMPK/SIRT1/PGC-1α 信号参与介导紫檀芪对DC 大鼠的治疗过程。以高剂量紫檀芪干预DC 大鼠的同时,采用AMPK 抑制剂Dorsomorphin抑制AMPK/SIRT1/PGC-1α 信号激活可减弱紫檀芪的抗炎及抗氧化活性,抵抗其对DC 大鼠晶状体上皮细胞形态改变及迁移聚集现象的改善,最终逆转紫檀芪对大鼠晶状体混浊等白内障症状的缓解作用。揭示紫檀芪是通过激活AMPK/SIRT1/PGC-1α信号通路减轻DC 大鼠氧化应激反应,延缓其白内障进展的。
综上所述,紫檀芪可显著减少DC 大鼠体内氧自由基及炎性介质生成,消除晶状体炎症和过氧化反应,减轻晶状体上皮细胞的片状、条索状形态改变,改善其向晶状体成纤维细胞迁移聚集及晶状体混浊,延缓白内障进展,促进AMPK/SIRT1/PGC-1α信号通路激活传导是其作用机制之一。本研究为DC的临床治疗带来了新的候选药物,有益于糖尿病眼部并发症的防治。

