清热养阴除湿丸调控焦亡通路治疗痛风的作用机制
温 博 马 丛 张 秦 施 阳 刘密凤 霍晓萌 顾 文 邵培培
(首都医科大学附属北京中医医院风湿病科,北京,100010)
痛风是与循环中尿酸过多导致单钠尿酸盐结晶沉积于组织有关的一种代谢性疾病[1]。急性痛风性关节炎(Acute Gouty Arthritis,AGA)是开始于滑膜的剧烈炎症反应,单钠尿酸盐结晶沉积于关节及周围组织,以炎症细胞浸润、关节肿胀和剧烈疼痛为主要临床特征的一种急性风湿性疾病。这一过程的主要组织学特征为滑膜衬里细胞增殖,以及中性粒细胞、单核细胞或巨噬细胞和淋巴细胞浸润[2]。有关痛风的发作机制研究得较为深入,巨噬细胞识别并吞噬单钠尿酸盐结晶造成无效吞噬,导致溶酶体损伤,进而引起NEK7-核苷酸结合寡聚化结构域样受体蛋白3(Nucleotide-binding Oligomerization Domain-like Receptor Protein 3,NLRP3)复合物形成,激活NLRP3炎症小体形成,释放大量白细胞介素-1β等炎症介质,是启动痛风性关节炎急性炎症反应的重要途径;另一方面,单钠尿酸盐可以通过诱导活性氧直接激活NLRP3炎症小体,促使pro-胱天蛋白酶-1(Caspase-1)成熟,切割成孔蛋白Gasdermin-D(GSDMD)的同时活化白细胞介素-1β、白细胞介素-18而介导细胞焦亡[3]。
清热养阴除湿丸是根据研究单位已故名老中医王为兰教授所创清热养阴除湿方研制的院内制剂,临床应用十余载,广泛用于多种风湿性疾病活动期的治疗,收到较好临床疗效[4-7]。清热养阴除湿丸由金银花、连翘、半枝莲、虎杖、白鲜皮、土茯苓、白芍、生熟地黄、桂枝、川乌组成。前期的研究提示清热养阴除湿丸能提高小鼠痛阈值;对小鼠炎性耳郭肿胀和足肿胀均有抑制作用,该药抗炎消肿止痛作用可能与减少炎症介质有关[8-9]。基于此,我们用改良的Coderre法制造痛风动物模型[10],观察清热养阴除湿丸对NEK7/GSDMD通路的干预情况以及相关炎症介质的影响,探讨清热养阴除湿丸可能的作用机制,为临床推广应用该药提供实验依据。
1 材料与方法
1.1 材料
1.1.1 动物 选取雄性SD大鼠50只(购自北京维通利华),体质量180~220 g,6~8周龄,合格证号(11400700382137)。分笼饲养,饲养环境室温22~24 ℃,自由饮食、饮水,自然昼夜节律光照,定期更换垫料。本研究通过伦理委员会审批(伦理审批号:IRM-DWLL-2019048)。
1.1.2 药物 尿酸钠(Sigma,美国,批号:BCBW1849);吐温80(北京索莱宝,批号:822L0419);清热养阴除湿丸(首都医科大学附属北京中医医院,批号:1811035);秋水仙碱(昆药集团股份有限公司,批号:180705-01)。
1.1.3 试剂与仪器 试剂:TIANScript RT KIT(天根生物科技有限公司,货号:Cat# KR104-02);SuperReal PreMix Plus(天根生物科技有限公司,货号:Cat# FP205);Trizol(Invitrogen,美国,货号:15596-026);BCA蛋白定量试剂盒(艾德卡公司,德国,批号:PP0102),Anti-NLRP3抗体(Ambion公司,美国,货号:ab214185),Anti-NEK7抗体(Ambion公司,美国,货号:ab133514),β-Actin antibody(天津三箭公司,批号:KM9001),Anti-ASCCantibody(santa cruz biotechnology公司,美国,货号:SC-514414),Anti-Caspase-1抗体(Ambion公司,美国,货号:ab1872),Anti-GSDMD抗体(Ambion公司,美国,货号:ab219800)。仪器:鼠足趾容积测量仪(济南益延科技发展有限公司,型号:YLS-7C),手持式匀浆机(上海净信实验设备科技部,型号:F6/10),涡旋振荡仪(海门市其林贝尔仪器制造有限公司,型号:QL-902),生物分光光度计(Eppendorf,德国,型号:BioPhotometer),荧光定量PCR仪(BIO-RAD,美国,型号:Connect CFXTM),高速离心机(Eppendorf,型号:5427R),离心机(Eppendorf,德国,型号:Centrifuge 5415D),低温离心机(Eppendorf,德国,型号:5418R),转移脱色摇床(海门其林贝尔仪器制造公司,型号:TS-8),垂直电泳槽(北京六一仪器厂,型号:DYCZ-20C),转移槽(北京六一仪器厂,型号:DYCP-40C,),显微镜(日本奥林巴斯,日本,型号:BX51T-PHD-J11),多功能真彩色细胞图像分析管理系统(Media Cybernetics公司,美国,型号:Image-Pro Plus),石蜡切片机(莱卡公司,德国,型号:RM2015)。
1.2 方法
1.2.1 分组与模型制备 用改良的Coderre法制造痛风动物模型[10]。乙醚麻醉大鼠后,用6号注射针在大鼠右侧踝关节后侧沿跟腱内侧以30°~40°方向插入至关节腔,向空白对照组大鼠右踝关节注入生理盐水50 μL,其余各组别大鼠的关节腔均注入50 μL浓度为25 g/L的尿酸钠混悬液,以关节囊对侧鼓起为注入标准,随后在关节腔注射部位涂少量红霉素软膏预防感染。连续注射生理盐水及尿酸钠溶液3 d。造模成功的表现:所有大鼠模型制备后大鼠步态、关节肿胀指数显著高于正常组,说明造模成功。将50只大鼠随机分为6组即空白对照组(BC)、模型组、清热养阴除湿丸剂低剂量观察组(MSD1)、中剂量观察组(MSD2)及高剂量观察组(MSD3)、秋水仙碱组(PC),每组8只。
1.2.2 给药方法 BC及模型组每日以生理盐水灌胃,3 mL/次,2次/d;成药清热养阴除湿丸每袋装6 g,成人用量2袋/次,3次/d;根据成人与老鼠体表面积换算关系及预实验情况,MSD2组为3.2 g/kg;秋水仙碱片每日成人最大剂量不超过6 mg,根据成人与老鼠体表面积换算关系及预实验情况,秋水仙碱用量为6×10-4g/kg。MSD1、MSD2、MSD3分别以1.6 g/kg、3.2 g/kg、6.4 g/kg的剂量给大鼠灌服清热养阴除湿丸混悬液(浓度分别为0.06 g/mL、0.12 g/mL、0.24 g/mL),3 mL/次,2次/d,连续7 d;秋水仙碱组按6×10-4g/kg的剂量给大鼠灌服秋水仙碱混悬液浓度0.02 g/L,6 mL/次,2次/d,连续7 d。其间,各组大鼠均自由饮水及正常饮食。
1.2.3 检测指标与方法 各组动物第5天灌胃1 h后,进行造模,造模6 h、12 h、24 h、48 h测量大鼠踝关节周径,计算关节肿胀指数;造模3 d后进行其他指标观察。关节肿胀指数=测定时间点关节周长-初始周长/初始周长,初始周长即0 h时周长。
在灌胃第7天即第3天诱导模型后1 h收集血清和组织样本。乙醚麻醉,无菌条件下经腹腔抽取静脉血3 mL,室温下放置20 min后,置于离心机中3 000 r/min,离心半径7 cm,离心10 min,收集血清,按照ELISA试剂盒说明书进行操作。取完血后,用颈椎脱臼法将其处死。以大鼠右后肢踝关节为中心前后0.5 cm剪断,去皮,在冰板上快速小心地分离踝关节的滑膜组织,并进行分装,一部分置于10%甲醛溶液中固定24 h以上用于免疫组织化学检测,另一部分分装入冷冻管于-80 ℃冰箱下储存用于蛋白质印迹法检测。
取出保存的踝关节滑膜组织,用Trizol提取组织样本中总RNA,取5 μLRNA用1%琼脂糖凝胶进行电泳,以检测RNA的完整性;用TIANScript RT KIT进行反转录,实验操作按产品说明书进行;将β-肌动蛋白(β-actin)作为内参基因,在CFX manager软件上按照2-△△Ct法进行基因相对定量分析。引物由生工生物工程(上海)股份有限公司合成。具体引物序列见表1。

表1 PCR引物序列
将滑膜组织剪成小块,按照每20 mg组织加200~400 μL的比例加入裂解液。用手握式电动组织细胞匀浆器匀浆约1 min或直至充分裂解。12 000 r/min,离心半径11 cm,离心10 min,取上清,用考马斯亮蓝法测定各样本蛋白含量,具体步骤参见产品说明书。制备10%分离胶,4%浓缩胶,根据蛋白定量结果,加入相应体积的总蛋白样品与5×缓冲液凝胶电泳上样,电泳,转膜,转移膜置于5%脱脂奶粉,室温、摇床上缓慢摇动状态下封闭1 h,抗体:细胞凋亡相关斑样蛋白(Apoptosis-associated Speck-like Protein,ASC)(1∶300)、Caspase-1(1∶300)、NLRP3(1∶800)、NEK7(1∶10 000)、GSDMD(1∶800)、β-actin(1∶1 000),4 ℃孵育过夜;用1×TBST洗涤3次,10 min/次,加入二抗(1∶3 000)中,室温、避光缓慢摇动作用60 min,用1×TBST洗膜3次,10 min/次;曝光及洗片后,采用Image J软件分析灰度值。
取常规制备踝关节石蜡组织切片,脱蜡后置于柠檬酸盐缓冲液(pH值为6.0)中10 min进行抗原热修复,磷酸盐缓冲液清洗后,加入3%过氧化氢溶液常温下放置25 min,磷酸盐缓冲液清洗3次,5 min/次,滴加山羊血清反应20 min,加ASC(1∶150)、胱天蛋白酶-1(1∶200)、NEK7(1∶300)、NLRP3(1∶500)、GSDMD(1∶800),β-actin(1∶1 000),4 ℃过夜,磷酸盐缓冲液清洗3次,每次5 min,加入中杉金桥即用型二抗(SP-9000型),37 ℃条件下20 min,用磷酸盐缓冲液清洗3次×5 min;切片上滴加辣根酶标记链霉卵白素工作液(S-A/HRP),37 ℃ 20 min,磷酸盐缓冲液清洗3次×5 min;DAB显色后充分水洗;苏木精复染细胞核1 min,充分水洗、1%盐酸乙醇分化、1%氨水反蓝、充分水洗、经70%乙醇5 min、80%乙醇5 min、90%乙醇5 min 2次、95%乙醇5 min 2次、100%乙醇5 min 2次脱水、二甲苯透明5 min 2次、中性树脂封片,显微镜下观察结果,记录各组免疫组化评分(Immunohistochemical Score,IHS)。
IHS[11]=阳性细胞数积分(A)×阳性细胞显色强度积分(B)。
A为阳性细胞数积分0~1%=0分、1%~10%=1分、10%~50%=2分、50%~80%=3分、80%~100%=4分;B为阳性细胞显色强度积分0分(阴性)、1分(弱阳性)、2分(阳性)、3分(强阳性)。
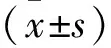
2 结果
2.1 清热养阴除湿丸对各组大鼠关节的影响 造模前各组大鼠踝关节周长基本相同,差异无统计学意义(P>0.05),具有可比性。造模6 h后除BC组,每组模型大鼠均出现关节红肿,活动减少,舔足等现象。且各组大鼠肿胀度较造模前均有增加,差异无统计学意义(P>0.05)。
造模12 h后,与BC组比较,其余各组大鼠踝关节肿胀指数均增加,差异有统计学意义(P<0.05);与模型组比较,PC组降低明显,差异有统计学意义(P<0.05),余药物处理组肿胀指数差异无统计学意义(P>0.05);与PC组比较,MSD1组、MSD2组、MSD3组组肿胀指数略高,但差异无统计学意义(P>0.05)。
造模24 h后,与BC组比较,各组肿胀指数均增加,差异有统计学意义(P<0.05);与模型组比较,各药物处理组关节肿胀指数差异无统计学意义(P>0.05);与PC组比较,MSD1组、MSD2组、MSD3组肿胀指数差异无统计学意义(P>0.05)。
造模48 h后,与BC组比较,MSD3组踝关节肿胀指数差异无统计学意义(P>0.05),其余各组关节肿胀指数均增加,差异有统计学意义(P<0.05);与模型组比较,各药物关节肿胀指数均降低,差异有统计学意义(P<0.05);与PC组比较,MSD3组踝关节肿胀指数明显降低,差异有统计学意义(P=0.01),MSD1组、MSD2组与PC组差异无统计学意义(P>0.05)。见表2。

表2 清热养阴除湿丸对大鼠踝关节肿胀指数的影响
在连续测量时间内,与空白组比较,其余各组大鼠均有明显踝关节肿胀;无药物干预的BC组大鼠,关节炎症于48 h内达高峰;各药物处理组大鼠踝关节肿胀指数于24 h内达高峰,随着治疗时间的延长,各药物处理组大鼠的踝关节肿胀指数逐渐降低,以MSD3组下降幅度最大,说明各药物处理组均可改善大鼠的关节炎情况,而MSD3组疗效更为明显。
2.2 清热养阴除湿丸对大鼠炎症介质的影响
痛风性关节炎为全身性炎症反应,大鼠踝关节液较少,收集关节冲洗液可能导致明显的稀释,白细胞介素-1β,白细胞介素-6,白细胞介素-18,肿瘤坏死因子-α为下游炎症介质,故其在血液中的含量水平同样可以反映关节炎的程度。
2.2.1 各组对白细胞介素-1β、白细胞介素-6表达水平的影响 与BC组比较,其余各组表达均明显升高,差异有统计学意义(P<0.05);与模型组比较,各药物处理组表达明显降低,差异有统计学意义(P<0.05);与PC组比较,MSD3组表达相似,差异无统计学意义(P=0.1),MSD1组、MSD2组表达均升高,差异有统计学意义(P<0.05)。
2.2.2 各组对白细胞介素-18水平的影响 与BC组比较,各组表达水平均升高,差异有统计学意义(P<0.05);与模型组比较,各药物处理组表达均降低,差异有统计学意义(P<0.05);与PC组比较,MSD3组表达差异无统计学意义(P=0.1),MSD1组升高,差异有统计学意义(P<0.05)。
2.2.3 各组对肿瘤坏死因子-α水平的影响 与BC组比较,其余各组表达均升高,差异有统计学意义(P<0.05);与模型组比较,MSD1组表达差异无统计学意义(P>0.05),余药物处理组表达均降低,差异有统计学意义(P<0.05);与PC组比较,MSD3组表达差异无统计学意义(P=0.3),MSD1、MSD2组升高,差异有统计学意义(P<0.05)。见表3。
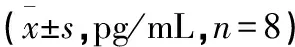
表3 清热养阴除湿丸对大鼠关节滑膜组织炎症介质含量的影响
清热养阴除湿丸MSD3组中白细胞介素-1β、白细胞介素-6、白细胞介素-18、肿瘤坏死因子-α的表达较BC组、模型组明显降低,相较于PC组,MSD3组的抑制作用更加明显,随着清热养阴除湿丸剂量的增加,其对炎症介质表达的抑制作用增强。
2.3 清热养阴除湿丸对NEK7/GSDMD通路各蛋白mRNA表达的影响 与BC组比较,各组mRNA表达均升高,差异有统计学意义(P<0.05);与模型组比较,各药物处理组mRNA表达均降低,差异有统计学意义(P<0.05);与PC组比较,MSD2、MSD3组mRNA表达接近,差异无统计学意义(P>0.05)。见表4。
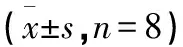
表4 清热养阴除湿丸对大鼠关节滑膜组织NEK7,NLRP3,Caspase-1,ASC,GSDMD mRNA表达的影响
清热养阴除湿丸MSD3组中各关键蛋白mRNA表达量较BC、模型组均降低;相较于PC组,清热养阴除湿丸中、高剂量组对各关键蛋白mRNA的表达的抑制作用无显著差异,随着清热养阴除湿丸剂量的增加,其对各关节蛋白mRNA表达的抑制作用增强。
2.4 清热养阴除湿丸对NEK7/GSDMD通路各关键蛋白表达量的影响 与BC组比较,各蛋白的表达均升高,差异有统计学意义(P<0.05);与模型组比较,各药物处理组蛋白表达均降低,差异有统计学意义(P<0.05);与PC组比较,MSD1表达增加,差异有统计学意义(P<0.05),MSD2、MSD3组蛋白表达相似,差异无统计学意义(P>0.05)。见表5,图1。
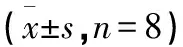
表5 清热养阴除湿丸对大鼠关节滑膜组织NEK7、NLRP3、Caspase-1、ASC、GSDMD表达的影响
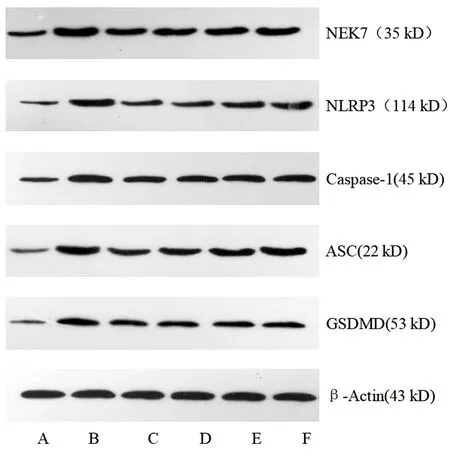
图1 关节滑膜组织中NEK7,NLRP3,Caspase-1,ASC,GSDMD蛋白电泳条带
上清热养阴除湿丸MSD3组中各关键蛋白表达量较BC、模型组均降低;相较于PC组,清热养阴除湿丸中、高剂量组对各关键蛋白的表达的抑制作用接近,随着清热养阴除湿丸剂量的增加,其对各关节蛋白表达的抑制作用逐渐增强。
2.5 清热养阴除湿丸对NEK7/GSDMD通路各关键蛋白IHS积分的影响 与BC组比较,各组表达均升高,差异有统计学意义(P<0.05);与模型组比较,MSD1组表达相似,差异无统计学意义(P>0.05),余药物处理组表达均降低,差异有统计学意义(P<0.05);与PC组比较,MSD1、MSD2表达增加,差异有统计学意义(P<0.05),MSD3组表达相似,差异无统计学意义(P>0.05)。见表6。
表6 清热养阴除湿丸对大鼠关节滑膜组织NEK7、NLRP3、Caspase-1、ASC、GSDMD IHS积分的影响分,n=8)
3 讨论
痛风是一种单水尿酸钠沉积所致的晶体相关性关节病,与嘌呤代谢紊乱和(或)尿酸排泄减少所致的高尿酸血症直接相关,临床主要表现为反复发作的急性关节炎、不可逆的外周关节损伤、皮下痛风石、痛风性肾病、尿路结石,甚至可以造成重要脏器功能异常[12]。来自国家风湿病数据中心的数据显示,在痛风发作期间,79%的患者会因疼痛和住院治疗无法正常工作,严重影响其工作和生命质量,痛风带来的经济社会损失不容忽视[13]。
中性粒细胞对单钠尿酸盐结晶的吞噬作用在痛风发作的急性炎症扩大中发挥显而易见的中心作用,但中性粒细胞募集至关节需要滑膜和关节血管中较早期局部细胞和液相事件。这些事件启动固有免疫系统介导的炎症,包括激活滑膜定居吞噬细胞和NLRP3炎症小体,后者导致白细胞介素-1前体细胞加工过程和关键细胞因子白细胞介素-1β的活化,进而导致剧烈的炎症反应。细胞焦亡(Pyroptosis)是在2001年由Cookson和Brennan等[14]研究发现的一种炎症性程序性细胞死亡方式,其以Caspase-1为核心环节,GSDMD蛋白为切割底物,这是细胞焦亡的经典激活途径,Caspase-1由NLRP3炎症小体复合物在感知病原信号后激活,是细胞质天然免疫最为重要的通路之一[15-16]。
痛风性关节炎患者体内尿酸盐结晶析出或痛风石崩解后,被激活的NEK7-NLRP3炎症复合物、Caspase-1能介导滑膜组织中的巨噬细胞发生焦亡,表现为细胞膜发生破裂并释放白细胞介素-1β等炎症介质,协同放大强烈的炎症反应,导致发热、关节肿痛等典型痛风性关节炎症状[17-18]。NEK7/GSDMD焦亡通路与痛风急性炎症的发生密切相关。从我们的实验结果来看,模型组NEK7-NLRP3-Caspase-1通路上的主要蛋白表达量及mRNA表达量均显著高于空白组,白细胞介素-1β、肿瘤坏死因子-α、白细胞介素-18等炎症介质的含量明显高于空白组,这与痛风性关节炎的发生机制相同,说明造模成功。同时也说明了NEK7/GSDMD通路在痛风急性炎症中的重要作用。秋水仙碱作为经典的控制痛风性关节炎药物,可以抑制NLRP3的表达,本研究结果发现,秋水仙碱组中NEK7/GSDMD通路各相关蛋白的表达明显低于模型组。结合动物的关节炎评分来看,秋水仙碱组要明显低于模型组,说明秋水仙碱可以控制痛风性关节炎相关症状。
清热养阴除湿丸基础药理作用研究显示,该药能降低Ⅱ型胶原诱导性关节炎(Collagen-induced Arthritis,CIA)大鼠足肿胀度、关节炎指数,降低血清中白细胞介素-1、白细胞介素-6、肿瘤坏死因子-α水平,提示该药作用机制可能与降低异常升高的细胞因子,减少炎症介质产生,调节促炎与抑炎细胞因子失衡有关[19]。此外,清热养阴除湿丸能提高小鼠痛阈值;对小鼠炎性耳郭肿胀和足肿胀均有抑制作用,该药抗炎消肿止痛作用可能与减少炎症介质有关。该药治疗痛风的临床研究结果显示,在控制患者关节疼痛,肝肾功能,白细胞,红细胞沉降率、C反应蛋白方面,与秋水仙碱组无显著性差异,证明了清热养阴除湿丸具有较好地控制关节炎症的作用[20-21]。本研究发现,清热养阴除湿丸各剂量组相较模型组,关节炎及关节肿胀积分均较低,而与秋水仙碱组相当,炎症介质白细胞介素-1β、白细胞介素-18、肿瘤坏死因子-α的含量低于模型组,高剂量组与秋水仙碱组相当;在调节NEK7/GSDMD通路上,与秋水仙碱组比较,高剂量组对该通路各相关蛋白的表达具有明显的抑制作用。从结果来看,清热养阴除湿丸对炎症通路的影响呈现剂量依赖性,随着剂量的增加,抗炎作用更明显,这与临床应用中观察结果相类似。
综上所述,本研究证明清热养阴除湿丸能够抑制NEK7-NLPR3炎症小体的形成,降低GSDMD的产生,调控细胞焦亡的发生,减少炎症介质表达,从而减轻关节炎症。清热养阴除湿丸的抗炎作用可能是通过NEK7/GSDMD通路实现的,这为进一步深入研究该药的作用机制提供前期基础,为清热养阴除湿丸治疗痛风关节炎提供生物学依据。

