氟苯尼考通过影响肉鸡药物代谢和介导炎症反应诱导肾损伤
卢春雨,张 璐,刘 维,窦萌萌,史万玉,2*,包永占,2*
(1.河北农业大学 中兽医学院,河北 保定 071000;2.河北省生物技术创新中心,河北 保定 071000)
氟苯尼考(florfenicol,FFC),又称氟甲砜霉素,是一种广谱抗生素,于1988年在美国被Schering-Plough公司研制成功[1]。FFC具有吸收良好、体内分布广泛、抗菌谱广、抗菌作用强等特点,在农场动物中被广泛使用,以治疗感染,也用于预防以及饲料添加剂[2-3]。随着FFC的广泛使用,FFC对各种动物的多器官损害已被报道。高剂量的FFC(40,60 mg/kg)显着改变了山羊血液中的肾脏和肝脏功能指标[4];FFC引起大鼠的空肠黏膜损伤和绒毛破裂,阻碍有益菌增殖而使肠道菌群失调,引起胃肠道功能紊乱[5]。FFC诱导造血细胞的细胞周期停滞和凋亡,并通过减少外周血细胞的数量改变骨髓造血微环境[6]。治疗剂量的FFC诱导仔猪血清和组织中出现IL-6、HSP70浓度的增加,并影响免疫功能[7]。
家禽肾脏结构较简单,滤过面积小,有效滤过压较低,对经肾脏排泄的物质(包括药物)很敏感,极易造成损害,引起肾功能不全[8]。研究表明,鸡内服FFC后吸收迅速,代谢相对缓慢,在肾脏分布浓度较高,代谢产物主要经尿及胆汁排泄,极易伤害肾脏[9-10]。FFC在雏鸡肾脏结构产生明显的损伤作用,损害雏鸡的肾功能[11]。WANG等[12]发现FFC通过促进凋亡因子Caspase-3 和 Caspase-6的表达来提高肾脏细胞的凋亡率,导致肾细胞过度凋亡,严重影响雏鸡肾功能。此外,药敏试验表明FFC对垂直感染的疾病,如沙门菌、大肠杆菌及支原体敏感性较好,目前 FFC常作为开口药用于家禽养殖,并且近年来 FFC 是禽蛋及禽肉中药残检出率较高的药物之一,也导致药物在鸡体内残留,影响鸡肉食品的质量和安全,进而影响人体健康[13]。因此,本研究分析FFC诱导雏鸡肾损伤的分子机制,为兽医临床防治的合理使用提供试验依据。
1 材料与方法
1.1 主要试剂FFC溶液(市售兽用临床非处方药物,纯度≥10%,山东神牛动物药业有限公司);尿酸(UA)、尿素氮(BUN)、肌酐(Cre)(南京建成生物工程研究所);苏木精、伊红染色液(北京博奥拓达科技有限公司);IL-6、IL-1β、TNF-α、ELISA试剂盒(上海酶联生物科技有限公司,上海);Eastep®Super总 RNA提取试剂盒(LS1040,Promega,北京);Go ScriptTMReverse Transcription System(A5001,Promega,USA);Go Taq®PCR Master Mix(A6001 Promega,USA)。
1.2 动物分组与处理1日龄AA肉鸡(购自河北大午公司)肉雏鸡随机分成2组,每组30只,分别为空白组和FFC组。FFC组给予0.15 g/L FFC混水(中国兽药典推荐剂量),从 1日龄开始,连续给药 5 d,饲养周期42 d。每天保证24 h光照,温度(25±5)℃,湿度55%±5%,自由饮水采食。给药结束,各组分别随机取 3只鸡,无菌摘取其肾组织,置于无酶管,送上海派森诺生物技术有限公司进行转录组测序。分别于6,42日龄,每组随机选10只,翅下静脉采血,在4℃低温条件下以3 500 r/min离心10 min,分离出血清。迅速摘取肾脏组织,然后将肾组织分为2部分,一部分用10%中性甲醛溶液固定,一部分于-80℃冰箱冷冻保存。
1.3 肾功能测定分离的血清严格按UA、BUN、Cre试剂盒说明书操作,测定血清中各指标水平的变化。
1.4 肾脏病理切片取固定好的肾组织,脱水,石蜡包埋,以5 μm的厚度切片后,用苏木精-伊红(HE)染色,并在光学显微镜下观察石蜡切片。
1.5 炎性因子检测称取500 mg肾组织放到适量的预冷的PBS的离心管内,进行匀浆后,离心取上清液,得到10%的肾脏组织匀浆溶液,并通过ELISA法分别对其进行IL-6、IL-1β、TNF-α ELISA 试剂盒操作,计算肾组织中炎症因子的水平。
1.6 转录组测序通过 Oligo(dT) 磁珠富集总 RNA 中带有 poly A 结构的 mRNA,采用离子打断的方式,将 RNA 打断到长度300 bp左右的片段。以 RNA 为模板,用6碱基随机引物和逆转录酶合成 cDNA 第一链,并以第一链 cDNA 为模板进行第二链 cDNA 的合成。文库构建完成后,采用PCR扩增进行文库片段富集,之后根据片段大小进行文库选择,文库大小在450 bp。接着,通过 Agilent 2100 Bioanalyzer 对文库进行质检,再对文库总浓度及文库有效浓度进行检测。样品经过 RNA 抽提、纯化、建库之后,基于 Illumina HiSeq 测序平台,对这些文库进行双末端 (Paired-end,PE)测序。采用 DESeq 对基因表达进行差异分析,筛选差异表达基因条件为表达差异倍数 |log2FoldChange|>1 ,显著性P<0.05 。使用数据库GO对差异表达基因进行GO功能注释,包括分子功能(molecular function)、细胞组分(cellular component)和生物过程(biological process)3大类。同时将差异表达基因序列在KEGG 数据库中进行注释,其显著性富集分析的P值计算和阈值与GO 富集分析相同。通过pathway 显著性富集确定差异表达基因参与的最主要生化代谢途径和信号转导途径。
1.7 RT-PCR检测差异基因使用总RNA提取试剂盒提取不同组肉鸡肾脏组织总RNA。用核酸定量仪器上检测,将合格的RNA用反转录试剂盒进行cDNA的合成。以β-action作为内参基因,用RT-PCR法对UGT1A1、CYP1B1、TLR1、TLR2、TLR4、Caspase-8基因转录水平进行检测,引物由TaKaRa(大连,中国)设计并合成(表1)。使用LightCycler®96全自动荧光定量PCR仪设置程序如下:预变性95℃ 30 s;以95℃ 5 s,55℃ 30 s,72℃30 s扩增4个循环。以2-△△Ct计算各目的基因相对转录水平。
1.8 统计学分析用SPSS 18.0软件统计差异显著性,P<0.05或P<0.01表示具有统计学意义,数据以“平均值±标准差”表示;通过GraphPad Prism 5.0 软件对数据结果进行绘图分析。

表1 引物和基因序列
2 结果
2.1 肾脏功能指标对6,42日龄的肉鸡进行肾功能指标检测,由图1可知,与空白组相比,FFC组6和42日龄肉鸡血清中Cre、BUN、UA都显著升高(P<0.05或P<0.01)。
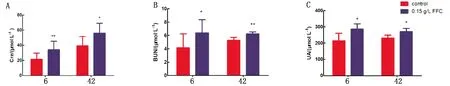
注:与正常组相比,*表示P<0.05,**表示P<0.01。下同
2.2 肾脏病理切片在光学显微镜下,空白组6和42日龄肉鸡肾小管结构完整清晰,未见炎性细胞浸润现象(图2A,B)。与空白组相比,FFC组6和42日龄肉鸡肾小管结构损伤较为严重,可见明显的肾小管上皮细胞崩解,刷状缘脱落,细胞碎片进入肾小管管腔(图2C,D)。此外,42日龄肉鸡的肾脏间质有炎性细胞浸润现象(图2 D)。

A.6日龄空白组肉鸡肾脏组织,400×;B.42日龄空白组肉鸡肾脏组织,400×;C.6日龄FFC组肉鸡肾脏组织,400×;D.42日龄FFC组肉鸡肾脏组织,400×。(黄色箭头指示肾小管结构,TEC;红色箭头指示肾小管上皮细胞脱落,DTEC;绿色箭头指示炎症因子浸润,Ⅱ)
2.3 原始数据质量评估与参考序列比对分析本研究通过构建空白组和FFC组的转录组文库,共获得 6 GB clean data数据量,各样品的clean rate 均高达93%,Q30均在92%以上,比对率均在93%以上,说明测序数据质控水平较高,测序质量优良,完整性高,能够满足后续数据分析的要求(表2)。

表2 测序数据统计结果
2.4 差异基因筛选本研究筛选各组的差异表达基因,由图3知,与空白组相比,FFC组上调109个,下调基因584个。其中,FFC组与免疫相关显著差异表达的基因: Toll样受体1(TLR1)、Toll样受体2(TLR2)、Toll样受体4(TLR4)、半胱氨酸蛋白酶-8(caspase-8)、具有胶原结构巨噬细胞受体(MARCO)、肿瘤坏死因子超家族成员10(TNFSF10)等;与药物代谢酶有关的基因:葡萄糖醛酸转移酶(UGT1A1)、细胞色素P450 1B1 (CYP1B1)、细胞色素P450 2D6 (CYP2D6)、细胞色素P450 51A1(CYP51A1)。

图3 空白组与FFC组差异表达基因分布火山图
2.5 差异表达基因的GO富集分析与空白组相比,FFC组差异表达基因分类于405个功能项中,包括305个生物学过程(BP),51个细胞组分(CC)和49个分子功能(MF)。挑选富集最显著的前30个GO term条目进行展示(图4),空白组与FFC组其中参与细胞过程(BP)较为丰富的是(GO:0002682)调节免疫系统过程、(GO:0002376)免疫系统进程、(GO:0022610)生物黏附等。参与细胞组分(CC)富集较为丰富的是(GO:0031012)细胞外基质、(GO:0005576)细胞外区域、(GO:0044459)质膜部分等。参与分子功能(MF)较为丰富的是(GO:0048407)血小板衍生生长因子结合、(GO:0004871)信号转导活性等。图4B分析结果显示,生物过程中的免疫系统进程的调节是肾脏损伤的关键门类。

A.空白组与FFC组GO富集分析柱状图; B.空白组与FFC组生物过程分析图(Top 10)。
2.6 KEGG通路由图5可知,KEGG分析发现FFC组肉鸡肾脏涉及的代谢通路主要包括吞噬体、细胞黏附、细胞因子与细胞因子互作、药物代谢-细胞色素P450、类固醇生物合成、细胞色素P450对外源性物质的代谢、肠道免疫IgA的产生、Toll样受体通路等,当肾脏损伤时,其相关代谢通路的含量也会随之变化。由表3可知,FFC组肉鸡肾脏主要富集在Toll受体信号通路的TLR1、TLR2、 TLR4 和Caspase-8基因和外源性物质通过细胞色素P450代谢通路的CYP1B1和UGT1A1基因。

图5 空白组与FFC组KEGG柱状图

表3 主要富集通路及差异基因
2.7 RT-PCR验证差异基因对通过GO和KEGG富集分析的差异基因UGT1A1、CYP1B1、TLR1、TLR2、TLR4、Caspase-8进行验证,由图6可知,与空白组相比,FFC组6和42日龄肉鸡CYP1B1、UGT1A1表达水平降低(P<0.05);FFC组6和42日龄肉鸡TLR4表达水平升高(P<0.01);此外,FFC组6日龄肉鸡TLR1表达水平升高(P<0.05);UGT1A1、CYP1B1、TLR1、TLR4基因表达水平与RNA-seq结果一致。TLR2、Caspase-8基因表达水平无显著性差异(P>0.05)。

图6 各组肉鸡差异基因RT-PCR分析
2.8 肾脏炎性因子的检测由图7可知,与空白组相比,FFC组6日龄和42日龄肉鸡肾脏组织中IL-6表达水平均上调(P<0.05);此外,6日龄肉鸡肾脏组织中TNF-α表达水平显著性上调(P<0.05)。6日龄和42日龄肉鸡肾脏组织中IL-1β表达水平无显著性差异(P>0.05)。

图7 各组肉鸡肾脏炎症因子IL-6(A)、IL-1β(B)和TNF-α(C)的表达水平
3 讨论
肾脏具有循环和排泄功能,是毒物的靶器官[14]。FFC暴露后引起肾脏组织的微观结构变化,包括充血、肿胀和管型。UA、BUN 和 Cre常用于评估肾脏疾病进程。本试验研究结果表明,FFC诱导的肉鸡肾脏损伤在用药结束(6日龄)出现UA、BUN 和 Cre 水平的升高,且随着时间延长至出栏时(42日龄),UA、BUN 和 Cr 水平也升高,提示肉鸡肾脏损伤模型建立成功。这与WANG等[12]的研究一致。为了进一步探讨FFC对肉仔鸡肾损伤的作用机制,我们采用了转录组学技术分析FFC对肉鸡肾损伤的关键作用靶点,为临床研究提供参考。结果表明,FFC能不同程度地诱导Toll受体信号通路(TLR1、TLR4)和外源性物质通过细胞色素P450代谢(CYP1B1、UGT1A1)等途径。提示FFC可通过引起肉鸡肾功能紊乱而影响肉鸡这些基因的异常表达。
肉鸡药物性肾损伤最常见的原因是抗生素、氨气、重金属等,它们的大多数代谢物具有肾毒性。药物反应有2个步骤,即Ⅰ期和Ⅱ期。第一阶段反应:药物水解、氧化和还原生成代谢物,主要代谢产物酶是细胞色素P450[15]。研究表明FFC能显著抑制肉鸡肝组织内肝药酶CYP1A1和CYP2H1 mRNA的转录水平[16]。我们的结果表明FFC降低了6日龄和42日龄肉鸡肾脏CYP1B1含量。另外,UDP-葡糖醛酸转移酶(UGT)是体内重要的Ⅱ相代谢酶之一,内外源性化合物及毒性代谢物清除与解毒的机制是其经UGT催化转化为极性较强的结合物,后经肾脏排出体外,从而完成内外源性化学物以及毒性代谢物在体内的代谢消除[17-18]。在本研究中,FFC显著抑制了6日龄和42日龄肉鸡肾脏UGT1A1的表达。提示FFC通过CYP1B1、UGT1A1影响肾脏药物代谢反应;FFC及其代谢产物的积聚可能会影响肾小管并引起肾小管内药物浓度增加,进而影响肾脏的正常生理功能。
TLRs 与肾脏疾病的发生密切相关,TLRs可能通过激活 NF-κB 信号通路,促进炎症因子的表达而在肾脏衰老过程中发挥重要作用[19]。过度激活炎症受体TLR1和TLR4可诱导TNF-α、IL-6和IL-1β的强烈表达,从而促进多器官细胞毒性[20]。研究发现脂多糖诱导的急性肾损伤模型中,肾脏组织中TLR4的表达明显增加,血清中促炎因子TNF-α、IL-1β、IL-6水平上升[21]。四氯化碳诱导的大鼠急性肾损伤中,存在肾脏组织促炎细胞因子TNF-α、IL-6、IL-1β和TLR4 表达上调[22]。本研究发现FFC均可以明显增加肉鸡肾脏组织TLR1、TLR4的基因表达水平,且炎症因子TNF-α和IL-6水平显著上升。
本研究发现FFC造成肉鸡肾脏损伤机制:一方面通过抑制药物代谢酶CYP1A1、UGT1B1,抑制FFC的代谢过程;另一方面,FFC通过诱导TLR1、TLR4的表达,增加促炎因子TNF-α、IL-6的生成,从而造成肾小管结构变化,并升高了肉鸡血清中肌酐、尿素氮、肌酸水平。这一研究表明,FFC的应用可能通过抑制药物代谢、介导炎症等方式促进肉鸡肾脏损伤的形成。

