牛源多杀性巴氏杆菌和溶血性曼氏杆菌双重PCR检测方法的建立与应用
高 瑞,谢玉杰,缪西鹏,姜兴佳,牛耀祖,许立华*
(1.宁夏大学 农学院,宁夏 银川 750021;2.宁夏威科嘉动物科技有限公司,宁夏 银川 750004)
近年来,随着养殖业的不断发展,牛呼吸道疾病综合征(bovine respiratory diseases complex,BRDC)在国内外频繁报道,多呈散发性或地方流行性[1]。BRDC又称“运输热”(shipping fever),是由病毒或细菌单纯感染或混合感染引起的一大类疾病的总称。牛感染了BRDC,会出现发烧、呼吸急促、反复咳嗽、鼻和/或眼睛有分泌物、腹泻、脱水和食欲不振,对牛的健康和生产性能产生深远的影响[2]。多杀性巴氏杆菌(Pasteurellamultocida,Pm)和溶血性曼氏杆菌(Mannheimiahaemolytica,Mh)是牛呼吸道疾病的重要致病菌[3-4]。Pm和Mh均为革兰阴性条件性致病菌,是健康反刍动物上呼吸道和扁桃体隐窝的正常共生体。然而,在动物防御机制下降和受到应激时,它可以迁移到肺部,引起急性纤维素性胸膜肺炎。牛多杀性巴氏杆菌病主要包括由荚膜血清A型引起的肺炎和荚膜血清B型引起的出血性败血症(hemorrhagic septicemia,HS),后者一旦出现发病迹象,很快死亡,病死率接近100%[5]。在国外,Mh主要流行生物型A血清1和6型[6],而我国,Mh生物型A血清1型在牛肺炎中占主导地位,而血清2型在绵羊和山羊病中占主要优势[7]。
开展准确、快速的病原检测是牛呼吸道疾病综合防控措施的关键环节。Pm和Mh均属于巴斯德菌科,引起的临床症状较为相似,且多以混合感染及继发感染等形式出现,传统的病原分离、培养及鉴定方法耗时费力,为准确诊断带来困难。本研究建立了一次反应可同时检测Pm、Mh 2种牛源细菌性病原的双重PCR方法,为快速检测牛呼吸道传染病及开展流行病学调查提供有利的技术手段。
1 材料与方法
1.1 菌株及临床样本Pm(CVCC447)、Mh(CVCC4086)、绿脓杆菌(CVCC3359)购自中国兽医药品监察所;金黄色葡萄球菌(ATCC29213)、致病性大肠杆菌(ATCC35150)、肺炎克雷伯菌(ATCC13883)、鼠伤寒沙门菌(ATCC14028)、无乳链球菌(ATCC13813)、停乳链球菌(ATCC12388)购自于美国模式培养物集存库;牛支原体菌株、牛传染性鼻气管炎病毒(IBRV)毒株、牛病毒性腹泻-黏膜病毒(BVDV)毒株、牛呼吸道合胞体病毒(BRSV)毒株由本实验室分离鉴定保存。
2021年3-11月间,从宁夏地区各规模化牛场采集疑似呼吸道症状病牛的118份样品,包括鼻拭子、乳样及脏器等。
1.2 主要试剂和培养基口腔拭子基因组DNA提取试剂盒、细菌基因组DNA提取试剂盒、2×Taq 预混试剂Ⅱ、DL2000 DNA Marker 均购自天根生化科技(北京)有限公司;病毒DNA/RNA提取试剂盒购自OMEGA公司;营养琼脂(NA)、脑心浸出液肉汤(BHI)培养基购自青岛海博生物技术有限公司;支原体培养基由实验室配制;脱纤维羊血购自广州鸿泉生物科技有限公司。
1.3 引物设计根据 GenBank收录的PmKmt1基因、MhLkt基因,运用Primer 5.0软件设计2对特异性引物(表1),引物由生工生物工程(上海)股份有限公司合成。

表1 双重PCR引物序列
1.4 菌株、毒株及病料DNA的提取采用细菌基因组DNA提取试剂盒提取细菌DNA;采用病毒DNA/RNA提取试剂盒提取病毒DNA/RNA。临床拭子用口腔拭子基因组DNA提取试剂盒提取DNA。提取的DNA、总RNA置于-20℃保存备用。
1.5 Pm和Mh双重PCR检测方法的建立
1.5.1双重PCR反应条件的设立及优化 将提取的细菌基因组DNA通过紫外分光光度计测量浓度,用公式[copies/μL=(6.02×1023)×(mg/L×10-9)/(DNA长度×660)]计算其拷贝数浓度。将两者等体积混匀作为双重PCR的模板,建立25 μL反应体系,分别对退火温度(50~65℃)、引物浓度(0.05~0.4 μmol/L)进行优化。反应体系:2种病原菌基因组DNA各1 μL,2对上、下游引物各1 μL,2×Taq 预混试剂Ⅱ12.5 μL,ddH2O 9 μL,总体系为25 μL。反应程序:95℃ 3 min;94℃ 30 s,50~65℃ 30 s,72℃ 1 min, 共30个循环;72℃ 10 min,4℃ 10 min。取5 μL PCR产物进行1.5% 琼脂糖凝胶电泳,筛选出最佳温度和引物浓度。
1.5.2Pm和Mh双重PCR检测方法特异性试验 利用已优化的PCR反应体系,以Pm、Mh、牛支原体、金黄色葡萄球菌、致病性大肠杆菌、肺炎克雷伯菌、鼠伤寒沙门菌、无乳链球菌、停乳链球菌、绿脓杆菌、IBRV基因组DNA、BVDV及BRSV总cDNA为模板,同时加入1.5.1中最优引物浓度2对、2×Taq 预混试剂Ⅱ、ddH2O,按1.5.1中最佳退火温度进行扩增,取5 μL PCR产物进行1.5%琼脂糖凝胶电泳,评估该双重PCR方法的特异性。
1.5.3Pm和Mh双重PCR检测方法灵敏性试验 将Pm和Mh基因组 DNA 10倍倍比稀释,通过1.5.1中摸索的最佳条件,以各个稀释度的基因组DNA作为模板进行PCR扩增,以检测本方法的灵敏度。设置阴性对照(灭菌 ddH2O),评估该方法的敏感性。
1.5.4Pm和Mh双重PCR检测方法重复性试验 以1.5.3中最低检测限的基因组DNA稀释倍数浓度为模板,以1.5.1中建立的双重PCR检测方法进行扩增,并且在随后的2周内重复3次,以检测该方法的重复性。
1.6 Pm和Mh双重PCR检测方法的临床应用将处理后的118份样品,其中拭子83份(鼻拭子80份,咽拭子2份,环境拭子1份),乳样16份,脏器组织18份(肠管6份,肺脏5份,脾脏3份,肝脏2份,心脏、肾脏各1份),淋巴1份。用试剂盒提取核酸,利用建立的双重PCR检测方法与单重PCR分别进行检测,验证该多重PCR方法的可靠性,单一PCR方法参照TOWNSEND等[8]建立的Pm特异性PCR方法,ALEXANDER等[9]建立的Mh特异性PCR方法,评价临床实用性。
2 结果
2.1 模板浓度的确定Pm、Mh基因组DNA的浓度分别为3.14×1011, 3.96×1011copies/μL,将两者等体积混匀作为双重PCR的模板(Pm、Mh基因组DNA的浓度分别为1.57×1011,1.98×1011copies/μL),
2.2 双重PCR扩增条件优化及扩增结果将多重PCR检测方法退火温度设定为8个梯度,分别为50,51,53,55.9,59.5,62.5,64.1,65℃。最终根据特异性及引物二聚体生成量少,选取最佳退火温度为62.5℃(图1)。其他条件不变,选取条带中最清晰且各引物用量最少的浓度,最终确定反应最佳引物浓度为0.25 μmol/L,结果如图2所示。

M.DL2000 DNA Marker;1~8.分别为退火温度由53~65℃递增的PCR产物

M.DL2000 DNA Marker;1~8.分别为引物终浓度由0.05~0.4 μmol/L递增的PCR产物
2.3 双重PCR检测方法特异性试验结果利用已优化的双重PCR方法对Pm、Mh、牛支原体、金黄色葡萄球菌、致病性大肠杆菌、肺炎克雷伯菌、鼠伤寒沙门菌、无乳链球菌、停乳链球菌、绿脓杆菌、IBRV、BVDV、BRSV核酸进行扩增,同时设立阴性对照。结果显示,Pm和Mh混合模板扩增出了2个条带,大小分别为476,948 bp,而其他病原的核酸及阴性对照均未出现特异性条带。结果如图3所示,表明该方法具有良好的特异性。

M.DL2000 DNA Marker;1~14.分别为Pm+Mh,Pm,Mh,支原体,金黄色葡萄球菌,致病性大肠杆菌,肺炎克雷伯菌,鼠伤寒沙门菌,无乳链球菌,停乳链球菌,绿脓杆菌,IBRV,BVDV,BRSV的PCR产物;15.阴性对照
2.4 双重PCR检测方法灵敏性试验结果将Pm、Mh等体积混合基因组DNA以102~108梯度稀释后作为模板,ddH2O为阴性对照,进行双重PCR扩增。结果如图4所示,Pm和Mh最低检测限分别为1.57×105,1.98×106copies/μL,表明该方法具有较好的敏感性。

M.DL2000 DNA Marker;1~7.分别为模板浓度102~108倍稀释浓度;8.阴性对照
2.5 双重PCR检测方法重复性试验结果通过已优化的双重PCR方法在不同的时间段做3次重复,每次检测结果Pm和Mh均为阳性,表明本试验所建立的方法具有良好的重复性。
2.6 Pm和Mh双重检测方法的初步临床应用利用本试验建立的双重PCR方法和单重PCR对宁夏地区采取的118份临床样品进行检测,如图5~7所示,结果显示双重PCR方法对Pm、Mh的检出率分别为57.63%(68/118),30.51%(36/118),混合感染检出率为24.58%(29/118);单重PCR方法对Pm、Mh的检出率分别为54.24%(64/118),26.27%(31/118)。2种方法的总符合率分别为Pm 91.53%,Mh 94.07%;相对敏感性分别为Pm 89.71%,Mh 83.33%;相对特异性分别为Pm 94%,Mh 98.78%;Kappa值分别为Pm 0.82,Mh为0.85,数据如表2、3所示。结果表明,本研究所建立的双重PCR检测方法能快速检测出Pm、Mh 2种病原。

M.DL2000 DNA Marker;1.阳性对照;2.阴性对照;3~9.为临床样品

M.DL2000 DNA Marker;1.阳性对照;2.阴性对照;3~9.为临床样品
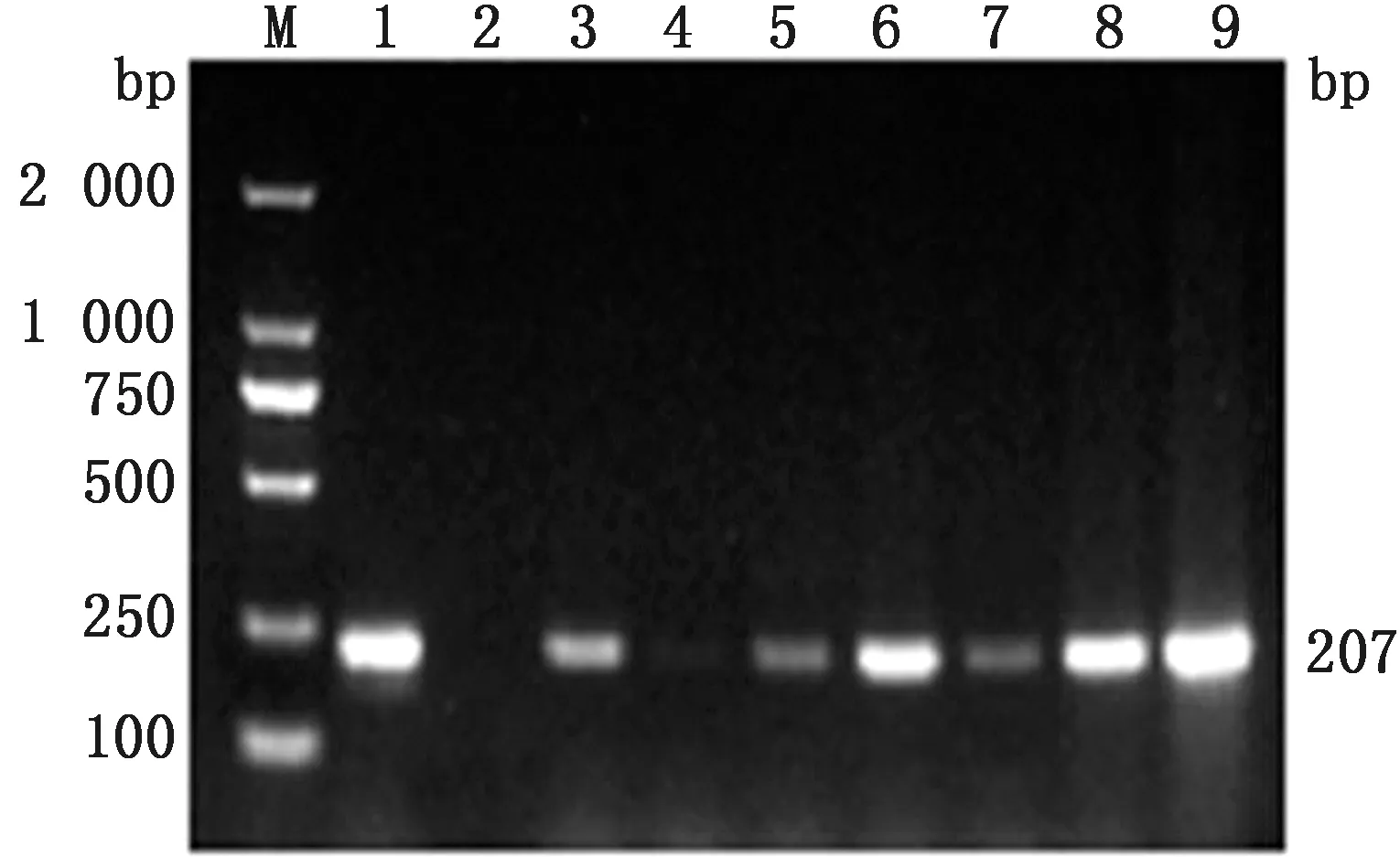
M.DL2000 DNA Marker;1.阳性对照;2.阴性对照;3~9.为临床样品
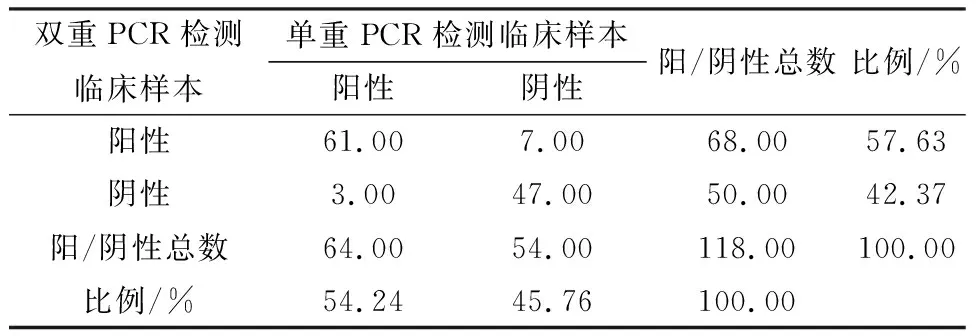
表2 双重PCR与单重PCR方法对临床样本Pm的检测结果
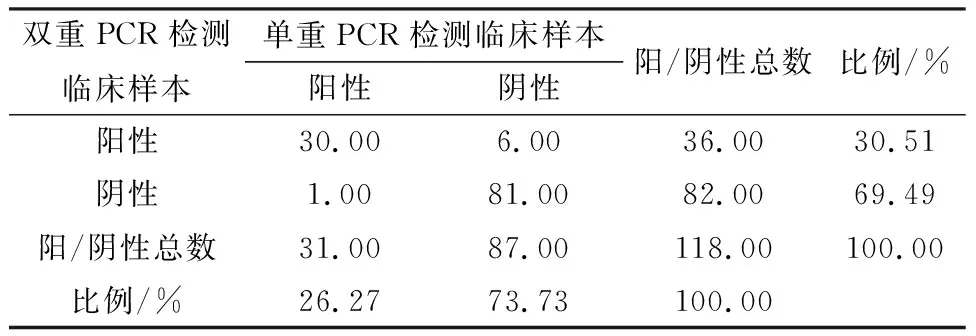
表3 双重PCR与单重PCR方法对临床样本Mh的检测结果
3 讨论
牛呼吸道综合征是由多种因素及病原体感染引起的系统性呼吸道疾病,Pm和Mh作为牛呼吸道疾病(bovine respiratory diseases,BRDs)的主要细菌性病原体[10],在我国流行范围广,受到众多学者的关注。我国自2008年首次发现牛感染血清A型Pm以来,Pm引起牛患病的发生率在不断上升[11-12]。本研究对临床病例样品中Pm检测发现,鼻拭子提取的基因组DNA,通过血清型鉴定发现,主要以荚膜血清A型Pm居多,而乳样中主要是荚膜血清B型Pm。因此,Pm会使产奶量下降或急性死亡,给牧场造成巨大的损失,亟需建立一种同时检测Pm和Mh的双重PCR检测技术。
目前,已经建立了牛源Pm和牛支原体双重PCR检测方法[13]、羊源Mh和Pm双重PCR检测方法[14]、化脓隐秘杆菌和Mh双重TaqMan荧光定量PCR检测方法[15],但未见建立牛源Pm和Mh的双重PCR检测方法。为了进一步对牛源的这两种病原进行快速准确检测和诊断,本研究通过对引物筛选,保证引物的特异性,优化了反应温度和最佳引物浓度,建立了牛源Pm与Mh双重PCR检测方法。特异性试验和敏感性试验也说明了该方法具有高度特异性和较高敏感性。通过对临床样本的检测,结果显示,Pm的检出率为57.63%(68/118),Mh的检出率为30.51%(36/118),混合感染检出率为24.58%(29/118),Pm和Mh呈现较高的感染率。因此,对牛源Pm和Mh所致疾病的防治不容忽视。
综上所述,本研究所建立的可同时检测Pm和Mh的双重PCR检测方法,具有高度特异性和较高敏感性,在临床初步应用中效果较好。该方法对快速准确检测Pm和Mh两种病原菌、指导临床用药、提高牛呼吸道疾病的防治效果提供了可靠的技术支持。

