广西地区不同黄羽肉鸡品系种公鸡群中禽白血病流行病学调查
崔真毓,韦祖樟,张亚文,张智慧,赵 鹏,常 爽*,黄伟坚*
(1.广西大学 动物科技学院,广西 南宁 530004;2.山东农业大学 动物科技学院,山东 泰安 271018)
禽白血病(avian leukemia,AL)是由禽白血病/肉瘤病毒群病毒(avian leukosis/sarcoma viruses,ALSV)引起的以免疫抑制、生长抑制和多器官组织出现肿瘤等为主要特征的禽类多种良性和恶性的肿瘤性疾病统称[1]。根据ALV的宿主范围、病毒囊膜糖蛋白抗原结构和病毒中和反应将其分为A~J共10个亚群[2],以及在我国地方品系鸡基因库中新鉴定出的K亚群[3]。此前,在很长的一段时间内,由于我国一直未曾开展全面系统的AL净化,我国不同鸡群特别是黄羽肉鸡群和纯地方品系鸡群感染ALV的报道已有很多[4-8]。
为了减少ALV感染带来的巨大损失,一些大型种鸡场不得不开始实施严格的AL净化措施,净化初期主要借鉴发达国家的净化程序。尽管ALV可以在孵化和育雏期间通过水平传播,也可以通过使用了含有ALV污染的弱毒疫苗等特殊途径而传播[9-10],但垂直传播始终是ALV最主要的传播方式,因此净化始终瞄准种鸡繁育体系中的原种鸡群开展。最初净化时多数种禽场重点关注了母鸡而忽视了公鸡,特别是公鸡精液在ALV传播中的作用,其客观原因是,在很长的一段时间内国际上对于公鸡在ALV传播中发挥的作用并无明确阐述。然而在净化的长期实践中发现,公鸡及其精液在ALV传播中可能发挥了重要作用,并开始重视对种公鸡的检测。李阳等[11]通过系统的动物实验首次证明了ALV-J可以通过公鸡的精液感染母鸡并且垂直传播给子代的雏鸡,这一发现提示加强对公鸡ALV的感染和带毒情况开展系统流行病学调查对于实施AL净化具有非常重要的意义。本研究对广西地区正在实施AL净化的种鸡场的12个不同品系种公鸡群,分别同时采用血浆病毒分离和精液病毒分离两种方式对其ALV感染状况开展了流行病学调查,以期为了解这些品系公鸡中ALV感染状况进而实施净化提供必要的参考数据。
1 材料与方法
1.1 样品与细胞分别从正在实施AL净化的12个不同黄羽肉鸡品系种公鸡群采集样品,各品系代号及其日龄与采样数量参见表1。对每一只公鸡以含有肝素钠的一次性无菌抗凝采血管采集血液,同时采集精液,所有公鸡的血液和精液样品均一一对应编号。可区分内源性和外源性ALV的DF-1细胞购自美国ATCC(American Type Culture Collection),其培养所需的生长液为含10%胎牛血清(FBS,GIBCO,USA)的DMEM,维持液为含1%FBS的DMEM。
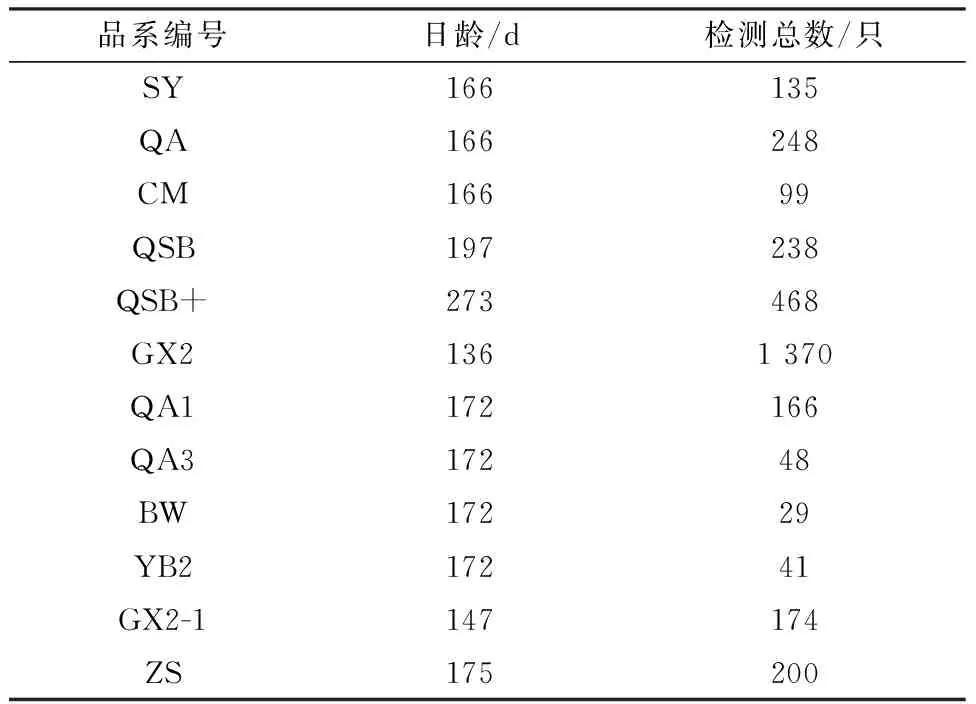
表1 12个黄羽肉鸡品系种公鸡群编号表
1.2 血浆样品的病毒分离鉴定每只公鸡均以无菌肝素钠抗凝采血管经翅静脉无菌采集抗凝血1 mL,在1 200 r/min转速下,于4℃离心3 min后取100 μL血浆样品接种于24孔细胞培养板已长成单层的DF-1细胞上,37℃孵育2 h后弃掉细胞生长液,用无菌PBS洗涤2次细胞后更换为细胞维持液,在37℃、5% CO2条件下继续培养9 d后收集培养上清,以ALV-p27抗原ELISA检测试剂盒(IDEXX,USA)按照说明书进行检测,以确定是否存在外源性ALV感染,p27阳性样品的上清液保存于-80℃备用。
1.3 精液样品的病毒分离鉴定参照国家标准《原种鸡群禽白血病净化检测规程》附录采集精液。首先以酒精棉球将泄殖腔周围擦拭干净以降低细胞接种时的污染概率,然后将精液采集到2 mL无菌离心管中,置于冰盒中存放。在无菌离心管中预先加入100 μL含有两性霉素B和青链霉素的无菌PBS缓冲液,再加入25 μL采集的精液后充分震荡混匀,于4℃以3 000 r/min转速离心3 min后取100 μL上清液接种到已长成单层DF-1细胞的24孔细胞培养板上,37℃孵育2 h后弃掉细胞生长液,用灭菌PBS洗涤3次后更换为细胞维持液,在37℃、5% CO2条件下培养9 d后收集培养上清,以ALV-p27抗原ELISA检测试剂盒检测,以确定是否存在外源性ALV感染,p27阳性样品的上清液保存于-80℃备用。
1.4 分离毒株gp85基因的扩增、克隆和测序为进一步鉴定种禽场主要流行毒株的亚群,对来自于上述4个鸡场种公鸡的6份S/P值读数较高且接种DF-1细胞可成功增殖的样品进行了gp85基因扩增和克隆测序。将样品以Viral RNA Kit(OMEGA,USA)参照说明书提取其总RNA,根据已发表的文献合成了相应引物扩增ALV的gp85基因[12]。PCR扩增产物经1.0%琼脂糖凝胶电泳鉴定并将目的条带切下后以商品化凝胶回收纯化试剂盒E.Z.N.A Gel Extraction Kit(OMEGA,USA)参照说明书回收纯化DNA,将纯化后DNA连接至pMD18-T Vector(TaKaRa,Japan)后转化到大肠杆菌感受态细胞DH5α,挑取单菌落以质粒提取试剂盒Plasmid Mini Kit(OMEGA,USA)提取质粒并进行酶切鉴定,鉴定为阳性的克隆质粒送上海生工生物工程有限公司测序。
1.5 序列比对和遗传进化分析使用DNA Star软件对所测定的gp85序列进行分析,将其与GenBank中已发表的不同亚群ALV的gp85参考序列进行比对,分析分离毒株与不同参考毒株间的同源性并绘制分子遗传进化树。
2 结果
2.1 以公鸡血浆样品为标准的分离鉴定结果按照本研究规定的血浆样品病毒分离程序,经商品化ALV-p27抗原ELISA检测试剂盒检测确定,标号为SY、QA、CM、QSB、QSB+、GX2、QA1、QA3、BW、YB2、GX2-1、ZS的12个不同地方品系种公鸡群的ALV 阳性率分别为0.74% (1/135),3.46%(8/231),1.37%(1/73),3.78%(9/238),8.12%(38/468),5.33%(73/1370),5.45%(9/165),2.13%(1/47),0.00%(0/29),2.50%(1/40),1.72%(3/174),2.50%(5/200)。结果表明,除标号BW的品系未分离到ALV外,其他11个黄羽肉鸡品系种公鸡群中均存在ALV的感染,最高阳性率达到8.12%,对经血浆样品病毒分离鉴定为阳性的种公鸡淘汰不再作为种用。
2.2 以公鸡精液样品为标准的分离鉴定结果按照本研究规定的精液样品病毒分离程序,经商品化ALV-p27抗原ELISA检测试剂盒检测确定,标号为SY、QA、CM、QSB、QSB+、GX2、QA1、QA3、BW、YB2、GX2-1、ZS 的12个不同地方品系种公鸡群的ALV 阳性率分别为0.74%(1/135),1.73%(4/231),1.37%(1/73),1.26%(3/238),1.71%(8/468),6.64%(91/1370),4.24%(7/165),0.00%(0/47),0.00%(0/29),0.00%(0/40),5.17%(9/174),1.50%(3/200)。结果表明,有3个品系未分离到ALV,特别是标号BW的品系精液病毒分离也未分离到ALV。总体可见,在12个品系种公鸡群中,精液病毒分离阳性率普遍低于血浆病毒分离阳性率,对所有经精液样品病毒分离结果鉴定为ALV阳性的种公鸡淘汰不再留作种用。
2.3 分别以血浆样品和精液样品实施病毒分离的结果对比通过对12个不同品系种公鸡群进行病毒分离结果的对比发现同一鸡群内精液和血浆病毒分离阳性率并不一致,有的精液病毒分离阳性率高于血浆病毒分离阳性率,如表2所示,编号GX2的品系共检测公鸡1 370只,2种样品均采集1 370份,其中精液病毒分离鉴定为ALV阳性的91份,血浆病毒分离鉴定为ALV阳性的73份,精液病毒分离和血浆病毒分离同时为阳性的却仅仅只有9份。多数血浆病毒分离阳性率远远高于精液病毒分离阳性率,如表2所示,编号QA的品系共检测公鸡231只,2种样品均采集231份,其中血浆病毒分离鉴定为ALV阳性的8份,精液病毒分离鉴定为ALV阳性的4份,且精液阳性公鸡其血浆检测也均为阳性;编号QSB的品系中,经血浆病毒分离鉴定为ALV阳性9份,精液病毒分离鉴定为ALV阳性的有3份,两者同时为阳性的仅有1份;编号QSB+的品系中,经血浆病毒分离鉴定为ALV阳性多达38份,精液病毒分离鉴定为ALV阳性的只有8份,两者同时为阳性的仅有4份。

表2 12个黄羽肉鸡品系种公鸡群ALV分离的检测结果及其对比 份
2.4 部分分离毒株的gp85序列分析与亚群鉴定因为检测冻融的损失和部分样品其S/P值较低,难以形成有效细胞复制和PCR扩增,本研究最终选取细胞上清S/P值较高的6株外源性ALV进行了gp85基因的扩增和克隆测序。同源性分析结果显示,6株ALV分离株之间其gp85核苷酸同源性为91.1%~100.0%,氨基酸同源性为87.5%~100.0%,所有分离株与J亚群ALV参考毒株gp85核苷酸同源性为88.5%~94.5%,而与其他亚群参考毒株gp85核苷酸同源性仅保持在49.6%~52.1% 之间。进一步对所有毒株的gp85基因进行遗传进化分析显示所有分离株与J亚群参考毒株处于进化树的同一分支上(图1),表明6株ALV均属于J亚群。

图1 分离株与不同亚群参考株ALV gp85核苷酸序列遗传进化树
3 讨论
我国家禽饲养量约占世界存栏量的1/3,长期居世界首位。目前,我国每年饲养白羽肉鸡和黄羽肉鸡均在45亿只左右,已成为我国居民肉食品供应的主要来源之一。白羽肉鸡的种源主要来源于国外进口,而黄羽肉鸡是我国自繁自养的特色品系。禽病一直是导致我国家禽生产性能不高和淘汰死亡的主要原因,在诸多禽病中,ALV、禽网状内皮增生症病毒和鸡传染性贫血病毒等病毒可按照“曾祖代—祖代—父母代—商品代”这一金字塔式扩繁链条在垂直传播过程中逐代放大,此类疾病在严重威胁种鸡健康的同时还给商品鸡群造成重大的经济损失。发达国家经过了长达数十年的努力成功净化了AL,而同时期我国黄羽肉鸡一直未开展规模化系统性AL净化导致ALV感染带毒率越来越高。
我国最初开展AL净化基本借鉴和参照了发达国家的净化程序,重点关注了母鸡的淘汰,如对母鸡的初产蛋采集蛋清检测其p27抗原并淘汰阳性母鸡是生产中应用最多的方法。在证实了公鸡及其精液在ALV传播中的重要作用后,很多种禽企业开始重视对种公鸡的净化。但是对于公鸡,除了病毒分离外尚无更科学更可靠的检测途径。在对不同的鸡群实施净化的过程中,我们发现当一些母鸡经血浆病毒分离已经无法检测到ALV,公鸡通过血浆病毒分离也检测不到ALV时,这些母鸡经人工授精后又变成了ALV阳性,这促使我们怀疑公鸡在某个特定感染时期仅在精液中存在ALV而血液中检测不到ALV。
作为我国重要的黄羽肉鸡种源基地,了解广西地区种公鸡中ALV的带毒状况对于加速特定鸡群的净化具有重要的意义。为此,本研究同时采取血浆病毒分离和精液病毒分离两种方式对12个黄羽肉鸡品系开展了ALV的调查。通过大量的样品检测显示,12个黄羽肉鸡品系种公鸡群中仅有1个品系从血浆和精液中均未分离到任何ALV外,其他11个品系均存在一定程度的ALV流行,未分离到ALV的公鸡是否因其群体过小导致病毒分离概率较低尚不可知,但总体上多个品系都存在ALV感染的现状提醒我们要高度关注种公鸡中ALV的感染和带毒。同时还发现对某一确定鸡个体而言,血液和精液两种样品病毒分离的结果存在不一致的情况,即在同一只公鸡存在精液和血液中ALV带毒状态的不一致性,这为我们实施ALV净化过程中对阳性公鸡的淘汰带来了挑战。以往针对ALV净化时仅仅采集公鸡血液开展病毒分离并实施淘汰,从现有结果看,这可能漏掉某些病毒血症消失但精液中仍旧存在ALV的公鸡,这些公鸡通过人工授精后进一步传给母鸡及其后代。这可以解释为什么某些鸡群在分别对公鸡和母鸡的血浆做病毒分离为阴性前提下再次进行人工授精后其雏鸡仍出现了一定比例的ALV阳性。
针对上述发现的血液和精液中ALV感染状态的不对应性,我们推测,ALV感染公鸡形成病毒血症后,在特定的时期为了躲避机体免疫系统等压力,某些ALV进入到了免疫细胞较少的精囊中,而血液中却检测不到ALV。类似的现象已经在与ALV高度相似的人类逆转录病毒人免疫缺陷病毒(HIV)中被广泛报道和关注,大量研究表明“狡猾”的HIV会隐藏在某些药物或免疫系统不易达到的器官或组织中进行逃逸。最熟知的就是HIV可在人睾丸中隐藏起来,大量临床实践表明,即使在大量使用药物后病人血液中HIV为阴性前提下在其精液中仍可检测到HIV[13-14]。HIV利用了动物机体的关键保护机制——免疫豁免,即某些特定部位如眼睛,就是免疫豁免区之一,是为了避免炎症对眼睛和视力的损害。产生精子的睾丸也是重要的免疫豁免区,是病原微生物天然的避难所,病原微生物会随着精液躲藏在睾丸中,以躲避机体免疫系统和药物的攻击。作为研究逆转录病毒的重要病毒模型,本研究在生产中观察到的现象无疑为解释上述科学设想提供了一种佐证。
本研究通过大量样品调查显示在多个黄羽肉鸡种公鸡中存在ALV的感染并在此过程中进一步发现公鸡血液和精液中ALV感染状态具有不吻合性,这提示我们要重视对种公鸡的净化,并且在实施公鸡净化时单纯依靠血浆病毒分离结果或者单纯依靠精液病毒分离结果淘汰感染公鸡都是不全面的,对公鸡血浆和精液同时实施检测和淘汰有助于加速ALV的净化进程。

