代谢综合征患者腰围及热应激蛋白70与血清肿瘤坏死因子-α水平的关联研究
彭 玥,宋 辉,杨宇轩,郭忠琴
(宁夏医科大学公共卫生与管理学院流行病与卫生统计学系,银川 750004)
代谢综合征(metabolic syndrome,MS)以多种并行发生的代谢性病理改变为特点,以胰岛素抵抗为病理基础,机体内聚集了高血压、糖尿病或糖调节异常、中心性肥胖和血脂异常等复杂的代谢紊乱综合征,甚至是诱发心血管疾病的危险因素[1-2]。全世界约有1/3的人暴露于多种可能引起MS的危险因素下,而MS患病率仍保持着不断升高的趋势[3]。一项美国健康与营养的调查结果表明,1990—2006年成年人MS患病率由28%增加至34%,相比男性,女性MS患病率的增加更为明显[4]。2002—2010年中国广东省的健康调查结果显示,8年内MS患病率从7.3%上升至24.5%[5]。MS的病因复杂,涉及多个系统,发病机制不明确,但已有的研究表明[6],MS是具有慢性低度和系统性特征的炎症状态,病情转归的过程中,可通过血清生物标记物监测病情进展。肿瘤坏死因子-α(TNF-α)是具有强效促炎作用的细胞因子,作为炎性反应的始动因素,已有研究证实TNF-α水平可影响胰岛素抵抗的发生发展,影响腰围(waist circumference,WC)并参与肥胖的发病环节,最终可导致MS的发生并不断推进病程[7-9]。相关研究强调WC在MS诊断中的地位,并将其纳入评分范围[10]。肥胖过程中调节平衡的关键之一是在应激条件下激活的防御机制,即热激反应。热应激蛋白70(heat stress proteins,HSP-70)在反应中具有重要地位,参与抗凋亡、抗炎反应、细胞信号和免疫反应调节以及糖尿病、肥胖等慢性疾病的进程,对MS具有保护作用[11]。但MS诊断或患病相关指标间的关联仍不明确,国内外对TNF-α水平在MS的病情转归中的作用也未达成共识。因此,本文旨在明确MS患者WC、HSP-70及其他体格和实验室检查指标与血清TNF-α水平的关系,探索各指标与血清TNF-α的相互作用,为MS发病机制的研究提供依据。
1 对象与方法
1.1 研究对象
本研究按照2005年美国心脏协会(American Heart Association,AHA)对2002年成人高胆固醇血症评估和治疗专家组的第三报道(Adult Treatment PanelⅢ,ATPⅢ)的修订[11]及排除标准,筛选376例无血缘关系的MS患者作为研究对象,所有研究对象均签署知情同意书。
1.2 纳入标准(MS诊断标准)
按2005年AHA的ATPⅢ修订标准,符合以下3项特征即可确诊MS:(1)腹型肥胖:WC(男性)≥90 cm;WC(女性)≥80 cm;(2)高甘油三酯血症:三酰甘油(triglyceride,TG)≥1.7 mmol·L-1;(3)高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)水平降低:男性HDL-C<1.03 mmol·L-1,女性HDL-C<1.29 mmol·L-1;(4)高血压:收缩压(systolic blood pressure,SBP)≥130 mmHg或舒张压(diastolic blood pressure,DBP)≥85 mmHg;(5)高血糖:空腹血糖(fasting plasma glucose,FPG)≥5.6 mmol·L-1。
1.3 排除标准
排除患有心脑血管疾病、肝肾急慢性损伤、循环和内分泌障碍、自身免疫病和长期使用免疫抑制剂者、患有炎症性疾病(受检前2周内无明显感染)和癌症患者,近期手术、外伤和应激状态,职业病,滥用药物或吸毒者,孕产妇人群。
1.4 现场调查
1.4.1 一般情况问卷调查 所有研究对象均自行填写流行病学调查问卷表,内容包括姓名、性别、年龄和MS相关疾病史等基本情况。
1.4.2 体格检查 由经过训练的调查员测量身高、体质量、WC、臀围(hip circumference,HC)及血压,并计算体质量指数(body mass index,BMI)和腰臀比(waist-to-hip ratio,WHR)。
1.4.3 实验室检查 于上午7:30—9:30采集研究对象空腹(禁食≥12 h)肘静脉血样10 mL,全自动生化分析仪(Sysmex XE-2100,TOA Medical Electronics’Kobe,Japan)检测白细胞(white blood cell,WBC)、总胆固醇(total cholesterol,TC)、TG、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、HDL-C、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、FPG和尿酸(uric acid,UA)等生化指标。血清中TNF-α、HSP-70的表达水平采用ELISA法测定。
1.5 统计学方法
使用SPSS 22.0统计学软件进行数据分析,计量资料以均数±标准差(±s)描述,采用独立样本t检验比较MS患者不同性别间体格检查与实验室指标的差异;采用方差分析比较多组血清TNF-α水平间体格检查与实验室指标的差异,用LSD-t检验进行两两比较。相关性分析用偏相关。采用多元线性回归建立影响血清TNF-α水平变化模型。统计学检验均采用双侧检验,检验水准α=0.05。
2 结果
2.1 不同性别MS患者一般临床资料比较
不同性别MS患者间年龄、BMI、WC、HC、WHR、TG、TC、HDL-C、LDL-C、SBP、AST、ALT、FPG、WBC、TNF-α、HSP-70和UA分布差异均无统计学意义(P均>0.05),女性DBP低于男性(P=0.002),见表1。
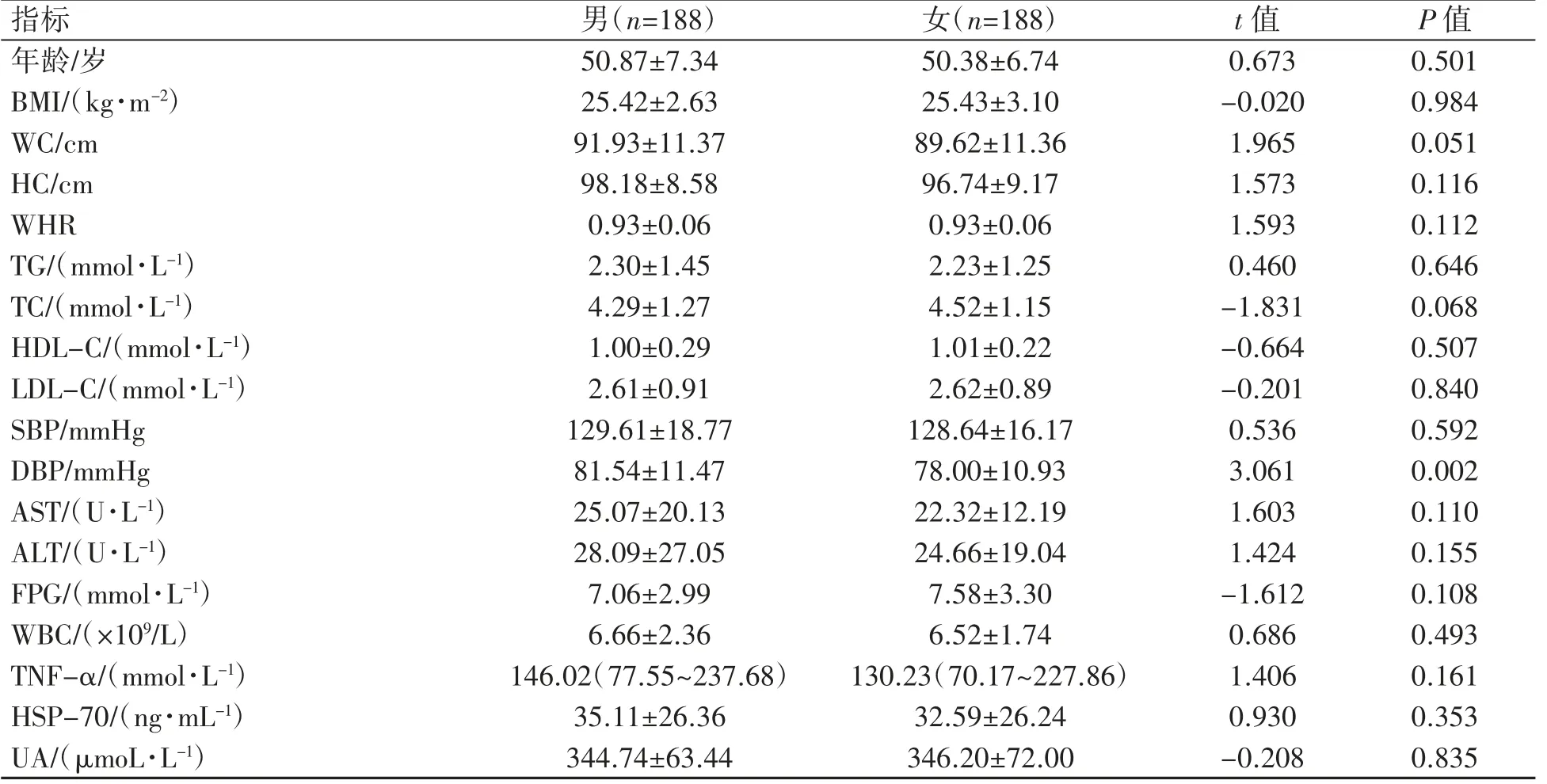
表1 不同性别MS患者一般临床资料比较
2.2 MS患者不同血清TNF-α水平组间体格检查、血脂、肝功能及其他实验室指标比较
血清TNF-α为正偏态分布资料,以四分位数为分组依据,即Q1(<75.69 mmol·L-1,94例)、Q2(≥75.69且<139.21 mmol·L-1,94例)、Q3(≥139.21且<233.46 mmol·L-1,94例)、Q4(≥233.46 mmol·L-1,94例)。在不同TNF-α水平组间,MS患者的WC(P=0.046)、WHR(P=0.043)、HSP-70(P<0.001)和UA(P=0.045)差异均有统计学意义,血脂各指标、肝功能各指标、BMI、HC、SBP、DBP、FPG、WBC各组间差异均无统计学意义(P均>0.05)。采取LSD-t检验分析MS患者WC、WHR、HSP-70和UA的组别差异:Q4组WC比Q1、Q3组更宽(P均<0.05),Q4组WHR比Q1组更高(P<0.01);TNF-α有随着HSP-70浓度升高而降低的趋势(P<0.05);Q2组的UA比Q1和Q4组的更高(P均<0.01),见表2~表5。
表2 MS患者不同血清TNF-α水平组间体格检查指标比较(±s)
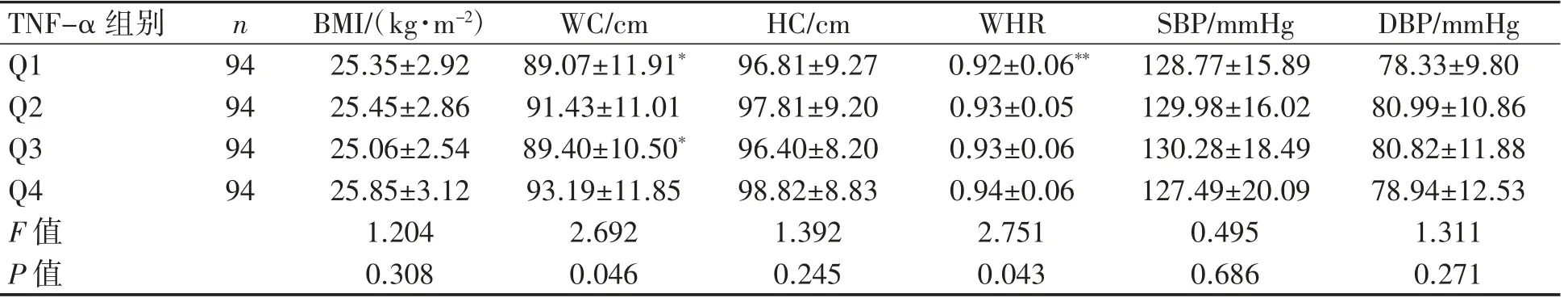
表2 MS患者不同血清TNF-α水平组间体格检查指标比较(±s)
与Q4组比较*P<0.05,**P<0.05。
TNF-α组别 n Q1 94 Q2 94 Q3 94 Q4 94 F值P值BMI/(kg·m-2) WC/cm HC/cm WHR SBP/mmHg DBP/mmHg 25.35±2.92 89.07±11.91* 96.81±9.27 0.92±0.06** 128.77±15.89 78.33±9.80 25.45±2.86 91.43±11.01 97.81±9.20 0.93±0.05 129.98±16.02 80.99±10.86 25.06±2.54 89.40±10.50* 96.40±8.20 0.93±0.06 130.28±18.49 80.82±11.88 25.85±3.12 93.19±11.85 98.82±8.83 0.94±0.06 127.49±20.09 78.94±12.53 1.204 2.692 1.392 2.751 0.495 1.311 0.308 0.046 0.245 0.043 0.686 0.271
表5 MS患者不同血清TNF-α水平组间其他实验室指标比较(±s)
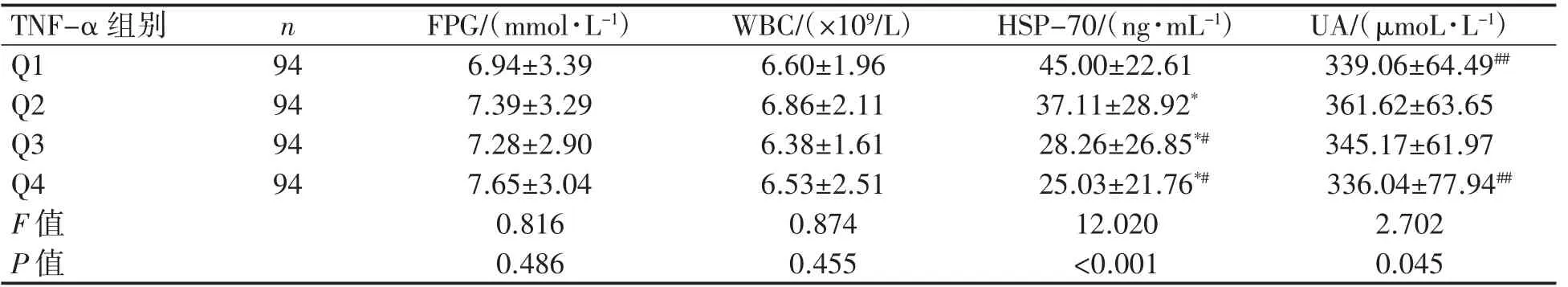
表5 MS患者不同血清TNF-α水平组间其他实验室指标比较(±s)
与Q1组比较*P<0.05;与Q2组比较#P<0.05,##P<0.01。
TNF-α组别 n Q1 94 94 Q2 Q3 94 Q4 94 F值P值FPG/(mmol·L-1) WBC/(×109/L) HSP-70/(ng·mL-1) UA/(μmoL·L-1)6.94±3.39 6.60±1.96 45.00±22.61 339.06±64.49##7.39±3.29 6.86±2.11 37.11±28.92* 361.62±63.65 7.28±2.90 6.38±1.61 28.26±26.85*# 345.17±61.97 7.65±3.04 6.53±2.51 25.03±21.76*# 336.04±77.94##0.816 0.874 12.020 2.702 0.486 0.455 <0.001 0.045
2.3 血清TNF-α与WC和HSP-70的多元线性回归分析
以血清TNF-α浓度为因变量,WC、HSP-70和UA为自变量,根据不同的调整水平建立模型,进行多元线性回归分析。容忍度>0.1,不存在多重共线性。将结果不具有显著性的UA排除后,WC和HSP-70进入方程(P均<0.05),TNF-α与WC和HSP-70存在线性关系。模型2优于模型1和模型3,调整R2=0.101,线性回归方程为YTNF-α=13.131-0.053XHSP-70+0.045XWC,见表6。
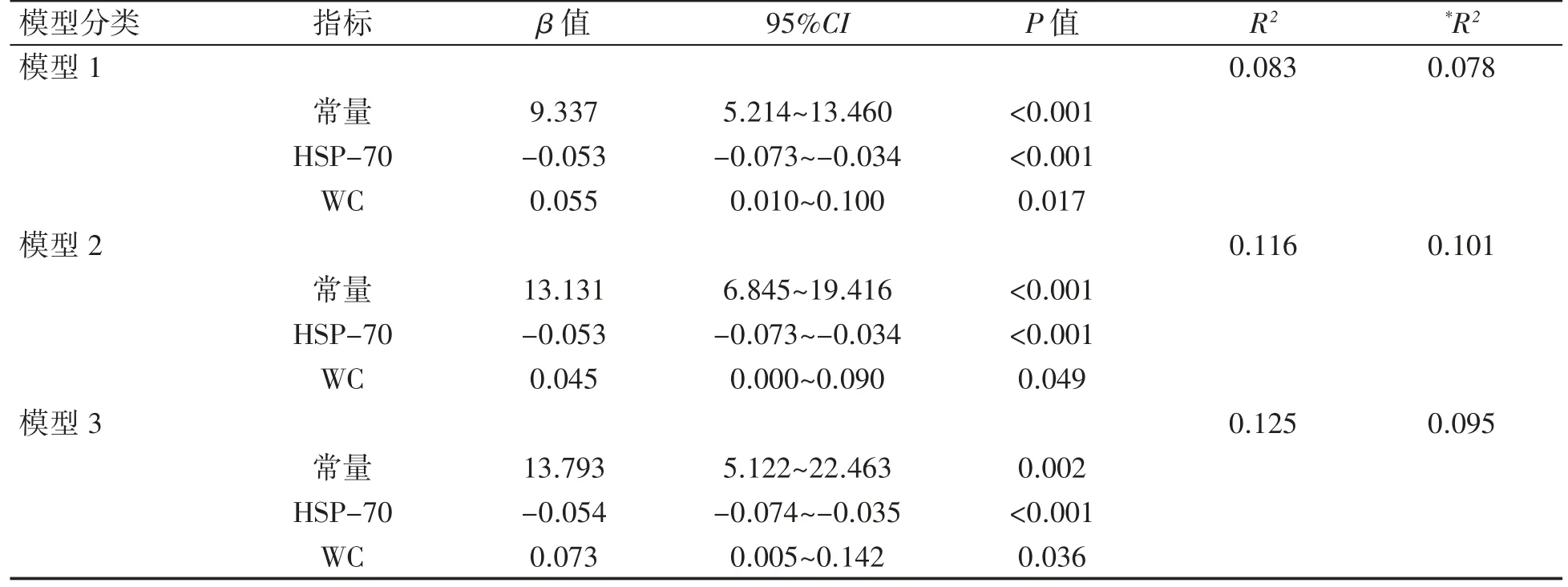
表6 MS患者血清TNF-α水平的多元线性回归分析
表3 MS患者不同血清TNF-α水平组间血脂指标比较(±s)

表3 MS患者不同血清TNF-α水平组间血脂指标比较(±s)
TNF-α组别 n Q1 94 Q2 9 94 Q3 4 Q4 94 F值P值TG/(mmol·L-1) TC/(mmol·L-1) HDL-C/(mmol·L-1) LDL-C/(mmol·L-1)2.16±1.06 4.49±1.36 1.01±0.22 2.57±0.93 2.36±1.71 4.29±1.10 1.00±0.20 2.59±0.96 2.34±1.31 4.43±1.18 1.04±0.36 2.65±0.82 2.20±1.24 4.41±1.22 0.98±0.23 2.66±0.90 0.507 0.472 0.724 0.215 0.677 0.702 0.538 0.886
表4 MS患者不同血清TNF-α水平组间肝功能指标比较(±s)
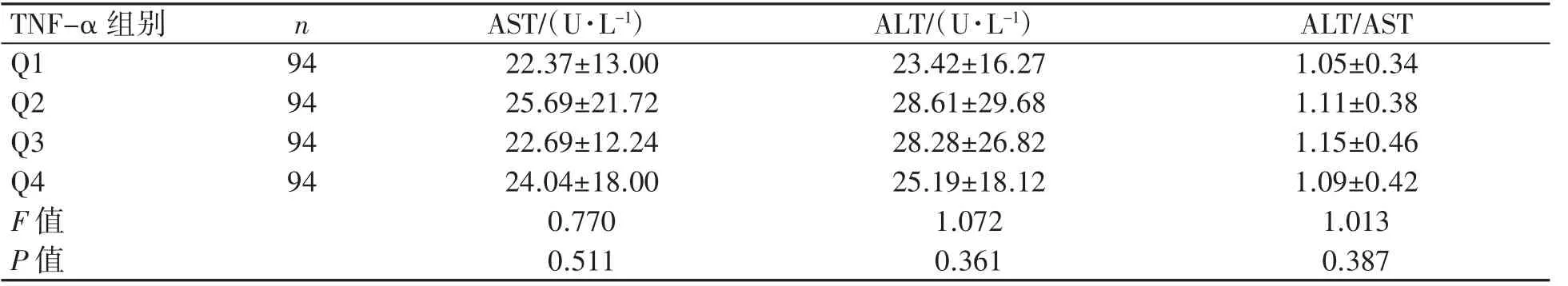
表4 MS患者不同血清TNF-α水平组间肝功能指标比较(±s)
TNF-α组别 n Q1 94 94 94 Q2 Q3 Q4 94 F值P值AST/(U·L-1) ALT/(U·L-1) ALT/AST 22.37±13.00 23.42±16.27 1.05±0.34 25.69±21.72 28.61±29.68 1.11±0.38 22.69±12.24 28.28±26.82 1.15±0.46 24.04±18.00 25.19±18.12 1.09±0.42 0.770 1.072 1.013 0.511 0.361 0.387
2.4 血清TNF-α与WC、HSP-70的偏相关分析
血清TNF-α水平与WC呈正相关(r=0.103,P=0.047)、与HSP-70呈负相关(r=-0.262,P<0.001)。采用偏相关分析剔除血清TNF-α的影响后,WC和HSP-70的相关程度,发现WC和HSP-70在控制血清TNF-α后无相关性(r=0.094,P=0.071)。
3 讨论
胰岛素抵抗是多种代谢性病理改变的结果,包括高度相关的MS发病组件,如腹型肥胖、高甘油三酯血症、HDL-C水平降低、高血压和高血糖[12]。诱导胰岛素抵抗的介质——TNF-α是MS最重要的促炎因子之一,在感染、炎症、肿瘤、创伤等状态或其他病理情况下增加细胞因子并激活炎症信号通路,免疫细胞激活并分泌TNF-α,使TNF-α水平不断升高,MS病程发展速度不断加快[13-14]。
有研究[15]表明,相比WHR和HC,WC更适用于MS评价体系。WC作为诊断MS的依据之一,与TNF-α水平高度相关,广西的一项城乡居民研究显示,在WC水平较高的人群中,MS的患病率高于其他人群[16]。本研究结果显示,TNF-α水平与WC的关系为正相关,TNF-α水平提升越快,WC水平越高。在脂肪细胞和组织中,TNF-α是胰岛素抵抗存在的重要标志,这可能是引起局部和全身肥胖的炎症状态的原因[17]。同时,TNF-α的过度表达对胰岛素信号转导的抑制会影响葡萄糖转运,引起机体肝脏脂肪的沉积,增加肥胖的风险[18-19]。
邱方园等[20]研究提示,在MS的慢性病程持续作用下,长期的生理生化指标异常使HSP-70水平降低,这与本研究HSP-70水平随着血清TNF-α升高而降低的趋势相符。有研究指出[11],免疫系统可能接收HSP-70的抗原信息而产生对应抗体,降低HSP-70的表达。
TNF-α水平与WC和HSP-70有关,随着TNF-α表达增高,WC水平也增高,而HSP-70水平与TNF-α呈负相关。在关于2型糖尿病胰岛素抵抗的研究中,Alemi等[21]对HSP-70和WC的关系探索后得出结论,两者是独立的。HSP-70基因表达和肥胖关系的研究也表明,WC和HSP-70无相关性[11],与本研究控制TNF-α的偏相关分析结果一致。同时纳入方程但最终被排除的还有UA。研究发现,血清UA浓度与MS存在相关性,较低的UA水平已经能够对个体心血管风险状况产生负面影响,增加心血管疾病的病死率[22-23]。本研究中除了Q2组UA水平较高外,其他组UA水平区别不大,代表UA可能只与MS的发病有关。还有研究[24]表明,BMI和HDL-C也与TNF-α水平显著相关。
综上所述,TNF-α作为脂肪细胞和组织中胰岛素抵抗的重要标志,与MS发病组件中肥胖的重要指标WC密切相关。而在MS的慢性病程中,具有保护作用的急性应激产物HSP-70随着血清TNF-α升高而降低表达,持续消耗。

