黄芪甲苷对脂多糖刺激的奶牛乳腺上皮细胞乳蛋白及乳脂合成相关因子表达的影响
樊嘉琦 周学章
(宁夏大学生命科学学院,银川 750000)
乳脂和乳蛋白是衡量乳制品品质的关键营养成分,其中乳脂在牛奶中含量为3%~5%,牛奶乳脂中97%的成分可被人体吸收,牛奶中乳蛋白的含量影响牛奶的营养价值[1]。奶牛乳腺上皮细胞(bovine mammary epithelial cells,BMECs)是乳腺组织中吸收营养物质、执行泌乳功能、与外界直接接触、高度分化的免疫细胞,也是合成和分泌乳脂、乳糖、乳蛋白等营养成分的主要场所[2-3]。牛乳中各种成分会在一定范围内波动,其中乳脂含量是牛乳中最容易产生浮动的指标,奶牛品种、年龄、胎次、泌乳时间等均可影响乳脂的分泌[4-5]。当奶牛乳腺炎发生时,由于乳腺组织的损伤,会导致牛奶中营养成分的降低及产量的下降,在BMECs炎症模型中,乳脂、乳蛋白表达量减少[6-7]。脂多糖(lipopolysaccharides,LPS)是革兰氏阴性菌细胞壁的主要成分,可引起机体及细胞的免疫反应。有研究表明,LPS可引起乳腺组织剧烈的炎症反应,目前LPS刺激BMECs是体外研究奶牛乳腺炎模型的主要方法[6,8]。奶牛乳腺炎的发生会降低乳脂及乳蛋白的合成,影响牛奶的品质及产量,增加奶牛淘汰率,因此,寻找缓解BMECs细胞炎症、保证乳品质的持续发展的药物十分重要。如今发现多种中药及中药提取物可以提升奶牛的泌乳性能,并缓解乳腺炎的发生[1,9-10]。黄芪甲苷(astragalus-Ⅳ,AS-Ⅳ)是中药黄芪的一种提取物,具有抗炎、抗病毒、抗菌、抗癌的功能和增强机体免疫的作用[11]。本课题组前期研究发现,AS-Ⅳ可以抑制LPS刺激的BMECs中炎症因子的表达,并激活细胞中β-酪蛋白的分泌[12]。基于此研究背景,本试验以LPS为炎症诱导剂,研究AS-Ⅳ干预LPS诱导的BMECs中乳脂及乳蛋白合成的影响,为AS-Ⅳ在缓解乳腺炎中的进一步应用提供理论依据。
1 材料与方法
1.1 试验细胞
BMECs由宁夏大学生命科学学院王东老师惠赠,将培养8~15代的BMECs用于试验研究。
1.2 试验仪器及试剂
倒置显微镜(日本奥利巴斯公司);细胞计数仪、酶标仪、荧光定量PCR仪、蛋白电泳仪、蛋白转膜仪(美国Bio-Rad公司);流式细胞仪(美国BD公司)。AS-Ⅳ(北京某科技有限公司);黄芪甲苷-5(6)-羧基二乙酸荧光素琥珀酰亚胺酯复合物(ASIV-CDFA,相对分子质量1 228.43)(南京固与生物有限公司);磷酸盐缓冲液(PBS)(美国Sigma公司);DMEM高糖培养液(以色列Biological Industeies公司);胎牛血清(FBS)、胰蛋白酶(美国Gibco公司);CCK-8试剂盒(日本同人公司);氟化硼二吡咯衍生物(美国GLPBIO公司);脂质过氧化物(LPO)试剂盒、丙二醛(MDA)试剂盒(南京建成生物工程研究所);HiScript Ⅱ Q Select RT SuperMix for qPCR试剂盒、ChamQ Universal SYBR qPCR Master Mix试剂盒(南京诺唯赞生物科技股份有限公司);全蛋白提取试剂盒、BCA试剂盒(江苏凯基生物技术股份有限公司);抗哺乳动物雷帕霉素靶蛋白抗体(bs-1992R)、抗磷酸化哺乳动物雷帕霉素靶蛋白抗体(bs-5331R)(北京博奥森生物技术有限公司);抗β-肌动蛋白(β-actin)抗体(ab8227)(英国Abcam公司)。
1.3 BMECs细胞生物学活性检测
BMECs以1×104个/孔的密度接种在96孔板中,培养24 h使细胞完全贴壁。试验设计不同浓度(12.5、25.0、50.0、100.0、200.0、400.0、800.0 μg/mL)的AS-Ⅳ,与细胞共孵育1、3、6 h,并同时设立对照孔(对照组,不含药物,含细胞及培养基)和空白孔(空白组,不含细胞和药物,只含培养基),每组设置6个重复。弃去培养基,每孔添加含10% CCK-8的培养液,避光孵育3 h,于450 nm处测定吸光度值,并计算细胞存活率,计算公式如下:
细胞存活率(%)=[(样品组-空白组)/(对照组-空白组)]×100。
1.4 BMECs中乳蛋白及乳脂相关基因表达影响
BMECs以2×105个/孔的密度接种在6孔板中,培养24 h使细胞完全贴壁。试验分为8组(每组3个重复),分别为对照组(C组)、LPS刺激组(LPS组,0.5 μg/mL LPS刺激24 h)以及6个AS-Ⅳ干预组,即在0.5 μg/mL LPS刺激24 h后,加入不同浓度的AS-Ⅳ继续培养,6个AS-Ⅳ干预组分别为100 μg/mL AS-Ⅳ刺激1 h组(LPS+100 AS-Ⅳ 1 h组)、100 μg/mL AS-Ⅳ刺激3 h组(LPS+100 AS-Ⅳ 3 h组)、100 μg/mL AS-Ⅳ刺激6 h组(LPS+100 AS-Ⅳ 6 h组)、25 μg/mL AS-Ⅳ刺激6 h组(LPS+25 AS-Ⅳ 6 h组)、50 μg/mL AS-Ⅳ刺激6 h组(LPS+50 AS-Ⅳ 6 h组)、100 μg/mL AS-Ⅳ刺激6 h组(LPS+100 AS-Ⅳ 6 h组)。使用Trizol法提取细胞总RNA,并使用分光光度计检测RNA的纯度及浓度。按照HiScript Ⅱ Q Select RT SuperMix for qPCR试剂盒说明书步骤逆转录合成cDNA。按照ChamQ Universal SYBR qPCR Master Mix试剂盒说明书步骤进行实时荧光定量PCR。反应程序:95 ℃ 3 min;95 ℃ 5 s,60 ℃ 30 s,40个循环;熔解曲线为单峰,β-肌动蛋白作为内参基因,使用2-ΔΔCt法计算基因相对表达量。引物设计参考文献[13-14],具体见表1。
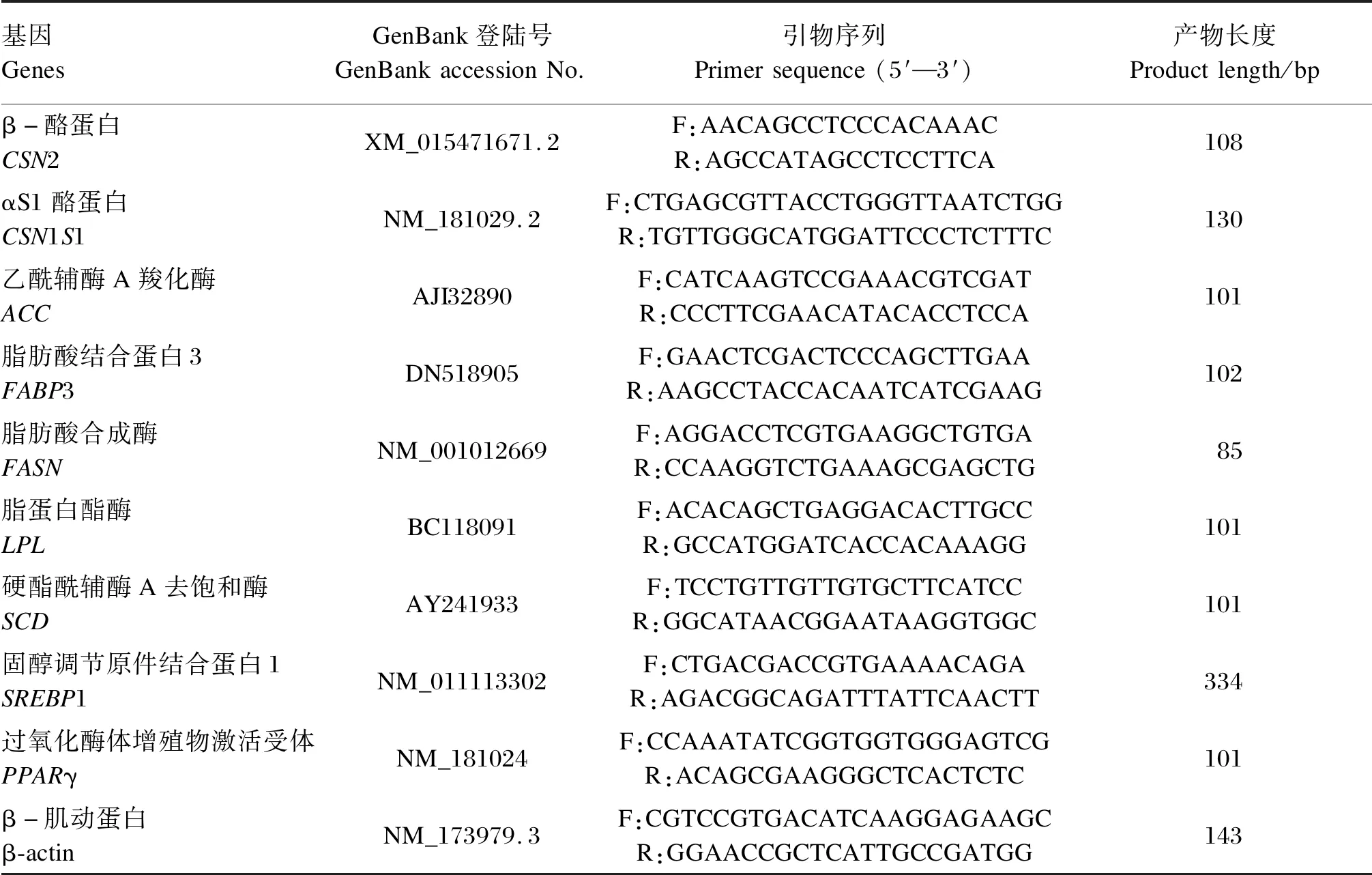
表1 实时荧光定量PCR引物Table 1 Primers for RT-qPCR
1.5 BMECs中MDA、LPO含量的测定
BMECs以2×105个/孔的密度接种在6孔板中,培养24 h使细胞完全贴壁。试验分组同1.4,每组设置3个重复。收集各组中细胞培养液,按照MDA和LPO测定试剂盒说明书进行检测。
1.6 BMECs中脂滴的分泌
BMECs以2×105个/孔的密度接种在放有盖玻片的6孔板中,培养24 h细胞完全贴壁。试验分组同1.4。使用4%的多聚甲醛固定细胞20 min,PBS清洗3次,加入BODIPY495/503染料染色15 min,PBS清洗3次,用含4′,6-二脒基-2-苯基吲哚(DAPI)的抗荧光淬灭封片剂封片,荧光倒置显微镜观察细胞,使用Image J软件检测细胞中平均荧光强度。
1.7 BMECs中mTOR蛋白表达的测定
BMECs以2×105个/孔的密度接种在6孔板中,培养24 h使细胞完全贴壁。试验分组同1.4。使用全蛋白提取试剂盒裂解细胞并收集细胞全蛋白,BCA试剂盒测定蛋白浓度,并调整蛋白含量一致。在含5%浓缩胶、7.5%分离胶的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)中进行蛋白电泳,湿转法将蛋白转移至聚偏二氟乙烯(PVDF)膜。PVDF膜封闭在0.5%的脱脂奶粉中,封闭1 h。4 ℃孵育一抗12 h,TBST缓冲液清洗3次。室温孵育辣根过氧化物酶标记二抗2 h,TBST清洗3次。使用增强型化学学发光显色液(ECL)曝光和拍照。使用Image J软件对哺乳动物雷帕霉素靶蛋白(mTOR)、磷酸化哺乳动物雷帕霉素靶蛋白(p-mTOR)、β-肌动蛋白的蛋白表达进行灰度分析。
1.8 BMECs对ASIV-CFDA摄取量的检测
为检测BMECs可否吸收AS-Ⅳ,将使用荧光倒置显微镜观察ASIV-CDFA在BMECs中的位置,并使用流式细胞术分析ASIV-CDFA在BMECs中的吸收状况与药物刺激时间及浓度的相关性。
BMECs以2×105个/孔的密度接种在放有盖玻片的6孔板中,培养24 h细胞完全贴壁。ASIV-CDFA以100 μg/mL刺激BMECs 1 h,PBS漂洗3次,4%的多聚甲醛固定20 min。用含DAPI的抗荧光淬灭封片剂封片,荧光倒置显微镜观察ASIV-CDFA在BMECs中的位置。
使用流式细胞术分析ASIV-CDFA在BMECs中的吸收状况。BMECs以2×105个/孔的密度接种在6孔板中,培养24 h细胞完全贴壁。0.5 μg/mL LPS刺激BMECs 24 h,加入不同浓度(25、50、100 μg/mL)的ASIV-CDFA,与细胞共孵育1、3、6 h,PBS清洗2次,胰酶消化细胞,PBS清洗细胞后将细胞重悬至Hanks液中,使用流式细胞仪检测细胞摄取的荧光强度。
1.9 统计分析
使用SPSS 22.0软件对试验数据进行单因素方差分析(one-way ANOVA),数据均以平均值和标准差表示,P<0.05为差异显著。
2 结果与分析
2.1 不同浓度及不同时间AS-Ⅳ对BMECs细胞活性的影响
如图1所示,AS-Ⅳ对细胞的毒性作用会随着刺激浓度的提高和刺激时间的延长而增加。在浓度为100 μg/mL的AS-Ⅳ刺激BMECs 1、3、6 h时,细胞存活率分别为100%、96%、92%,25%、50%、100 μg/mL的AS-Ⅳ刺激BMECs 6 h时,细胞存活率分别为96%、95%、92%,在此时间及浓度下细胞存活率在90%以上,将选取以上浓度及时间作为后续试验条件。
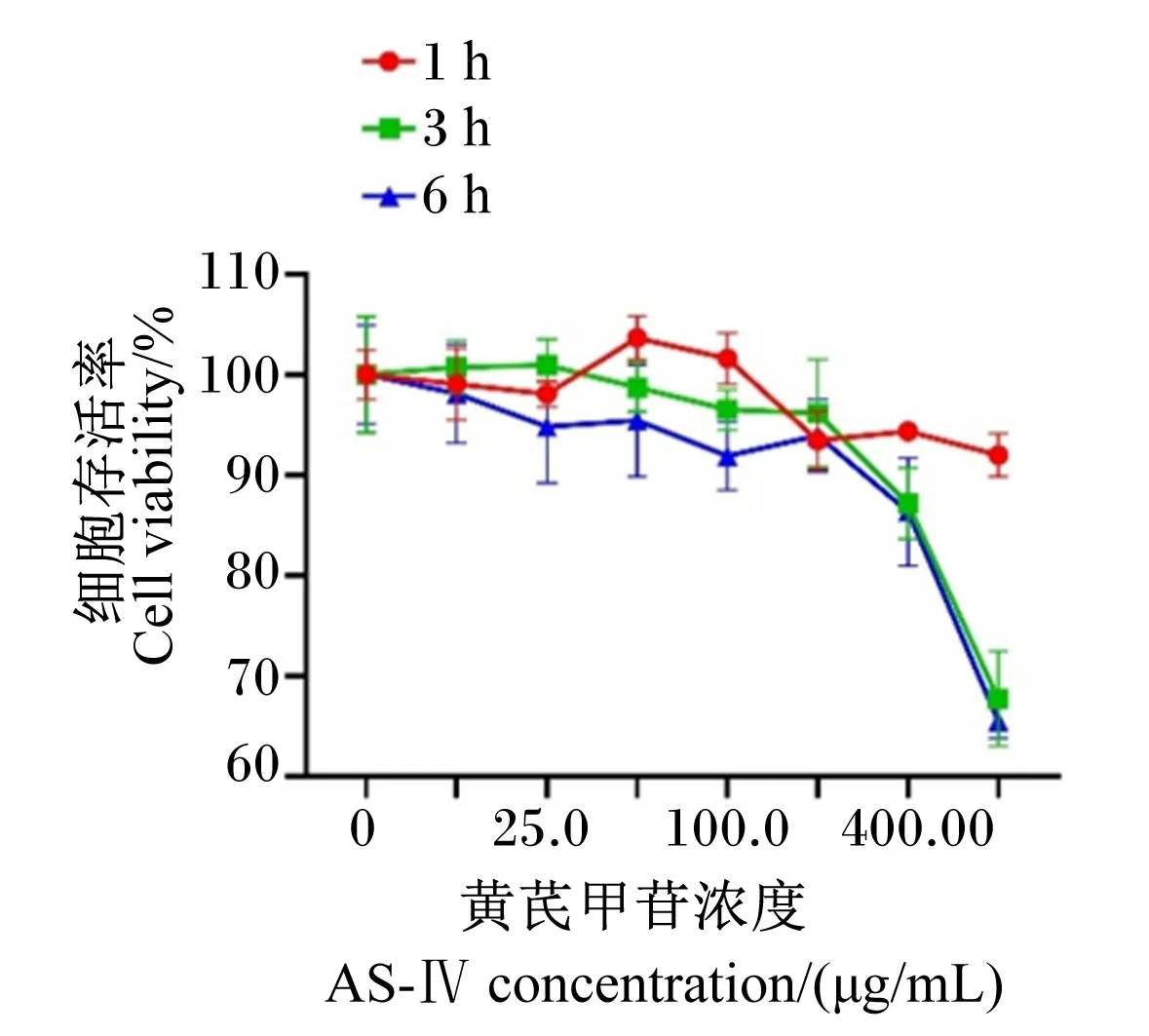
图1 AS-Ⅳ对BMECs细胞活性的影响Fig.1 Effects of AS-Ⅳ on BMECs cell activity
2.2 AS-Ⅳ对LPS刺激的BMECs乳蛋白相关基因表达的影响
如图2所示,与对照组相比,LPS刺激BMECs会显著抑制细胞中β-酪蛋白(CSN2)及αS1-酪蛋白(CSN1S1)基因相对表达量(P<0.05);与LPS组相比,各AS-Ⅳ组细胞中CSN2基因相对表达量均显著升高(P<0.05),但AS-Ⅳ对炎症细胞中CSN1S1基因相对表达量无激活作用,100 μg/mL AS-Ⅳ刺激细胞1 h会显著抑制炎症细胞中CSN1S1基因相对表达量(P<0.05)。
2.3 AS-Ⅳ对LPS刺激的BMECs乳脂合成相关基因表达的影响
如图3所示,与对照组相比,LPS显著抑制脂肪酸结合蛋白3(FABP3)、脂肪酸合成酶(FASN)、固醇调节元件结合蛋白1(SREBP1)基因相对表达量(P<0.05)。与LPS组相比,各个浓度的AS-Ⅳ可以显著提高FABP3基因相对表达量(P<0.05),100 μg/mL AS-Ⅳ刺激炎症细胞1 h显著升高FASN、乙酰辅酶A羧化酶(ACC)、脂蛋白酯酶(LPL)基因相对表达量(P<0.05),25 μg/mL AS-Ⅳ刺激细胞6 h显著提高过氧化酶体增殖物激活受体γ(PPARγ)基因相对表达量(P<0.05),50 μg/mL AS-Ⅳ刺激细胞6 h显著提高LPL基因相对表达量(P<0.05)。
2.4 AS-Ⅳ对LPS刺激的BMECs脂质相关因子含量的影响
如图4所示,与对照组相比,LPS显著提高细胞上清液中LPO和MDA含量(P<0.05);与LPS组相比,各AS-Ⅳ组均可显著降低炎症细胞中MDA含量(P<0.05),25、50、100 μg/mL的AS-Ⅳ刺激细胞6 h显著降低炎症细胞中LPO含量(P<0.05)。
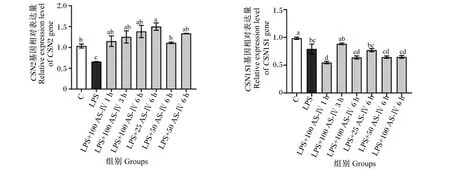
CSN2:β-酪蛋白 β-casein;CSN1S1:αS1酪蛋白 αs1-casein。C:对照组;LPS:0.5 μg/mL LPS刺激组;LPS+100 AS-Ⅳ 1 h:0.5 μg/mL LPS刺激24 h+100 μg/mL AS-Ⅳ刺激1 h;LPS+100 AS-Ⅳ 3 h:0.5 μg/mL LPS刺激24 h+100 μg/mL AS-Ⅳ刺激3 h;LPS+100 AS-Ⅳ 6 h:0.5 μg/mL LPS刺激24 h+100 μg/mL AS-Ⅳ刺激6 h;LPS+25 AS-Ⅳ 6 h:0.5 μg/mL LPS刺激24 h+25 μg/mL刺激AS-Ⅳ 6 h;LPS+50 AS-Ⅳ 6 h:0.5 μg/mL LPS刺激24 h+50 μg/mL AS-Ⅳ刺激6 h。数据柱标注不同小写字母表示差异显著(P<0.05)。下图同。C: control group; LPS: 0.5 μg/mL LPS stimulation group; LPS+100 AS-Ⅳ 1 h: 0.5 μg/mL LPS for 24 h+100 μg/mL AS-Ⅳ for 1 h; LPS+100 AS-Ⅳ 3 h: 0.5 μg/mL LPS for 24 h+100 μg/mL AS-Ⅳ for 3 h; LPS+100 AS-Ⅳ 6 h: 0.5 μg/mL LPS for 24 h+100 μg/mL AS-Ⅳ for 6 h; LPS+25 AS-Ⅳ 6 h: 0.5 μg/mL LPS for 24 h+25 μg/mL AS-Ⅳ for 6 h; LPS+50 AS-Ⅳ 6 h: 0.5 μg/mL LPS for 24 h+50 μg/mL AS-Ⅳ for 6 h. Data columns with different lowercase letters indicate significant difference (P<0.05). The same as below.图2 AS-Ⅳ对LPS刺激的BMECs中CSN2、CSN1S1基因相对表达量的影响Fig.2 Effects of AS-Ⅳ on relative expression levels of CSN2 and CSN1S1 genes in LPS-stimulated BMECs
如图5所示,LPS预处理后脂滴表达量降低,100 μg/mL的AS-Ⅳ刺激细胞1 h及25、50 μg/mL的AS-Ⅳ刺激细胞6 h显著提高炎症细胞中脂滴的含量(P<0.05)。
2.5 AS-Ⅳ对LPS刺激的BMECs中p-mTOR、mTOR蛋白表达的影响
如图6所示,与对照组相比,LPS组p-mTOR蛋白被显著抑制(P<0.05);与LPS组相比,AS-Ⅳ刺激炎症细胞时,25,100 μg/mL的AS-Ⅳ刺激细胞6 h可显著激活炎症细胞中p-mTOR蛋白的表达(P<0.05)。
2.6 BMECs对ASIV-CFDA的摄取
ASIV-CDFA以100 μg/mL刺激BMECs 1 h,发现BMECs可吸收ASIV-CDFA,并在细胞质中聚集(图7)。之后使用流式细胞仪检测了在炎症状态下,BMECs所吸收的ASIV-CDFA荧光强度,结果如图8所示,在同一时间中,ASIV-CDFA的细胞吸收量会随着浓度的升高而增高;但同一浓度中,ASIV-CDFA的细胞吸收量却没有随时间的延长而提高。
3 讨 论
奶牛乳腺炎是奶牛中频发发作、对乳业生产影响最严重的疾病之一,乳腺炎的发生会影响乳脂、乳蛋白的合成[6]。当发生临床性乳腺炎时,乳汁的颜色变为灰白色或黄褐色、浓度变稀、伴有絮状沉淀物等明显变化;发生隐性乳腺炎时,虽肉眼不能观察到乳汁颜色变化,但乳汁成分发生改变,其中乳脂、乳糖等含量显著降低[15-16]。LPS是革兰氏阴性菌细胞壁的主要成分,当革兰氏阴性菌入侵乳腺组织,细菌大量繁殖时或治疗乳腺炎细菌裂解死亡时,LPS会被大量释放,其中BMECs对LPS高度敏感,短时间内可引起细胞中炎症因子的大量分泌,LPS刺激BMECs是体外研究乳腺炎病理的理想模型之一[17]。AS-Ⅳ是我国传统常用中药黄芪的主要活性物质,可作为评价黄芪质量的重要标志物,在抗炎、抗氧化、抗病毒、抗应激等方面具有显著效果[18-19]。本课题组前期研究发现,AS-Ⅳ可抑制LPS损伤的BMECs炎症因子及氧化因子的表达,提高LPS损伤的BMECs中β-酪蛋白表达[12],本试验进一步观察了不同时间和浓度的AS-Ⅳ对炎症细胞中乳蛋白及乳脂合成相关因子的影响。
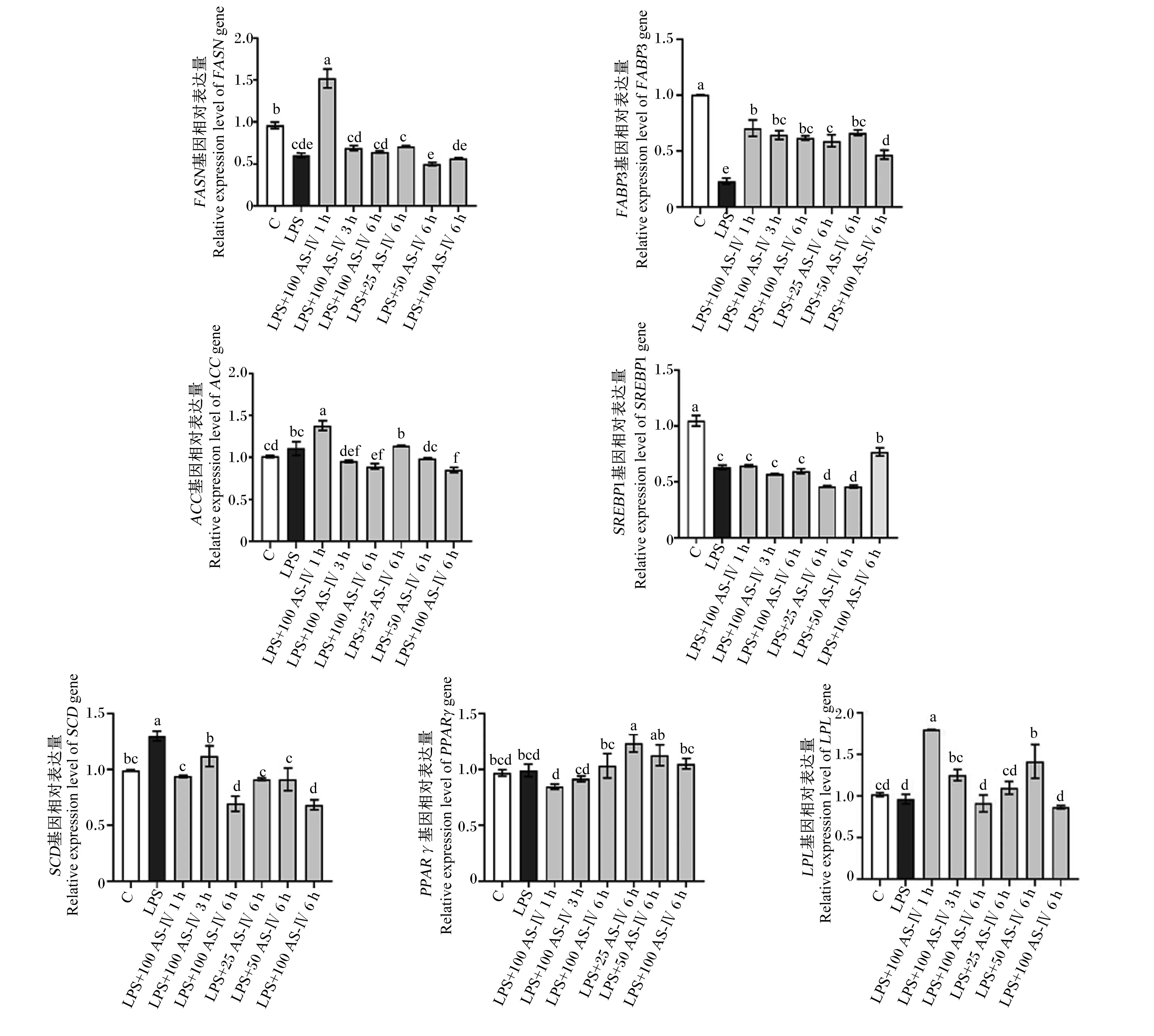
ACC:乙酰辅酶A羧化酶 acetyl CoA carboxylase;FABP3:脂肪酸结合蛋白3 fatty acid-binding protein 3;FASN:脂肪酸合成酶 fatty acid synthetase;LPL:脂蛋白酯酶 lipoprotein lipase;SCD:硬酯酰辅酶A去饱和酶 stearoyl-CoA-desaturase;SREBP1:固醇调节原件结合蛋白1 sterol regulatory element binding proteins 1;PPARγ:过氧化酶体增殖物激活受体γ peroxisome proliferators-activated receptors γ。图3 AS-Ⅳ对LPS刺激的BMECs中FABP3、ACC、FASN、PPARγ、LPL、SCD、SREBP1基因相对表达量影响Fig.3 Effects of AS-Ⅳ on relative expression levels of FABP3, ACC, FASN, PPARγ, LPL, SCD and SREBP1 genes in LPS-stimulated BMECs
大多研究认为,酪蛋白基因的表达是影响酪蛋白合成和分泌的关键因素,但酪蛋白的分泌还会受到其他营养物质的影响,在炎症状态下,用于合成酪蛋白的营养物质及前体物会被用于抗炎,因此导致酪蛋白基因的表达量降低[20-21]。100 mL牛乳中总蛋白质含量约为3.3 g,其中酪蛋白可占总蛋白质含量的80%,剩余20%为乳清蛋白,酪蛋白分为4类,分别是CSN1S1(约40%)、CSN2(约36%)、κ-酪蛋白(约14%)、αs2-酪蛋白(约10%),α-酪蛋白及β-乳球蛋白是乳蛋白中引起过敏的主要蛋白质[22]。胡耀等[23]发现LPS刺激BMECs会抑制CSN2、CSN1S1基因及蛋白的表达,LPS还可抑制细胞中mTOR基因的表达,黄花蒿乙醇提取物可以拮抗LPS对BMECs中乳蛋白的抑制。田青等[20]发现,LPS刺激大鼠乳腺上皮细胞会抑制细胞中CSN2、乳清蛋白(α-LA)基因的表达,但增强CSN1S1基因的表达,并推测CSN2与CSN1S1基因之间的拮抗作用是由于CSN1S1基因部分承担炎症免疫调节作用所导致。本试验研究结果发现,LPS刺激BMECs时会抑制乳蛋白合成相关基因CSN2、CSN1S1基因的相对表达,与胡耀等[23]研究结果相似;100 μg/mL的AS-Ⅳ刺激炎症细胞1、3、6 h和25、50、100 μg/mL的AS-Ⅳ刺激炎症细胞6 h均可提高细胞中CSN2基因相对表达,但各个AS-Ⅳ组之间无显著差异;AS-Ⅳ不能提高炎症细胞中CSN1S1基因相对表达,且100 μg/mL AS-Ⅳ刺激细胞1 h显著抑制了炎症细胞中CSN1S1基因相对表达量,并推测AS-Ⅳ可能通过提高炎症细胞中的CSN2含量,从而调节酪蛋白的组成成分。
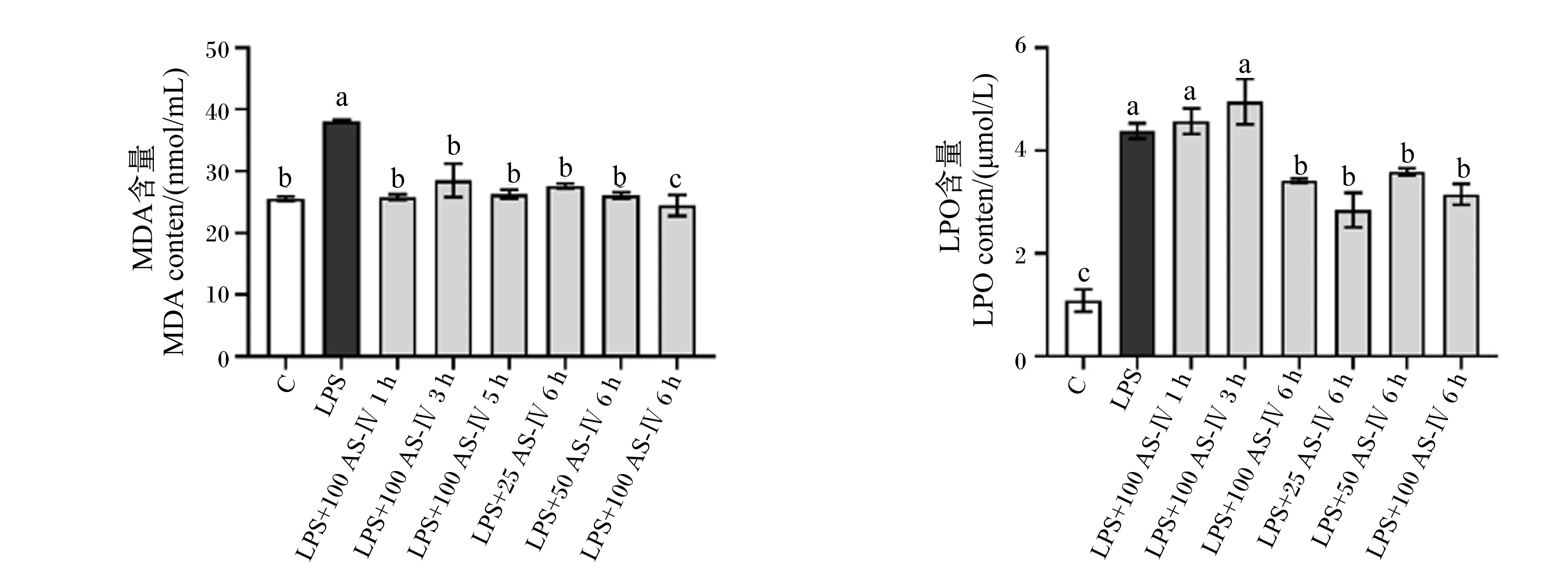
MDA:丙二醛 malondialdehyde;LPO:脂质过氧化物 lipid peroxidase。图4 AS-Ⅳ对LPS刺激的BMECs中MDA、LPO含量的影响Fig.4 Effects of AS-Ⅳ on MDA and LPO contents in LPS-stimulated BMECs
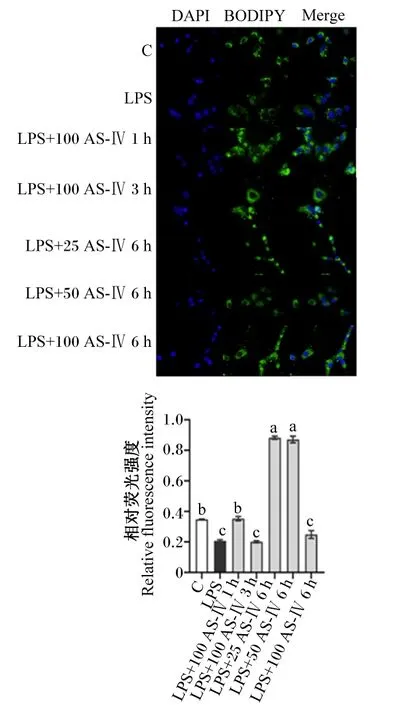
图5 AS-Ⅳ对LPS刺激的BMECs中BODIPY脂滴荧光染色图及荧光染色量化结果图Fig.5 Fluorescence staining of BODIPY lipid droplets in LPS-stimulated BMECs by AS-Ⅳ and quantification results of fluorescence staining (40×)
乳脂是牛奶中的另一主要成分,其中短链脂肪酸可在乳腺中合成,长链脂肪酸由血液运输中获取[1,13]。当奶牛泌乳期时,BMECs细胞代谢速度增高,导致细胞中活性氧(ROS)的沉积增多,当过量的ROS沉积会引起细胞损伤,并攻击细胞中的不饱和脂肪酸,引起细胞中的脂质过氧化物的沉积[24]。MDA和LPO是细胞中活性氧和不饱和脂肪酸作用后的氧自由基产物,是反映细胞中脂质过氧化程度的指示剂,并间接反映细胞损伤程度[25]。本试验发现AS-Ⅳ可显著抑制炎症细胞中MDA的含量,25、50、100 μg/mL的AS-Ⅳ刺激细胞6 h可显著抑制炎症细胞中LPO的含量,100 μg/mL的AS-Ⅳ刺激细胞1 h及25、50 μg/mL的AS-Ⅳ刺激细胞6 h显著提高炎症细胞中脂滴的含量。FASN及ACC是合成短链脂肪酸的关键因子,可调控脂肪酸的初始合成及碳链延伸,FABP3及LPL是参与长链脂肪酸摄取及转运的关键因子,硬酯酰辅酶A去饱和酶(SCD)是催化饱和脂肪酸形成不饱和脂肪酸关键因子,PPARγ及SREBP1是影响长链脂肪酸代谢并调控脂肪合成的重要因子[13,26]。本试验研究发现,当LPS刺激BMECs会降低脂滴含量,抑制细胞中乳脂合成相关基因FABP3、FASN、SREBP1基因相对表达量,提高细胞中脂质氧化相关因子LPO和MDA含量。Wang等[27]研究发现,LPS处理后的BMECs中SREBP1、FASN、ACC基因在转录水平显著下调,与本试验研究结果相似。AS-Ⅳ在不同的刺激时间和刺激浓度提高乳蛋白合成相关基因的效果不同,其中100 μg/mL AS-Ⅳ刺激炎症细胞,刺激时间为1 h比3、6 h对细胞中ACC、FASN、LPL基因激活表达更佳,使用ASIV-CDFA观察炎症细胞对AS-Ⅳ的吸收效果发现,AS-Ⅳ的吸收量会呈浓度依赖性升高,但没有呈时间依赖性升高。这可能是因为AS-Ⅳ的细胞吸收量无显著差异时,AS-Ⅳ刺激细胞首先调控了脂肪酸从头合成相关ACC、FASN基因和乳糜摄取相关的LPL基因,之后再影响SCD、PPARγ基因的表达。AS-Ⅳ不仅可以激活乳脂合成相关基因的表达,而且对细胞中的脂质氧化有抑制作用,抑制细胞损伤。
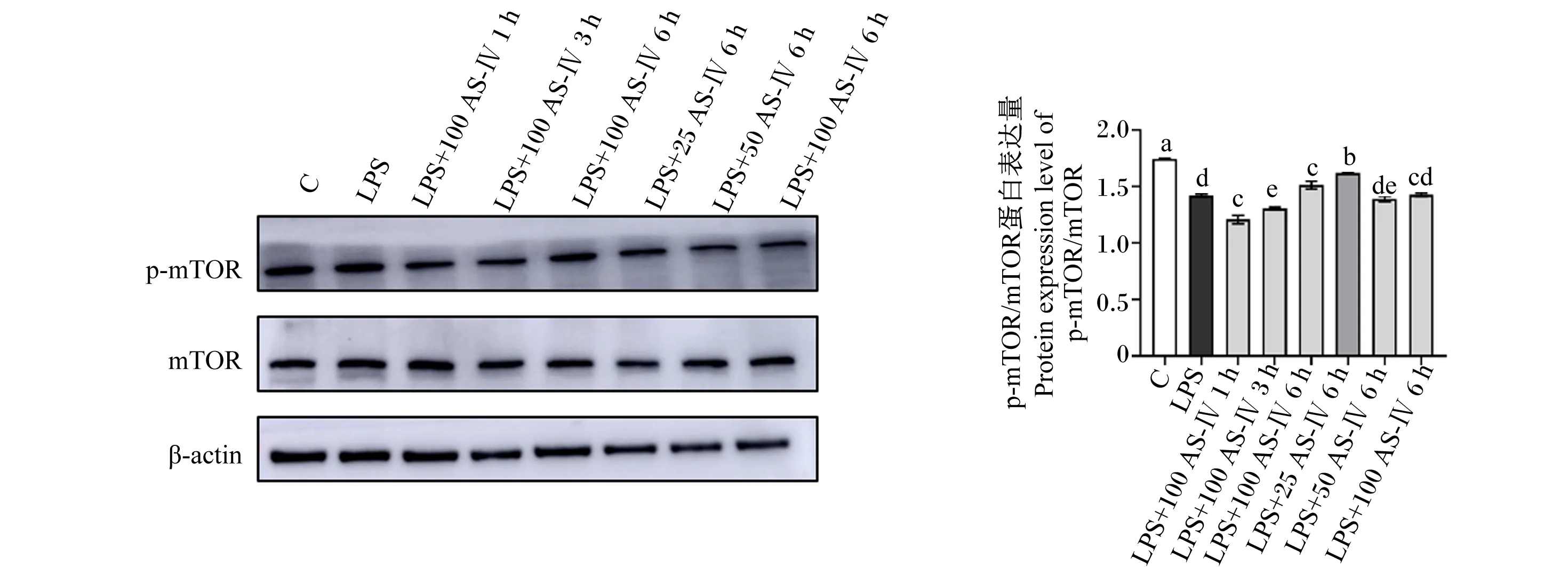
图6 AS-Ⅳ对LPS刺激的BMECs中p-mTOR、mTOR蛋白表达的影响Fig.6 Effects of AS-Ⅳ on expression of p-mTOR and mTOR proteins in LPS-stimulated BMECs
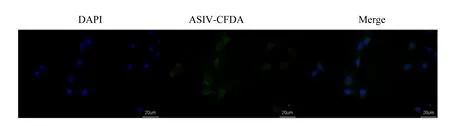
图7 100 μg/mL的ASIV-CDFA刺激BMECs 1 h细胞图Fig.7 Graph of 100 μg/mL ASIV-CDFA stimulated BMECs for 1 h (40×)
mTOR信号通路广泛存在于多种细胞中,影响细胞的转录、翻译、增殖、凋亡等多种生命活动,在BMECs中还会影响细胞中乳脂和乳蛋白的合成[28]。mTOR信号对于细胞中脂肪酸合成及转录调控因子PPARγ、SREBP1的表达具有调控作用,对于乳蛋白的合成、翻译过程发挥重要作用[1,29]。本研究结果发现,在LPS刺激细胞后,p-mTOR蛋白被显著抑制,25、100 μg/mL的AS-Ⅳ刺激炎症细胞6 h时p-mTOR蛋白表达显著提高。这提示AS-Ⅳ可能激活炎性细胞中mTOR信号通路,从而缓解LPS对乳蛋白和乳脂的抑制作用,并抑制细胞上清液中脂质氧化物的表达。但AS-Ⅳ如何通过影响mTOR信号通路中关键因子的表达,从而影响乳脂及乳蛋白的合成;在不同时间点,细胞对AS-Ⅳ的吸收量不变,但是不同时间点对CSN1S1、FASN、ACC、SCD、LPL、LPO的响应不同的原因和机制尚不明确,具体机制仍需进一步试验深入研究。
4 结 论
在体外培养环境下,LPS刺激BMECs会抑制细胞中乳脂及乳蛋白合成相关基因的表达,激活脂质过氧化物MDA及LPO的产生。AS-Ⅳ可提高炎症细胞中FABP3、ACC、FASN、PPARγ、LPL、SCD、CSN2基因相对表达量,降低炎症细胞上清液中MDA、LPO含量,从而起到保护细胞的作用;AS-Ⅳ可通过激活mTOR信号通路,调节乳脂及乳蛋白合成关键调控基因的表达。
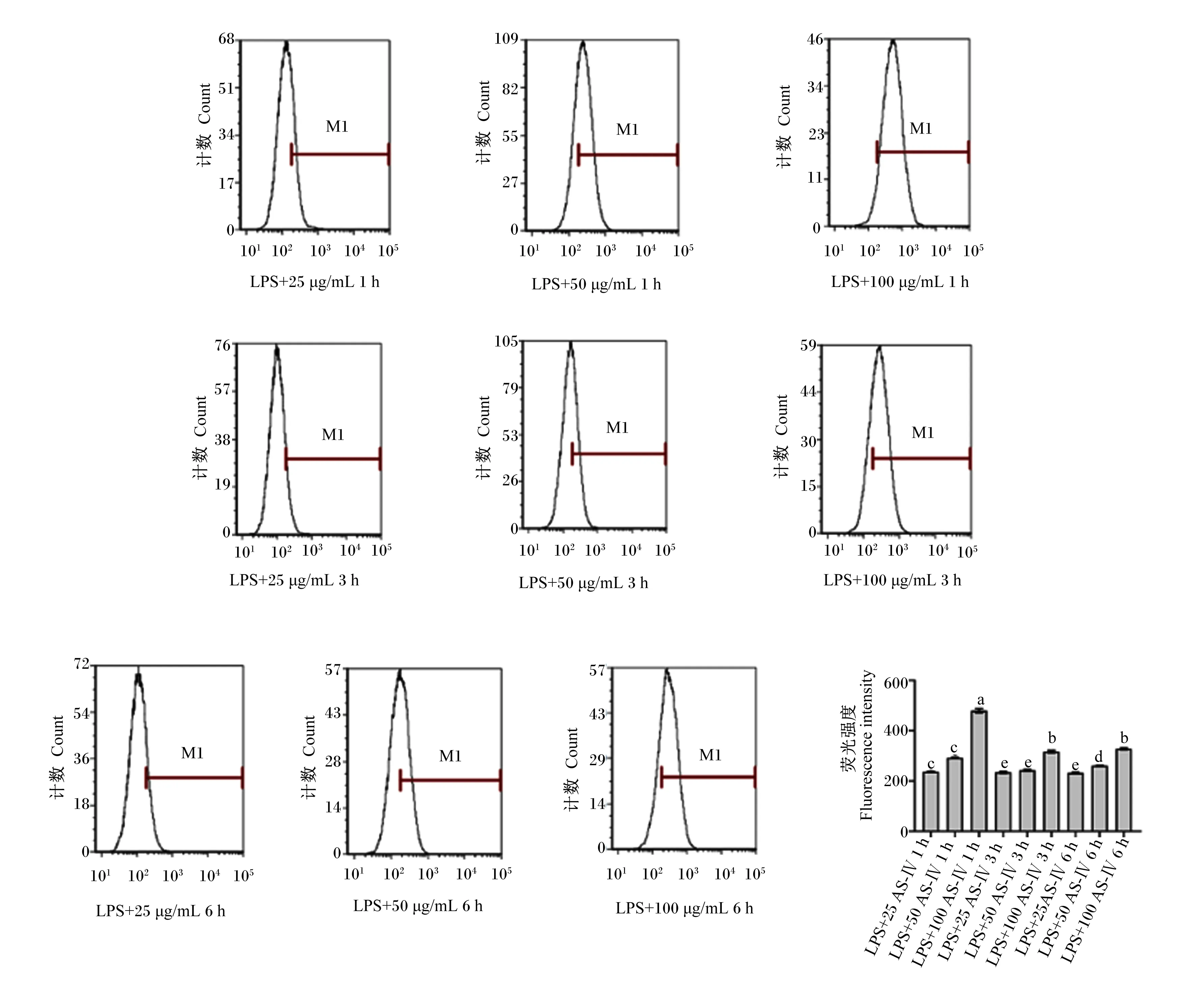
图8 BMECs对ASIV-CDFA的摄取Fig.8 Uptake of ASIV-CDFA by BMECs

