饲粮中发酵豆渣添加水平对不同品种山羊营养物质消化代谢的影响
刘 远 吴贤锋 王迎港 李文杨*
(1.福建省农业科学院畜牧兽医研究所,福州 350013;2.福建省畜禽遗传育种重点实验室,福州 350013;3.福建农林大学动物科技学院,福州 350001)
豆渣(soybean curd residue)是生产豆浆、豆腐、豆粉、腐竹等豆制品的副产物,我国每年产生湿豆渣超过2 000万t,其粗蛋白质(CP)含量约为20%[干物质(DM)基础],氨基酸组成和比例与大豆基本一致,是一种潜在可替代常规畜禽饲料原料的饲料资源[1-3]。新鲜豆渣含水量高,且含有胰蛋白酶抑制因子、皂苷和单宁等抗营养因子,影响畜禽适口性和利用效率,不易储存和鲜饲。烘干豆渣的能耗高,还会降低其营养价值[4],在生产中多通过发酵工艺实现豆渣的贮存和营养价值的改善。大量研究证实,采用化学添加剂[5]、纤维素酶[6-7]和微生物[8]等单独或复合发酵处理豆渣及混合豆渣饲料均能改善发酵品质和有氧稳定性。
发酵豆渣的饲料化利用已经取得了一定的进展。研究表明,饲料中添加适量发酵豆渣可促进建鲤、鲫鱼和大口黑鲈等水产动物生长[9]。利用发酵豆渣饲喂育肥猪可替代部分蛋白质饲料,减少饲养成本[10],还有助于控制猪肠道细菌耐药性,可用于无抗猪肉的生产实践[11]。在反刍动物中,高红[12]应用康奈尔净碳水化合物-蛋白质体系(CNCPS)和NRC模型评价了豆渣的奶牛营养价值,结果表明豆渣的过瘤胃蛋白质和可代谢蛋白质含量较高,具有替代奶牛饲粮中部分蛋白质饲料的潜力。Zhao等[13]研究表明,豆渣与玉米秸秆的混合发酵饲料能改善奶牛瘤胃发酵环境,提高生产性能。发酵豆渣在肉羊生产中也有广泛的应用,但国内相关研究鲜有报道,缺乏肉羊高效利用发酵豆渣资源的科学依据。另外,我国猪、奶牛等养殖的品种较统一,而肉羊的品种丰富,品种间体型和生产性能差异大,不同品种对同一饲料资源的利用效率也不尽相同[14-15]。鉴于此,本研究以发酵豆渣为对象,分别以大体型努比亚山羊以及福建省中小体型地方山羊品种福清山羊和闽东山羊为试验动物,开展消化代谢试验,测定饲粮中不同发酵豆渣添加水平对不同品种山羊营养物质消化代谢的影响,评价发酵豆渣在不同肉用山羊品种中的营养价值,为发酵豆渣在肉羊中的饲料化高效利用提供参考。
1 材料与方法
1.1 样品采集与制备
2021年4月,于古田县文泰来农牧开发有限公司采集试验用新鲜豆渣(黄豆生产豆腐后的副产物)2 t,利用四川高福记生物科技有限公司提供的复合微生物发酵剂(500 g,植物乳杆菌数量≥3.0×108CFU/g,屎肠球菌数量≥1.0×108CFU/g)均匀混合后进行桶装(120 L)密封发酵。发酵7 d后全部取出,按分点取样法采集发酵豆渣样品约5 kg用于常规营养成分分析。剩余的发酵豆渣经过挤压脱水机脱水后粉碎加工,用于消化代谢试验。
1.2 样品营养成分测定分析
发酵豆渣、试验饲粮和粪样中的DM、粗灰分(Ash)和有机物(OM)含量参考刘远等[14]的方法进行测定。总能(GE)采用氧弹式热量计测定;CP含量按照GB/T 6432—2018[16]测定;粗脂肪(EE)含量按照GB/T 6433—2006[17]测定;磷(P)含量按照GB/T 6437—2002[18]测定;钙(Ca)含量按照GB/T 13885—2017[19]测定;中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量采用Van Soest[20]的方法(CAU滤袋,购自中国农业大学)测定。消化代谢试验中的尿氮含量采用凯氏定氮法测定。
1.3 消化代谢试验
1.3.1 试验设计及饲养管理
试验于2021年5—8月份在福建省农业科学院渔溪试验基地内进行,按照努比亚山羊、闽东山羊和福清山羊分批进行消化代谢试验。为了保持试验羊采食饲粮营养水平的一致,按照品种间体重相近、品种内年龄相近的原则,每个山羊品种选用体况良好的3~5月龄生长期羯羊24只,努比亚山羊、闽东山羊和福清山羊试验羊的体重分别为(15.40±1.23) kg、(15.38±1.32) kg和(15.46±1.27) kg。每个品种分为4个组,每组6个重复,每个重复1只羊。对照组(CON组)饲喂不含发酵豆渣的基础饲粮,试验组分别饲喂发酵豆渣添加水平为10%、20%和30%的试验饲粮。
试验期间,试验羊均单独圈养于自制消化代谢笼(规格为1.5 m×0.8 m)内,分别饲喂基础饲粮和3个试验饲粮,基础饲粮营养水平参照《肉羊饲养标准》(NY/T 816—2004)15 kg体重育肥山羊日增重150 g的营养需要配制[21]。所有饲粮全部制成颗粒饲料(环模压缩比8∶1,直径5 mm,长10 mm),参照刘洁[22]的方法计算饲粮的代谢能(ME),饲粮组成及营养水平见表1。
1.3.2 消化代谢试验方法
消化代谢试验参考赵明明等[23]报道的方法设计。试验前对所有试验羊只进行统一驱虫、健胃。消化代谢试验全期17 d,预试期10 d,正试期7 d。预试期间试验羊的饲粮逐渐过渡到试验饲粮。正试期内每只羊每日饲喂500 g试验饲粮(DM基础),分别于09:00、17:00各饲喂全天饲粮的1/2,自由饮水。自制消化代谢笼可实现粪便与尿液自动分离,采用全收粪尿法收集粪尿。每日晨饲前1 h收集、称取和记录每只试验羊前1天的粪样、尿样。每日按总粪样的10%取样后自封袋密封,-20 ℃冷冻保存;用装有200 mL 10% H2SO4的塑料桶收集尿液,稀释至5 L,对稀释尿液充分混合,用纱布过滤后取样100 mL,置于EP管内-20 ℃冷冻保存。试验结束后,粪样室温解冻,于65℃烘干48 h,回潮24 h后粉碎过40目筛网,用于营养物质的分析测试。试验正试期开始及结束时,逐只对试验羊进行空腹称重,记录始重(IBW)和末重(FBW),计算平均日增重(ADG)。

表1 饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of diets (DM basis) %
1.3.3 计算公式
饲粮及饲料原料中DM、OM、CP、GE、NDF和ADF的全肠道表观消化率参照Adeola[24]的公式计算,计算公式如下:
营养物质全肠道表观消化率(%)=100×(食入的该营养物质含量-排出的该营养物质含量)/食入的该营养物质含量。
饲粮的氮代谢相关指标的计算公式[20]如下:
沉积氮(g/d)=食入氮-粪氮-尿氮;氮沉积率(%)=100×沉积氮/食入氮;氮生物学价值(%)=100×沉积氮/吸收氮。
1.4 数据统计与分析
以山羊品种和发酵豆渣添加水平为分析因素,分析消化代谢试验数据,采用SPSS 26.0软件的一般线性模型中的单变量程序进行双因素方差分析,并应用Duncan氏法进行多重比较,P<0.05为差异显著。
2 结果与分析
2.1 发酵豆渣常规营养成分
由表2可知,发酵豆渣的GE为16.07 MJ/kg,CP、NDF、ADF、Ash、Ca和P含量分别为17.06%、52.81%、24.10%、3.40%、0.44%和0.18%。

表2 发酵豆渣常规营养成分含量(干物质基础)Table 2 Conventional nutrient contents of fermented soybean curd residue (DM basis)
2.2 山羊品种和发酵豆渣添加水平对试验羊生长性能的影响
由表3可知,各组试验羊的DMI和ADG分别为565.01~625.56 g/d和69.76~107.62 g/d,山羊品种和发酵豆渣添加水平的交互作用对DMI、ADG、IBW和FBW的影响均不显著(P>0.05),而山羊品种和发酵豆渣添加水平均显著影响DMI和ADG(P<0.05)。由表4和表5可知,闽东山羊的DMI显著高于努比亚山羊(P<0.05);FSR10组的DMI最高,显著高于CON组和FSR30组(P<0.05),CON组的DMI最低,显著低于各试验组(P<0.05)。闽东山羊和福清山羊的ADG显著高于努比亚山羊(P<0.05),FSR10组和FSR20组的ADG显著高于FSR30组和CON组(P<0.05)。
2.3 山羊品种和发酵豆渣添加水平对试验羊营养物质消化代谢的影响
由表3可知,试验羊对饲粮中DM、OM、CP、GE、NDF和ADF的全肠道表观消化率分别为62.17%~67.28%、62.38%~68.74%、75.26%~79.07%、60.01%~66.76%、53.11%~60.06%和39.08%~52.80%。山羊品种和发酵豆渣添加水平的交互作用对DM、OM、CP、GE、NDF和ADF的全肠道表观消化率的影响均不显著(P>0.05)。发酵豆渣添加水平显著影响DM、OM、CP、GE、NDF和ADF的全肠道表观消化率(P<0.05),而山羊品种仅显著影响ADF的全肠道表观消化率(P<0.05)。
由表4可知,福清山羊对ADF的全肠道表观消化率显著高于闽东山羊和努比亚山羊(P<0.05)。由表5可知,CON组DM、OM和GE的全肠道表观消化率显著高于各试验组(P<0.05);FSR10组NDF的全肠道表观消化率显著低于其他组(P<0.05);CON组和FSR20组ADF的全肠道表观消化率显著高于其他组(P<0.05),FSR30组ADF的全肠道表观消化率显著高于FSR10组(P<0.05);FSR10组CP的全肠道表观消化率显著高于其他各组(P<0.05),FSR30组CP的全肠道表观消化率显著低于其他各组(P<0.05)。
2.4 山羊品种和发酵豆渣添加水平对试验羊氮代谢的影响
由表3可知,试验羊的氮摄入量、粪氮、尿氮、沉积氮、氮沉积率和氮生物学价值分别为10.80~13.66 g/d、2.49~3.08 g/d、1.30~2.67 g/d、5.91~9.47 g/d、47.51%~69.27%和63.05%~87.85%。山羊品种和发酵豆渣添加水平的交互作用显著影响尿氮、沉积氮、氮沉积率和氮生物学价值(P<0.05),而对氮摄入量和粪氮影响不显著(P>0.05)。山羊品种和发酵豆渣添加水平均显著影响试验羊的氮摄入量、尿氮、沉积氮、氮沉积率和氮生物学价值(P<0.05)。由表4和表5可知,努比亚山羊的氮摄入量显著低于福清山羊和闽东山羊(P<0.05);不同发酵豆渣添加水平组之间的氮摄入量均差异显著(P<0.05),为FSR10组>FSR20组>FSR30组>CON组。
由表3可知,对于努比亚山羊,FSR20组和FSR30组的尿氮显著高于FSR10组和CON组(P<0.05),CON组的尿氮显著高于FRS10组(P<0.05);FRS10组的沉积氮、氮沉积率和氮生物学价值均显著高于其他各组(P<0.05)。这表明该品种对10%发酵豆渣添加水平的氮利用效率最优,随着发酵豆渣添加水平的进一步增加,饲粮中不能被吸收利用的氮随粪尿排出,降低饲粮氮生物学价值。
由表3可知,对于福清山羊,FSR30组的尿氮显著高于其他各组(P<0.05);FSR10组的沉积氮显著高于其他各组(P<0.05),FSR20组的沉积氮显著高于FSR30组和CON组(P<0.05);FSR10组的氮沉积率、氮生物学价值显著高于其他各组(P<0.05),FSR30组的氮沉积率、氮生物学价值显著低于其他各组(P<0.05)。这表明福清山羊对不同发酵豆渣添加水平饲粮氮代谢的作用与努比亚山羊较相似,而福清山羊对20%发酵豆渣添加水平的氮利用效率略高于努比亚山羊。
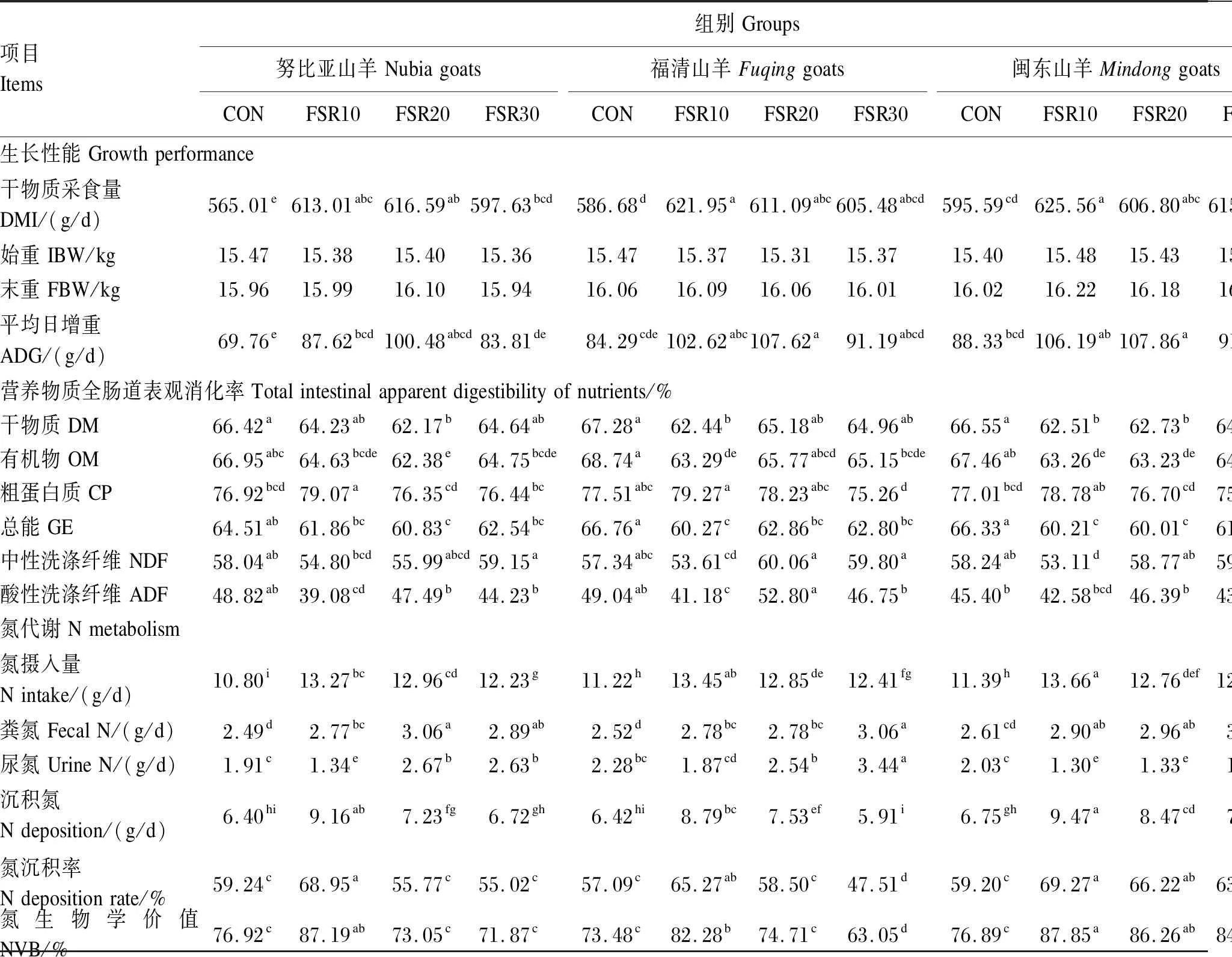
表3 山羊品种和发酵豆渣添加水平对试验羊生长性能、营养物质全肠道表观消化率及氮代谢的影响Table 3 Goat breeds and fermented soybean curd residue supplemental level on growth performance, total intestinal apparent digestibility of nutrients and nitrogen metabolism of experimental goats
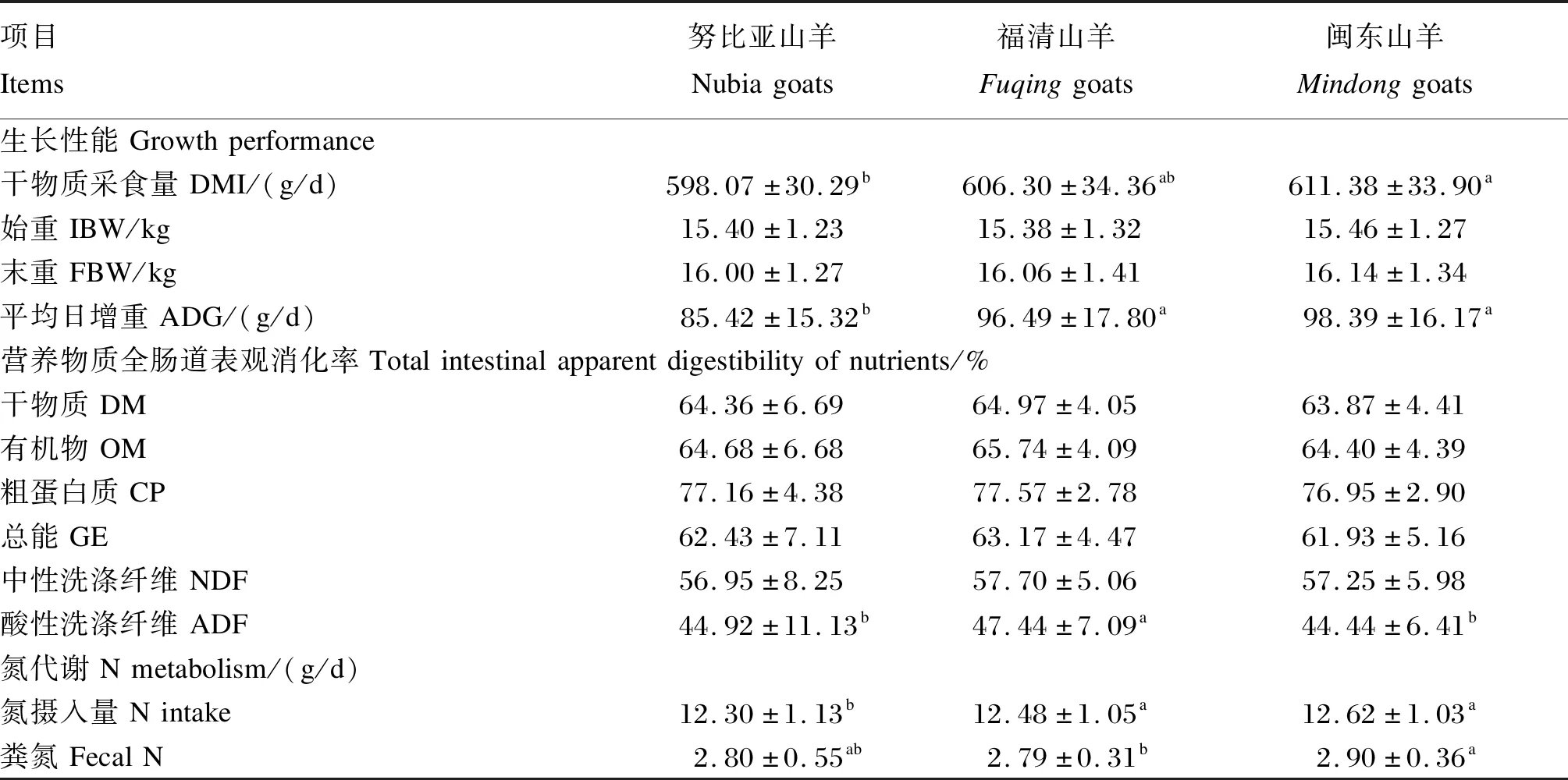
表4 山羊品种对试验羊生长性能、营养物质全肠道表观消化率及氮代谢的影响Table 4 Effects of goat breeds on growth performance, total intestinal apparent digestibility of nutrients and nitrogen metabolism of experimental goats
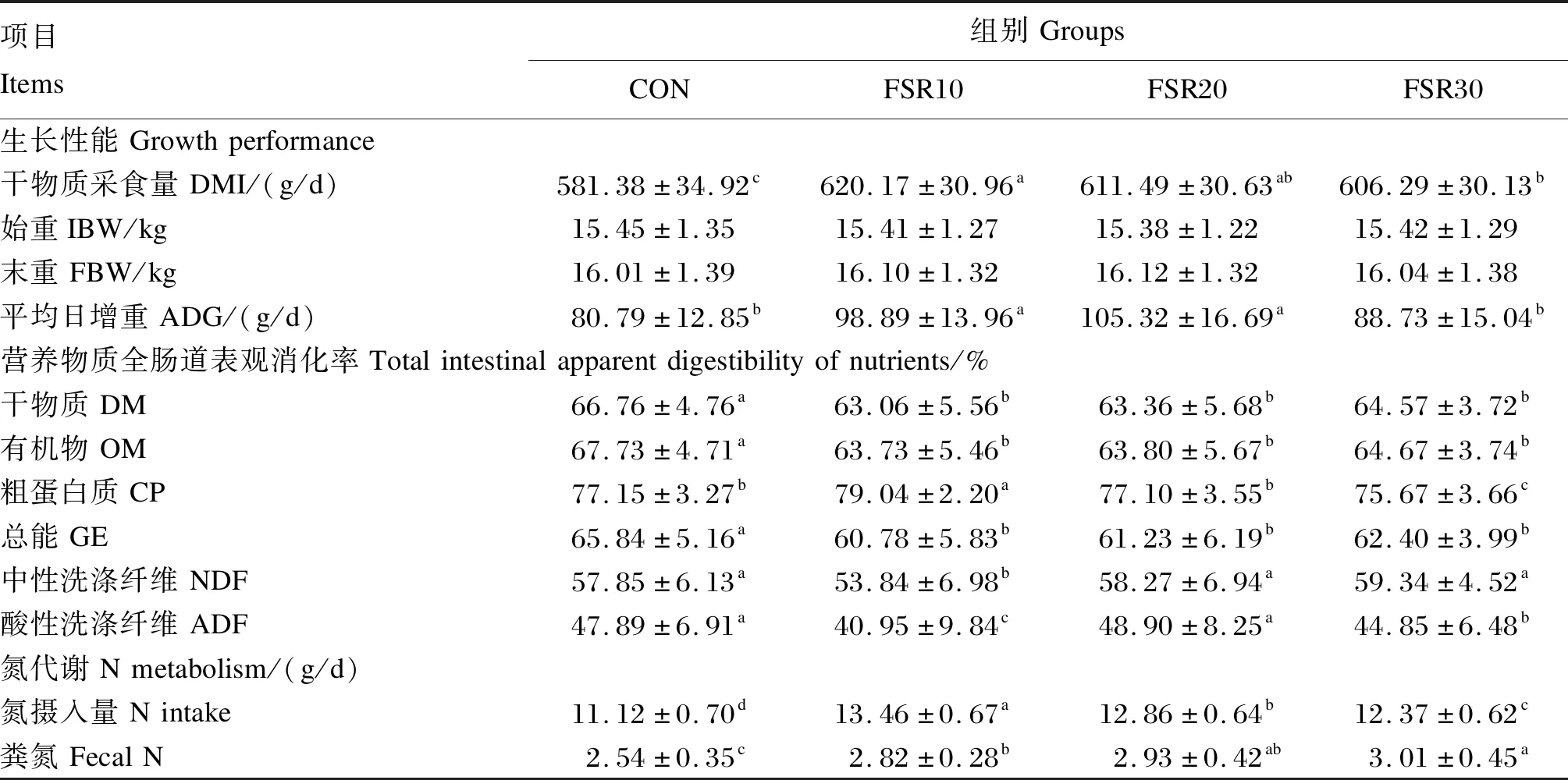
表5 发酵豆渣添加水平对试验羊的生长性能、营养物质全肠道表观消化率及氮代谢的影响Table 5 Effects of fermented soybean curd residue supplemental level on growth performance, total intestinal apparent digestibility of nutrients and nitrogen metabolism of experimental goats
由表3可知,对于闽东山羊,CON组的尿氮显著高于FSR10组、FSR20组和FSR30组(P<0.05);不同发酵豆渣添加水平组之间的沉积氮均差异显著(P<0.05),为FSR10组>FSR20组>FSR30组>CON组;CON组的氮沉积率和氮生物学价值均显著低于其他各组(P<0.05),FSR10组和FSR20组的氮沉积率和氮生物学价值差异不显著(P>0.05)。这表明闽东山羊对发酵豆渣的氮利用效率高于努比亚山羊和闽东山羊。
3 讨 论
3.1 山羊品种和发酵豆渣添加水平对试验羊生长性能的影响
DMI是影响畜禽健康情况和生产水平的重要指标,反刍动物DMI一般为其体重的2%~5%。为了实现肉羊预期的生产目的,饲粮配制主要参考相应的饲养标准,常用的肉羊饲养标准主要有美国的NRC(2007)、英国AFRC(1993)、法国INRA(1989)、澳大利亚CSIRO(2007)和中国肉羊农业行业饲养标准[25]。万凡[26]研究表明,利用不同饲养标准设计饲粮饲喂杜寒杂交肉用绵羊的实际DMI存在显著差异,且均未达到预期育肥目标。吴璇[27]参考NRC(2007)配制基础饲粮研究川中黑山羊的能量和蛋白质需要量,结果表明自由采食组的DMI和ADG并未达到预期,与本研究结果一致。本研究结果进一步表明山羊品种显著影响DMI和ADG,说明不同地方品种需要根据自身生长规律来制定适宜的营养需要标准。
饲粮的适口性和营养成分是影响山羊采食水平的重要因素。大量研究表明,发酵后的豆渣具有发酵的芬芳,增加蛋白质和小肽含量的同时降低抗营养物质含量,改善了营养价值,从而促进饲喂动物的采食[8-9,28-29]。反刍动物中利用发酵豆渣的报道较少,而饲粮中添加新鲜豆渣对DMI和生长性能的影响结果不尽相同。Tres等[30]研究表明,饲粮中添加32%的豆渣降低了奶牛的采食量,但不影响产奶量和奶成分。Odeyinka等[31]研究表明,饲粮中添加豆渣能增加山羊的DMI,但并未增加ADG。Rahman等[32]研究表明,豆渣对山羊DMI和ADG均有促进作用,与本研究结果一致。除了试验动物本身的差异外,可能不同地区豆渣营养成分差异以及饲粮中豆渣添加水平是导致不同研究结果差异的关键[3]。另外,本研究表明饲粮中发酵豆渣的适宜添加水平为10%~20%,随着发酵豆渣添加水平的进一步增加会降低试验羊的DMI和ADG,这与发酵豆渣在水产中应用的结果[9]相似,可能是由于发酵豆渣中仍然存在较高的粗纤维和一定量的抗营养因子,而高水平粗纤维降低了饲粮的适口性,抗营养因子的累积影响了试验羊对饲粮营养物质的消化利用。
3.2 山羊品种和发酵豆渣添加水平对试验羊营养物质全肠道表观消化率的影响
饲粮中各营养物质的表观消化率反映了试验动物对营养物质的利用及机体的生理状态,是评价饲料饲用价值的重要指标[22]。大量研究表明,饲粮中高含量的NDF和ADF会降低反刍动物对饲粮中DM、OM和NDF的表观消化率[33-35]。本研究中,发酵豆渣的NDF和ADF含量高于基础饲粮,添加发酵豆渣后增加了试验饲粮的NDF和ADF含量,同时豆渣中容易消化降解的无氮浸出物和EE含量较低,因此CON组DM、OM和GE的全肠道表观消化率均显著高于各试验组。尹琳琳等[8]研究表明,发酵豆渣中的纤维素酶和蛋白酶活性较高。这可能是造成FSR20组和FSR30组NDF和ADF的全肠道表观消化率高以及FSR10组CP的全肠道表观消化率高的关键因素。本研究提示,发酵豆渣存在为反刍动物供应能量不足的问题,应在发酵豆渣饲粮中补充一定比例的能量饲料。
在饲粮营养水平相同时,相同体重不同山羊品种的体成熟程度存在差异,相应的瘤胃体积/体重比也不尽相同,因此品种是影响肉羊消化能力的因素之一[36]。本项目前期研究表明,努比亚山羊和福清山羊对笋壳和莲蓬壳等粗饲料中营养物质的表观消化率存在差异[14-15]。本研究中,福清山羊是成年体重最小的山羊品种,在相同体重下,其瘤胃发育成熟度要优于闽东山羊和努比亚山羊,这可能是其对ADF的全肠道表观消化率显著高于闽东山羊和努比亚山羊的关键原因。
3.3 山羊品种和发酵豆渣添加水平对试验羊氮代谢的影响
饲粮中的蛋白质在动物体内消化、吸收等代谢过程会伴随部分损失,粪氮和尿氮是损失的主要部分,试验动物对粗饲料的氮沉积率和氮生物学价值越高,说明粗饲料的品质越优[22]。高红[12]研究表明,豆渣属于过瘤胃蛋白质和可代谢蛋白质含量较高的粮食加工副产物,具有替代奶牛饲粮中部分蛋白质饲料的潜力。本研究表明,山羊品种和发酵豆渣添加水平的交互作用对尿氮、沉积氮等多个氮代谢指标影响显著,表明利用发酵豆渣作为不同品种山羊育肥饲料原料时,应充分考虑品种因素,从而确定饲粮中适宜的发酵豆渣添加水平。本研究中,饲粮中添加10%和20%发酵豆渣显著提高了饲粮中CP的全肠道表观消化率,饲粮中添加10%发酵豆渣组的氮沉积率和氮生物学价值显著高于其他各组,证实发酵豆渣是山羊饲粮中品质较好的蛋白质饲料原料,在饲粮中的适宜添加水平为10%~20%。刘远等[14]研究表明,努比亚山羊和福清山羊对饲粮的氮沉积率和氮生物学价值存在显著差异,与本研究结果一致,这可能是由于不同品种虽然体重较一致,但所处的生长发育阶段存在差异,导致消化道内微生物区系以及蛋白酶活性有所差异,需进一步研究不同山羊品种在不同生长发育阶段对发酵豆渣利用能力的差异,为其高效利用提供更系统的参考。
4 结 论
① 山羊品种和饲粮发酵豆渣添加水平均能影响饲粮和豆渣的消化、吸收和利用。
② 在体重一致的条件下,地方山羊品种闽东山羊对发酵豆渣的氮消化利用能力优于大体型品种努比亚山羊。
③ 发酵豆渣能较好的满足育肥山羊的蛋白质需要,但存在能量供应不足的问题,育肥山羊饲粮发酵豆渣的添加水平以10%~20%为宜。

