cGAS-STING信号通路在自身免疫性疾病中的作用
邓珊珊,章越凡(上海大学医学院,上海 200444)
自身免疫性疾病(autoimmune disease,AID)是一类由于机体自身免疫耐受被打破导致机体针对自身抗原发生免疫反应,造成组织器官损伤或功能障碍的疾病,通常表现为自身反应性T 细胞、B 细胞过度活化、自身抗体大量产生等症状[1]。常见的AID 有系统性红斑狼疮(systemic lupus erythematosus,SLE)、类风湿关节炎(rheumatoid arthritis,RA)、银屑病(psoriasis)等。Ⅰ型干扰素(typeⅠinterferons,IFN-Ⅰ)和自身核酸都被认为是AID 发病机制的关键性驱动因素[2]。由环磷酸鸟苷-磷酸腺苷酸(cyclic GMP-AMP,cGAMP)合成酶(cyclic GMP-AMP synthase,cGAS)介导的cGAS-STING 信号通路是一类典型的天然免疫通路,能够识别机体自身DNA,并诱导IFN-Ⅰ的产生[3]。因此cGAS-STING 信号通路在AID 中的作用引起了人们极大的兴趣。
目前,临床上对于AID 的治疗方法还较为局限,主要集中于病理组织损伤治疗及免疫系统抑制疗法。这类治疗手段虽然能起到一定的治疗作用,但长期来看对患者的不良影响更大。近年来随着免疫疗法的兴起,有研究人员也开始尝试对AID 不同免疫信号通路涉及的作用靶点有针对性地开发治疗药物。鉴于cGAS-STING 信号通路与AID 之间的紧密联系,靶向调节cGAS-STING 信号通路的抑制剂有望成为治疗AID 的候选药物。现对cGAS-STING 信号通路及其在AID 中的功能和应用进行综述,旨在为AID 的研究和治疗提供思路。
1 cGAS-STING 信号通路
cGAS-STING 信号通路的信号传递过程可简要分为3 个阶段:双链DNA(double-stranded DNA,dsDNA)的感知、胞内信号转导和免疫应答激活(见图1)。
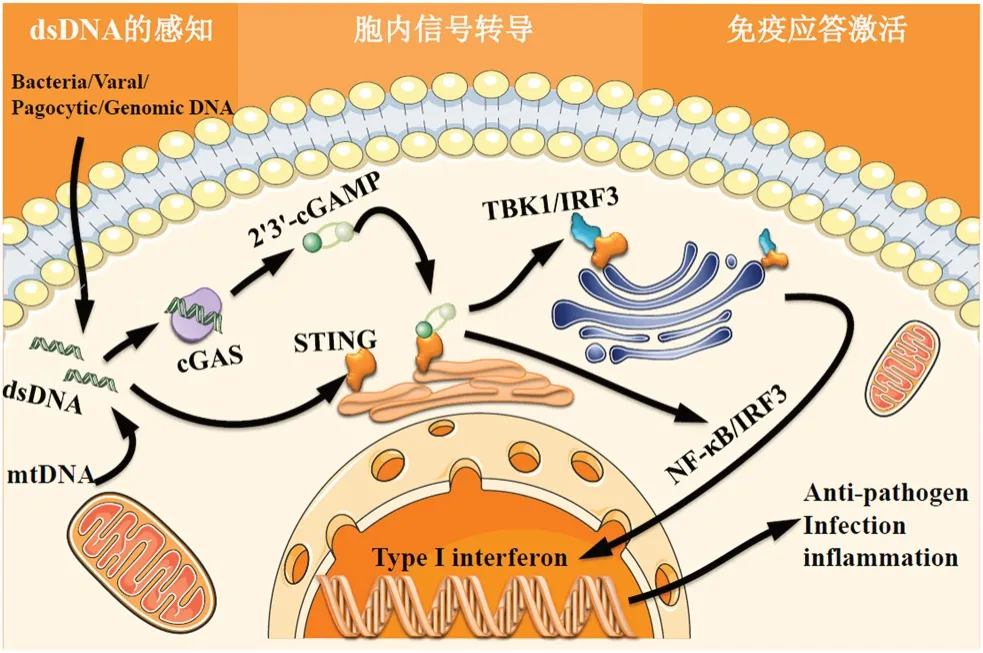
图1 cGAS-STING 信号通路Fig 1 cGAS-STING signaling pathway
1.1 dsDNA 的感知阶段
dsDNA 的感知阶段主要由细胞DNA 传感器cGAS 参与完成。目前除cGAS 外,尚未有研究表明已报道的DNA 受体是否为不依赖DNA 序列的通用型受体[4],而cGAS 作为一种广谱胞质DNA 识别受体可借助一种不依赖于DNA 序列的方式识别并结合dsDNA,催化ATP 和GTP 生成2’3’-cGAMP[5]。值得注意的是,这一阶段只有当较长片段的dsDNA 引发的信号超过一定的信号阈值时,cGAS 信号才能启动[6]。即在cGAS有限或dsDNA 片段序列较短的情况下,cGAS 难以被激活,这种激活方式为细胞提供了一种重要的潜在保护机制。
1.2 胞内信号转导阶段
cGAMP 可作为第二信使结合并激活定位于内质网上的干扰素基因刺激因子(stimulator of interferon gene,STING),导致STING 构象发生变化[7]。有研究发现STING 可直接结合dsDNA,也可被其上游含有两个3’-5’磷酸二酯键的原核CDNs(cyclic dinucleotides,CDNs)及2’3’-cGAMP 诱导活化[8]。cGAMP 与STING 的结合促进了STING向高尔基体转运,在转运过程中,活化的STING可招募TANK 结合激酶1 (TANK-binding kinase 1,TBK1)形成 STING-TBK1 复合物,随后催化干扰素调节因子3(interferon regulatory factor 3,IRF3)磷酸化和二聚化,且TBK1 也能在一定程度上催化核因子NF-κB 的转位[7,9];活化的STING 亦可直接激活下游IκB 激酶(inhibitor of nuclear factor kappa-B kinase,IKK),导致NF-κB 被释放[9]。
1.3 免疫应答激活阶段
IRF3、NF-κB 被激活后进入细胞核,从而诱导IFN-Ⅰ、干扰素刺激基因(interferon-stimulated gene,ISG)以及其他几种炎症介质、促凋亡基因和趋化因子的基因表达[9]。完成信号转导的STING 随后发生磷酸化、泛素化等修饰,活性受到抑制,防止天然免疫反应的过度激活[10]。
2 cGAS-STING 信号通路与AID
一方面,原本位于细胞核或者线粒体的自体DNA 泄漏到胞质或是自身DNA 清除机制存在缺陷,都有可能导致cGAS-STING 信号通路异常激活从而触发AID。正常情况下,细胞内存在的胞质外切酶 (cytoplasmic exonuclease enzymes,DNase)可以清除胞质内冗余的DNA,从而将胞质内的DNA 水平维持在cGAS 的激活阈值之下,避免自身免疫反应的发生[11]。当DNase 存在缺陷时,细胞质内积累的异常DNA 不能被及时清除,胞质内DNA 水平达到激活阈值,导致cGASSTING 信号通路过度激活,机体自身免疫平衡被打破,IFN-Ⅰ持续产生,进而诱发慢性炎症和AID 的发生[12]。另一方面,一些与STING 激活直接相关的基因(如TMEM173基因)发生突变也有可能导致cGAS-STING 信号通路激活异常,从而导致AID 的发生[13]。
2.1 cGAS-STING 信号通路与SLE
SLE 是一种常见的累及多脏器的AID,通常表现为IFN-Ⅰ水平增加和凋亡细胞清除缺陷。SLE 的免疫异常几乎覆盖整个免疫系统,被认为是AID 的原型,但SLE 的确切病因目前还尚不明确。现有研究表明,SLE 与核酸酶活力存在缺陷相关[14-15]。DNaseⅡ-/-鼠由于体内过量积累IFN-Ⅰ,导致其在胚胎期死亡[16],而DNaseⅡ和STING双缺失的小鼠却可以存活,且未产生狼疮的现象[17]。上述研究结果提示DNase缺失导致的狼疮是依赖于STING 信号通路的。
cGAS-STING 信号通路参与SLE 的发生发展。前期的临床调查显示,SLE 患者血清中的dsDNA 水平明显高于健康对照组[18],部分SLE患者血清中cGAMP 水平、cGAS 及免疫刺激因子的浓度都有所升高[19],表明cGAS 可能参与了识别结合SLE 患者体内自身dsDNA 产生cGAMP从而诱导炎症反应的过程。但Kato 等[18]后续开展的研究显示,SLE 患者血清中并不存在STING激动剂2’3’-cGAMP,且dsDNA 储存在凋亡衍生膜泡(apoptosis-derived membrane vesicle,AdMV)中,该膜泡结构能有效防止胞外核酸酶的降解并持续激活cGAS-STING 信号通路,促进IFN 和白细胞介素6(IL-6)等炎性因子的释放。以上结果提示,dsDNA 激活STING 通路并不一定只是通过cGAS 介导,不排除有dsDNA 直接激活STING 的可能性,且cGAS-STING 信号通路的持续激活很可能与细胞凋亡有关。另有研究显示,钙相关信号蛋白也参与了调控SLE 患者体内STING 通路,从而调节其免疫应答水平[20]。但关于cGAS-STING 信号在SLE 中发挥的作用还存在争议。在一项降植烷(pristane,TMPD)诱导的SLE 小鼠模型实验中,cGAS 和STING 缺陷非但不能使小鼠免于患病,反而还导致小鼠自身抗体产生增加以及蛋白尿水平的升高[21]。总体而言,SLE 潜在的病理机制存在相当大的异质性,cGAS-STING 信号通路在SLE 发病不同阶段中的作用是不一样的,在很大程度上取决于正在研究的SLE 动物模型种类及疾病发展的阶段。
2.2 cGAS-STING 信号通路与STING 相关婴儿期起病的血管病
STING 相关婴儿期起病的血管病(STINGassociated vasculopathy with onset in infancy,SAVI)是由于与STING 激活相关的基因发生突变而表现出由IFN-Ⅰ信号增强引起的慢性炎症和血管病变[22]。国内外关于SAVI 病例的报道基本都与STING 编码基因(TMEM173基因)变异有关,临床表现以新生儿期炎症性肺部疾病、皮肤血管病变、活动耐力下降等为主[23-24]。相关的SAVI 小鼠模型研究也显示,cGAS-STING 信号通路的过度激活会导致小鼠出现与SAVI 患者症状相似的无菌性炎症、免疫系统功能紊乱和重症肺炎[25]。STING编码基因的突变导致STING 过度激活,诱导大量IFN-Ⅰ产生,IFN-Ⅰ与干扰素受体结合后,经过Janus 激酶(janus kinase,JAK)-信号传导与转录激活因子(signal transducer and activator of tran ions,STAT)(JAK-STAT)信号通路进一步级联活化,产生炎症风暴,从而对STING 高表达的组织造成严重持久的损伤[22,26]。有研究报道采用JAK 抑制剂可有效抑制患者体内STAT 二聚体活化以控制cGAMP 诱导的STING 转录,并在一定程度上抑制炎症[27],提示JAK 抑制剂有望成为cGAS-STING信号通路过度激活的治疗药物,但JAK 抑制剂的安全性和有效性仍需要大量的临床试验验证。
2.3 cGAS-STING 信号通路与RA
RA 是以破坏性与对称性关节病变、关节滑膜炎为特征的慢性自身免疫性疾病[28]。有研究指出,RA 患者成纤维细胞样滑膜细胞中胞质 dsDNA 表达增加,且dsDNA 和cGAS 的表达与类风湿滑膜炎的严重程度相关,RA 患者细胞的cGAS或STING被敲除后细胞因子表达减少[29],这表明cGAS-STING 信号通路介导了RA 的炎症反应。在另一项研究中发现,cGAS 可通过激活蛋白激酶B(protein kinase B,Akt)和细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)信号通路,促进RA 成纤维细胞样滑膜细胞的炎症反应[30]。尽管AKT 信号通路的激活有可能会抑制STING 通路下游的激活[31],但目前关于RA 中cGAS 激活AKT 和ERK 信号通路是否与cGASSTING 信号通路激活调控有关尚未得到验证。综上,cGAS-STING 信号通路与RA 的发生发展有着密切的联系。
2.4 cGAS-STING 信号通路与银屑病
银屑病是一种慢性炎症性皮肤病,通常伴随着包括RA、自身免疫性甲状腺炎等多种AID在内的并发症,与先天性和适应性免疫反应有关[32]。有研究发现,在银屑病患者皮肤中DNA氧化损伤情况加重,银屑病样小鼠血浆中cfDNA(circulating free DNA,cfDNA)水平有所增加,且银屑病患者皮肤中存在STING 及其相关基因表达上调的现象[33-35]。初步机制研究表明,在银屑病患者皮肤的巨噬细胞和角质形成细胞中,STING 作为自身DNA 传感器诱导炎症反应,介导免疫细胞释放TNF-α或H2O2,产生的TNF-α、H2O2可促进DNA 释放到角质形成细胞胞质中,同时抑制dsDNA 诱导产生的STING 蛋白降解[34]。在一项STING 拮抗剂 H-151 的体内外抗银屑病作用研究中发现,局部给予H-151 能减轻咪喹莫特诱导的银屑病皮肤损伤,并减轻炎症的发生,其作用机制为通过抑制角质形成细胞和免疫细胞中的STING/NF-κB 信号转导,抑制皮肤的炎症,减轻银屑病的症状[35]。
2.5 cGAS-STING 信号通路与其他AID
有研究显示,Aicardi-Goutières 综合征(Aicardi-Goutières syndrome,AGS)的病理机制与cGAS-STING 信号通路密切相关[12]。AGS 是由于某些核酸酶基因突变缺失,导致核酸酶活性降低或丧失,核酸在胞浆内大量堆积,STINGTBK1-IRF3/NF-κB 等信号通路过度活化,最终导致IFN-Ⅰ水平显著升高[11]。现已确认血管和肺综合征(vascular and pulmonary syndrome,VAPS)患者与STING外显子突变有关[9],原发性胆汁性肝病也与cGAS-STING 信号通路激活有关[36]。
3 cGAS-STING 信号通路抑制剂在AID 中的研究
自2013年首次发现cGAS 是胞质识别DNA受体以来[37],后续相继发现了众多小分子化合物对因cGAS-STING 信号通路异常引发的AID 有疗效。Hansen 等[38]报道了STING 抑制剂硝基脂肪酸能抑制SAVI 患者成纤维细胞中IFN-Ⅰ的产生。有研究报道STING 抑制剂SN-011 已被证实可以抑制SAVI 疾病相关的STING 突变体激活活性,并且可调节TREX-/-小鼠免疫紊乱,提高小鼠存活率[39]。在HSV-1 感染的TREX-/-小鼠中,小分子环肽Astin C 可特异性抑制cGAS-STING信号通路及胞质DNA 所诱发的炎症反应,显著降低小鼠自身免疫炎症反应[40]。Haag 等[41]报道了三种靶向STING 蛋白的高效特异性小分子抑制剂C-176、C-178 和H-151,这些小分子可与人和小鼠细胞STING 蛋白中的Cys91 发生共价结合,阻断STING 活化所诱导的棕榈酰化,阻碍STING 多聚体复合物形成,抑制下游免疫应答激活,减弱小鼠自身炎症疾病的病理特征。该类化合物活性强且分子量低,药理实验结果显示能够有效阻断机体天然免疫反应的信号通路,是靶向cGAS-STING 信号通路治疗AID 极具潜力的候选药物。An 等[42]研究发现,在AGS 小鼠模型中,作为抑制cGAS 与DNA 相互作用的化合物X6 疗效优于羟氯喹,可显著降低小鼠脾脏细胞ISGs的表达,同时X6 在降低SLE 患者外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)ISGs表达方面也明显优于羟氯喹。该结果表明,X6 通过抑制cGAS-STING 信号通路激活治疗AGS 和SLE 具有明显优势。近期有研究发现,周期蛋白依赖性激酶抑制剂帕博西尼可直接靶向STING Y167,通过阻断STING 二聚化抑制其激活,后续研究结果表明帕博西尼对葡聚糖诱导的肠炎或TREX-/-小鼠的自身炎症性疾病具有保护作用[43]。
4 展望
综上所述,cGAS-STING 信号通路作为DNA传感器通路为AID 启动和发病的关键途径,因此针对cGAS-STING 信号通路开发调控该信号通路治疗AID 的药物显得尤为重要。就理论而言,与现有阻断IFN-Ⅰ下游信号通路(如JAK 抑制剂)的治疗药物相比,cGAS 及STING 抑制剂可能更具优势,因为其他识别细胞质内核苷酸的信号通路相对完整。但值得注意的是,cGAS-STING信号通路作为机体天然免疫系统的重要防御机制,除了参与常见AID 的发生发展过程,它还在因cGAS-STING 信号通路异常激活诱发的非酒精性脂肪性肝炎、慢性阻塞性肺疾病、脑缺血和帕金森病等疾病进程中发挥着重要作用,且在抗病毒、抗感染、抗肿瘤等方面也有广泛的作用,因此在使用阻断cGAS-STING 信号通路的免疫抑制药物时有可能会导致相关并发症恶化,机体免疫功能失调,增加病原微生物感染风险,长期使用甚至有可能导致肿瘤发病率提高。近些年对cGAS-STING 信号通路在AID 中的作用机制研究较为深入,但由于AID 发病机制的复杂性及实验模型的差异性等不可避免的因素,目前在该方向的药物临床转化效率还有待提升。因此,阐明cGAS-STING 信号通路在不同类型的AID 中发挥的不同作用机制非常必要,有助于我们进一步了解AID 的发生机制,为AID 的预防和治疗寻找更多潜在的方法。

