ABTS强化HRP/H2O2体系降解吲哚的效能与机制
黄亦欣, 邹景, 林金彬, 马红芳, 陈秀峰, 杨浩宇
(华侨大学 土木工程学院, 福建 厦门 361021)
吲哚是一种典型的氮杂环芳烃化合物,广泛地存在于焦化、印染、医药、农药等工业废水中[1-2].由于吲哚具有累积性及生物毒性,废水中的吲哚一旦进入环境中,就会在生物体内积累,对生物体的细胞造成不可逆的损害,进而产生致畸、致癌和致突变等不良作用[3-7].此外,由于吲哚的化学结构稳定,很难被微生物高效降解去除.臭氧、高铁酸盐等化学氧化法和纳米材料吸附法已被运用于吲哚的去除中[4,7-9],但存在药剂材料投入成本高、操作复杂、易产生二次污染等问题.
近年来,酶催化氧化法作为一种常见的高级氧化技术,已运用于废水中苯酚、雌激素等酚类及苯胺类有机污染物的降解,但对污染物降解的效率较低[10-19].由于能够产生具有更高氧化活性的中间体来高效地降解污染物,加入有机小分子作为电子转移体的酶介导体系逐渐成为研究热点.现有研究表明,1-羟基苯并三氮唑(HBT)、丁香醛(SA)等多种电子转移体可有效地强化漆酶/O2体系降解污染物,并拓宽该体系可降解的污染物种类[20-21].然而,漆酶价格昂贵,且漆酶/O2体系仅在pH值为酸性的条件下对污染物具有良好的去除效能.由于在pH值为中性的条件下对酚类及苯胺类有机污染物具有较高的降解效能,辣根过氧化物酶催化过氧化氢(HRP/H2O2)体系受到了水处理研究者的广泛关注[1,10,15,17].据报道,氯丙嗪和HBT可作为电子转移体强化HRP/H2O2体系降解污染物,但这些加入的电子转移体会随着污染物的降解而不断分解[22-23].因此,有必要探寻其他高效、稳定的电子转移体来强化HRP/H2O2体系降解污染物.
作为一种常用的还原剂,2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)可通过单电子转移反应生成具有较高氧化活性的ABTS自由基(ABTS·+).作为电子转移体,ABTS已运用于强化高铁酸盐[24]、高锰酸盐[25-26]及漆酶/O2体系[16,27-28]的有机污染物降解中.同时,课题组在前期的研究中发现,HRP/H2O2体系可迅速氧化ABTS生成ABTS·+[29].因此,ABTS作为电子转移体强化HRP/H2O2体系降解吲哚在理论上是可行的,但目前尚未有相关报道.基于此,本文以ABTS为电子转移体,强化HRP/H2O2体系降解吲哚.
1 材料与方法
1.1 试剂与仪器
辣根过氧化物酶(HRP,4 166.7 nkat·mg-1)、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS,质量分数为98%)、吲哚(AR级)及腐殖酸(上海市上海阿拉丁试剂有限公司);过氧化氢(H2O2,质量分数为30.0%)、磷酸氢二钠(Na2HPO4,AR级)、磷酸二氢钠(NaH2PO4,AR级)、硼酸钠(Na2B4O7,AR级)、硼酸(H3BO3,AR级)、氢氧化钠(NaOH,AR级)、高氯酸(HClO4,AR级)、碳酸氢钠(NaHCO3,AR级)、氯化钠(NaCl,AR级)、硫酸钠(Na2SO4,AR级)、硝酸钠(NaNO3,AR级)及硫代硫酸钠(Na2S2O3,AR级)(上海市上海国药集团);色谱级乙腈和甲醇(液相色谱分析中使用,德国默克公司).

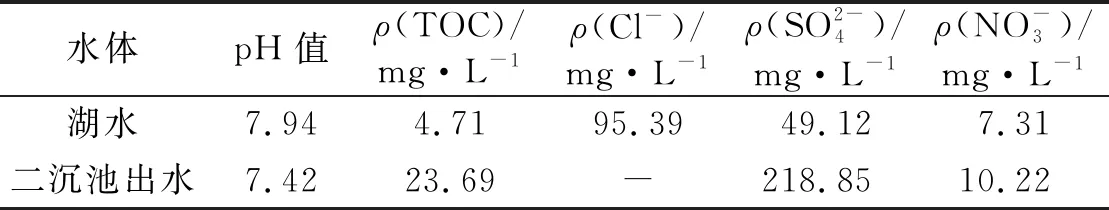
表1 实际水体的主要水质指标
1.2 实验步骤
吲哚降解实验在(25±2) ℃下恒温水浴,并用磁力搅拌器搅拌.首先,将11 mL的超纯水、5 mL的磷酸缓冲母液(50 mmol·L-1,pH值分别为5.0,7.0)或硼酸缓冲母液(50 mmol·L-1,pH值分别为9.0,11.0)、1.5 mL的ABTS母液(0.5 mmol·L-1)、0.5 mL的吲哚母液(0.3 mmol·L-1)及5 mL的H2O2母液(2.5 mmol·L-1)依次加入25 mL的玻璃锥形瓶中.然后,再加入2 mL的HRP母液(1 667 nkat·L-1),启动反应.模拟废水中的吲哚浓度为6 μmol·L-1.间隔一定的时间,从锥形瓶中取出500 μL反应液转移至含有过量Na2S2O3的液相色谱小瓶,并通过高效液相色谱仪测定吲哚浓度.
1.3 分析方法
吲哚浓度通过Agilent 1220型高效液相色谱仪(HPLC,德国Agilent公司)进行测定,HPLC色谱柱型号为Agilent TC-C18(2)(4.6 mm×150.0 mm(内径×长度),5.0 μm(粒径)),流动相由含体积分数为0.1%乙酸的水相和色谱级乙腈构成,二者体积比为20∶80,流速为1.0 mL·min-1,测定波长为270 nm,进样量为50 μL.
采用TU-1901型紫外-可见分光光度计(北京普析通用仪器有限责任公司)分别在340,732 nm处测定吸光度,再根据朗伯-比尔定律换算为ABTS和ABTS·+的浓度.
吲哚的中间降解产物通过Agilent 1290-6545型高效液相色谱-四级杆-飞行时间质谱仪(LC/Q-TOF/MS,德国Agilent公司)负离子模式进行分析.液相色谱柱为C18柱(3.0 mm×50.0 mm(内径×长度),1.8 μm(粒径)),流动相由色谱级甲醇(A相)和超纯水(B相)构成,流速为0.2 mL·min-1.采用梯度洗脱模式,A相比例在10 min内从10%提高到90%.吲哚降解过程中的生物毒性变化采用荧光发光菌法进行监测,详细步骤参考文献[30].
2 实验结果与讨论
2.1 ABTS强化HRP/H2O2体系降解吲哚的效能
ABTS加入前后HRP/H2O2体系对吲哚的降解效能,如图1所示.图1中:HRP的酶活力为133.3 nkat·mL-1;ABTS浓度为30 μmol·L-1;H2O2浓度为500 μmol·L-1;吲哚浓度为6 μmol·L-1;反应温度为(25±2) ℃;实验至少重复两次,点和误差棒分别表示重复实验结果的平均值和相对标准偏差;t为反应时间;δ为吲哚浓度剩余率,δ=ct/c0,c0为吲哚的初始浓度,ct为当前时刻的吲哚浓度.
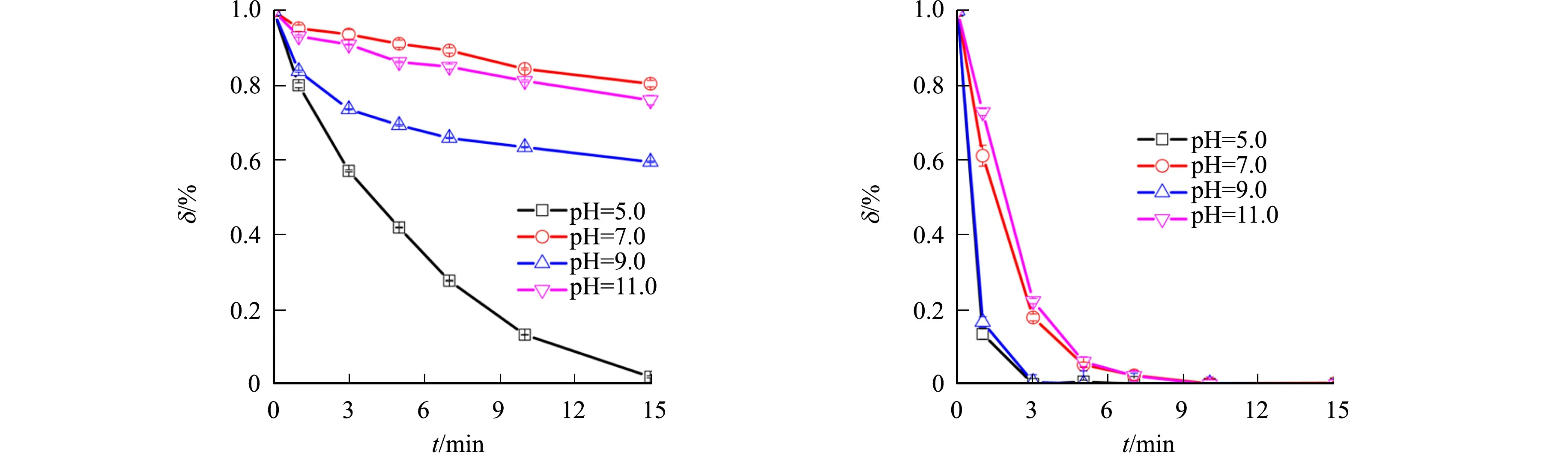
(a) ABTS加入前 (b) ABTS加入后
由图1可知:ABTS加入前,在pH值为5.0~11.0的范围内,HRP/H2O2体系降解吲哚的速度缓慢;当pH值为7.0时,HRP/H2O2体系在15 min内仅降解了约20%的吲哚;ABTS加入后,在pH值为5.0~11.0的范围内,可显著提升HRP/H2O2体系中吲哚的降解效能.
课题组之前的研究[29]表明,HRP可快速地催化H2O2氧化ABTS,生成ABTS·+.同时,文献[16]的研究表明,ABTS·+具有较强的氧化活性,可快速地氧化降解吲哚.因此,可推测HRP/H2O2体系中加入的ABTS被氧化生成ABTS·+,反应式为
HRP+H2O2+ABTS→ABTS·+,
(1)
进而促进吲哚的降解,反应式为
ABTS·++吲哚→ABTS+吲哚降解产物.
(2)
前期报道发现,ABTS·+的氧化活性随着反应溶液pH值的升高而提高[31],这与HRP/H2O2/ABTS体系在pH值为9.0时对吲哚的降解效能远高于pH值为7.0时的实验结果吻合(图1(b)).然而,该体系在pH值为11.0时对吲哚的降解效能远远低于pH值为9.0时,这可能是因为在pH值为11.0时,有相当比例的H2O2电离为具有较强还原能力的HO2-(H2O2的解离系数为11.62[32-33]),进而与吲哚竞争消耗大量ABTS·+,导致HRP/H2O2/ABTS体系对吲哚的降解效能降低.此外,文献[34]的研究表明,离子形态的吲哚比分子形态的吲哚更易被氧化降解,故HRP/H2O2/ABTS体系在pH值为5.0时对吲哚的降解效能反而高于pH值为7.0时,这主要归因于离子形态的吲哚在pH值为5.0时的比例更高,以及HRP/H2O2体系在pH值为5.0时对吲哚的降解具有更好的协同作用.
2.2 ABTS的强化作用机制
2.2.1 ABTS·+的生成及其对吲哚降解的作用 节2.1的分析认为,加入ABTS后,HRP/H2O2体系吲哚降解效能的显著提高归因于体系中ABTS·+的生成.文献[29,35-36]的研究表明,ABTS被氧化后生成的ABTS·+在可见光光谱区有显著吸收,且在415,650,732,820 nm等4个波长处有特征吸收峰.因此,为了验证ABTS·+的生成,对HRP/H2O2/ABTS体系反应溶液进行可见光光谱扫描.
各体系的可见光光谱图,如图2所示.图2中:HRP的酶活力为133.3 nkat·mL-1;ABTS浓度为0~30 μmol·L-1(分别取0,5,10,20,30 μmol·L-1,下同);H2O2浓度为500 μmol·L-1;吲哚浓度为6 μmol·L-1;初始pH值为7.0±0.1, 反应温度为(25±2) ℃;D为吸光度;λ为波长.由图2可知:HRP/H2O2体系反应溶液在可见光光谱区没有明显的吸收;ABTS的可见光谱也仅在340 nm波长处有特征吸收峰,在ABTS·+的4个特征波长均没有明显的吸收(与文献[37]的研究结果一致);加入ABTS后,出现了ABTS·+的4个特征吸收峰,表明确实有ABTS·+生成;随ABTS浓度的提高,检测到的4个ABTS·+特征吸收峰峰高也成比例提高,进一步证实了体系中ABTS·+的存在.
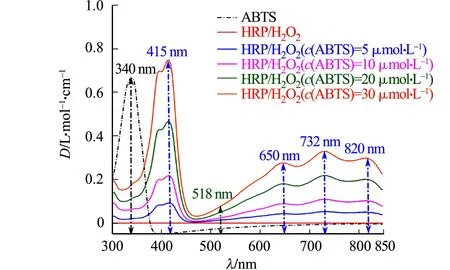
图2 各体系的可见光光谱图
需要注意的是,当存在过量H2O2时,ABTS·+可能会被进一步氧化生成在518 nm处有特征吸收峰的ABTS2+[38],但可见光光谱图在518 nm处没有特征吸收峰,进而排除HRP/H2O2/ABTS体系中ABTS2+的生成.
ABTS·+是由HRP催化H2O2氧化ABTS产生的,其生成量受ABTS浓度影响较为显著.为了探究ABTS·+在HRP/H2O2/ABTS体系中对吲哚降解的作用,进一步考察不同ABTS浓度下吲哚的降解效能及其与ABTS·+生成量之间的关系.ABTS浓度对HRP/H2O2/ABTS体系的影响,如图3所示.图3中:HRP的酶活力为133.3 nkat· mL-1;ABTS浓度为0~30 μmol·L-1;H2O2浓度为500 μmol·L-1;吲哚浓度为6 μmol·L-1;初始pH值为7.0±0.1;反应温度为(25±2) ℃;kobs为表观速率常数;c(ABTS),c(ABTS·+)分别为ABTS,ABTS·+的浓度.
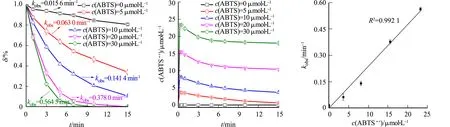
(a) 吲哚降解 (b) ABTS·+生成 (c) 反应速率
由图3(a),(b)可知:吲哚的降解效能随着ABTS浓度的增加而不断提高;加入30 μmol·L-1的ABTS后,HRP/H2O2/ABTS体系对吲哚降解的表观速率常数高达0.564 5 min-1,相比HRP/H2O2体系(0.015 6 min-1)提高了36.2倍;随着ABTS浓度的增加,ABTS·+的生成浓度也成比例提高.在不同ABTS浓度下,对HRP/H2O2/ABTS体系中吲哚降解的表观速率常数与ABTS·+生成浓度(t=15 s时)进行线性拟合,发现两者之间具有良好的线性相关性(R2>0.99).由此可知,HRP/H2O2/ABTS体系中生成的ABTS·+对吲哚降解起主要作用.
2.2.2 ABTS的电子转移体作用 据报道,氯丙嗪和HBT等有机小分子可作为电子转移体强化水中有机污染物的降解.然而,氯丙嗪和HBT在强化有机污染物降解的过程中,其本身也会随污染物的降解而不断消耗,并不是完美的电子转移体[22-23].同时,ABTS作为电子转移体在强化高铁酸盐、高锰酸盐降解污染物的过程中也存在分解[24,26].因此,进一步对HRP/H2O2/ABTS体系降解吲哚过程中成分的浓度变化进行监测,结果如图4所示.图4中:HRP酶活力为133.3 nkat·mL-1;ABTS浓度为30 μmol·L-1;H2O2浓度为500 μmol·L-1;吲哚浓度为6 μmol·L-1;初始pH值为7.0±0.1;反应温度为(25±2) ℃;c为浓度.由图4及相关分析可知:大部分ABTS先迅速通过单电子转移反应转变为ABTS·+;然后,随着反应的进行,生成的ABTS·+被吲哚及吲哚降解中间产物还原回ABTS,导致ABTS稳态浓度缓慢上升,而ABTS·+稳态浓度及两者的叠加浓度均缓慢下降;随着吲哚的降解,ABTS和ABTS·+的叠加浓度在15 min内由30 μmol·L-1下降至25 μmol·L-1左右,即ABTS的消耗比例约为17%;ABTS的少量消耗可能是由于生成的ABTS·+被氧化剂进一步氧化破坏所致[24,26].因此,在HRP/H2O2/ABTS体系降解吲哚的过程中,尽管ABTS起到了电子转移体的作用,但依然称不上“完美”的电子转移体.

图4 HRP/H2O2/ABTS体系降解吲哚过程中成分的浓度变化
2.2.3 ABTS强化吲哚降解的作用机制 由上述分析可知,ABTS·+是HRP/H2O2/ABTS体系降解吲哚的主要活性物质,并且强化剂ABTS在体系中可作为电子转移体循环作用于吲哚的降解.文献[10,39]的研究表明,HRP催化H2O2可生成具有氧化性的中间体化合物.因此,推测ABTS强化HRP/H2O2体系降解吲哚的反应机制为:首先,HRP被H2O2氧化,生成氧化性中间体;然后,氧化性中间体通过单电子转移的方式氧化ABTS,生成具有较强氧化活性的ABTS·+(式(1));随后,生成的ABTS·+快速氧化降解吲哚,且其自身被还原回ABTS(式(2)),即ABTS在HRP/H2O2/ABTS体系降解吲哚过程中主要起电子转移体的作用.
HRP/H2O2/ABTS体系降解吲哚的反应机制图,如图5所示.
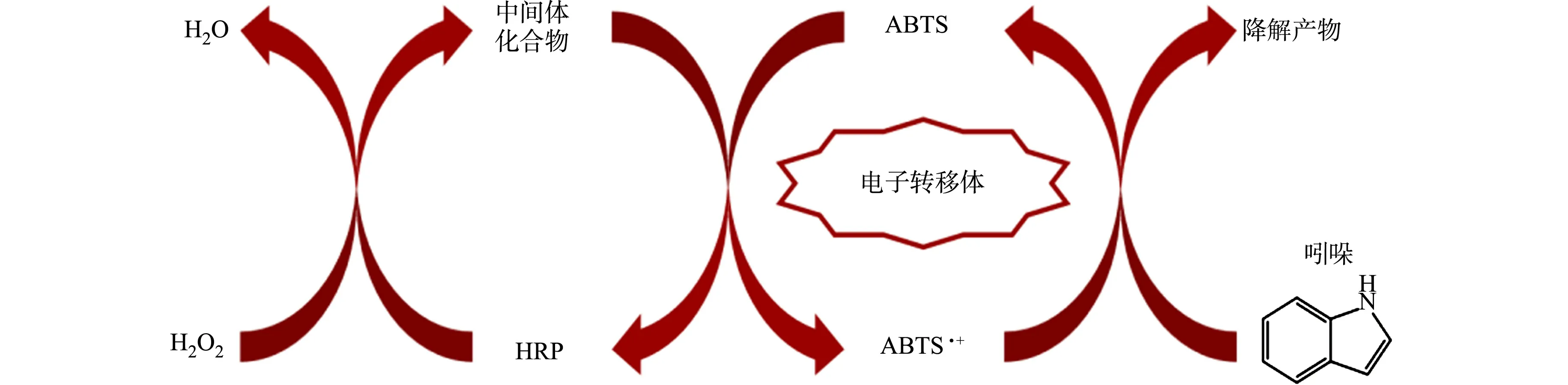
图5 HRP/H2O2/ABTS体系降解吲哚的反应机制图
2.3 水质背景的影响

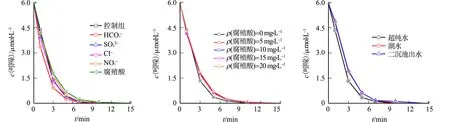
(a) 共存物质 (b) 腐殖酸质量浓度 (c) 实际水体
由图6(b)可知:当腐殖酸质量浓度从5 mg·L-1提高至20 mg·L-1,HRP/H2O2/ABTS体系对吲哚的降解效能没有显著影响,说明HRP/H2O2/ABTS体系对较高质量浓度的腐殖酸具有良好的抗干扰性能,可以运用于较高浓度腐殖酸水体中吲哚的降解.
由图6(c)可知:HRP/H2O2/ABTS体系可在10 min内将超纯水、湖水及二沉池出水中外加的6 μmol·L-1吲哚降解完全,呈现出高效的降解效能.这些现象表明,HRP/H2O2/ABTS体系应用于吲哚的降解时对实际水体具有良好的抗干扰性能;湖水和二沉池出水水质背景对吲哚降解有微弱抑制作用,主要是因为实际水体中存在的天然有机物会与吲哚竞争部分ABTS·+.
2.4 吲哚降解路径及生物毒性分析
2.4.1 吲哚降解的产物和路径 采用LC/Q-TOF/MS对HRP/H2O2/ABTS体系中吲哚的可能降解产物进行检测分析,结果如表2所示.表2中:tR为保留时间;RSD为相对标准偏差.除吲哚本身外,还检测出了5种吲哚降解产物.

表2 吲哚降解产物的信息
基于产物检测结果,推测出两种吲哚降解的路径,如图7所示.图7中:DP1*和DP5*表示未检测到.由图7可得以下两种吲哚降解的可能路径.

图7 HRP/H2O2/ABTS体系降解吲哚的途径

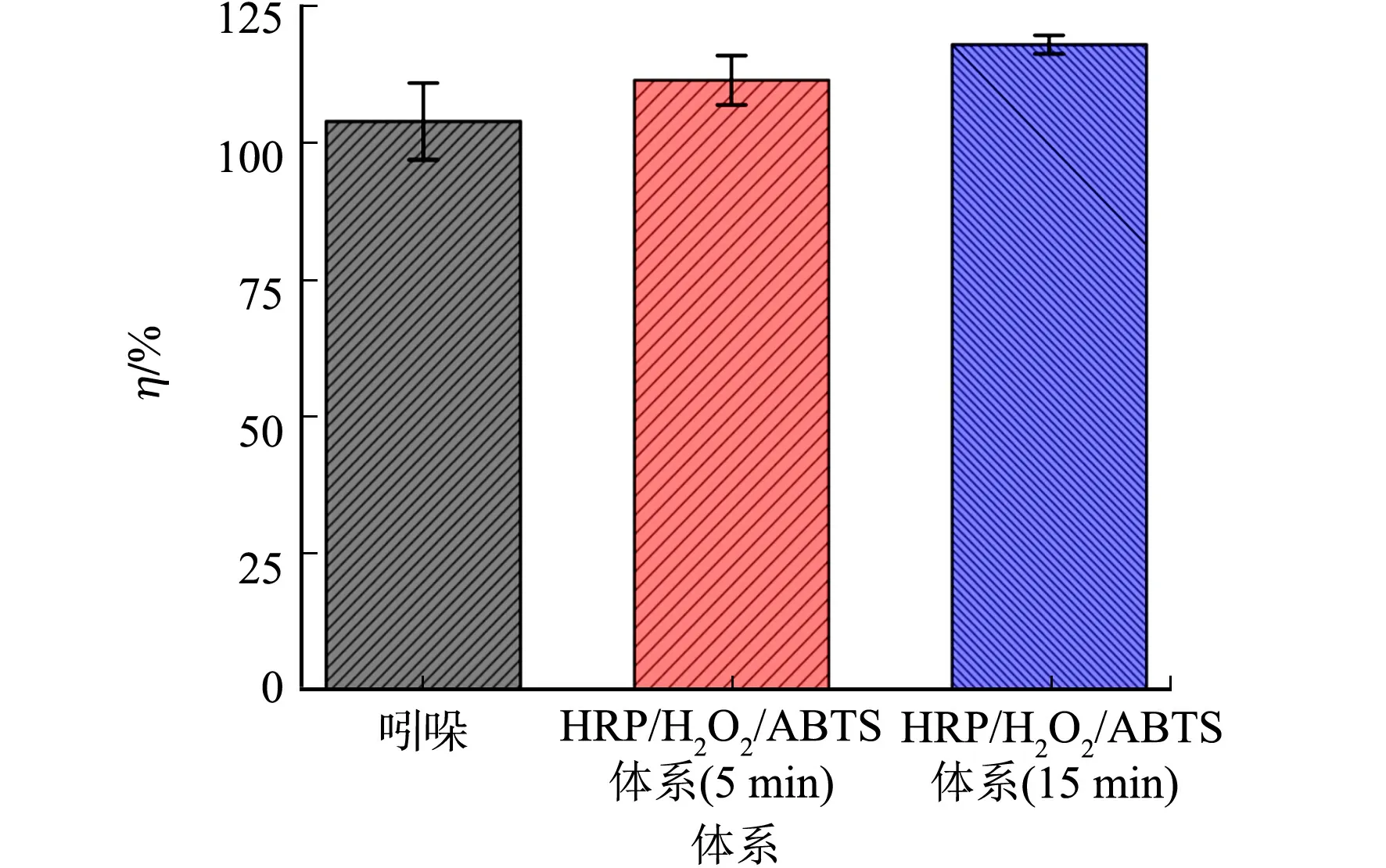
图8 HRP/H2O2/ABTS体系降解吲哚过程中的生物毒性变化
此外,由于吲哚对绿藻表现出显著的毒性[31],采用ECOSAR软件进一步模拟评估HRP/H2O2/ABTS体系降解吲哚过程中对绿藻急性毒性及慢性毒性的变化,确定吲哚及其降解产物的危险等级.
吲哚及其降解产物对绿藻的急性毒性和慢性毒性,如表3所示.表3中:EC50定义为96 h的半最大效应质量浓度,是指引起50%最大效应的质量浓度;ρChV为最大无可见不利影响质量浓度和最低可见不利影响质量浓度的几何平均值.根据HJ-T 154-2004 《新化学物质危害评估导则》,将危险等级分为极高(EC50/ρChV≤1 mg·L-1)、高(1 mg·L-1
由表3可知:吲哚对绿藻具有很强的急性毒性及慢性毒性,但其降解产物对绿藻的毒性均显著低于吲哚,且其中降解产物DP7的毒性达到低危险等级,这个结果进一步说明了HRP/H2O2/ABTS体系降解吲哚可以显著改善吲哚的毒性.

表3 吲哚及其降解产物对绿藻的急性毒性和慢性毒性
3 结论
ABTS的加入显著强化了HRP/H2O2体系在pH值为5.0~11.0范围内对6 μmol·L-1吲哚的降解效能,且其强化效能随着ABTS浓度的增加而提高.当pH值为7.0时,30 μmol·L-1ABTS的加入可将HRP/H2O2体系中6 μmol·L-1吲哚降解的表观速率常数提高36.2倍.HRP催化H2O2氧化ABTS生成的具有较高氧化活性的ABTS·+对吲哚降解起到主要作用,并且ABTS·+生成浓度与吲哚降解的表观速率常数具有良好的线性关系(R2>0.99).


