维生素A生物合成的研究进展
王欣慧,王颖,姚明东,肖文海
(1 天津大学化工学院,天津 300072; 2 天津大学合成生物学前沿科学中心和系统生物工程教育部重点实验室,天津 300072; 3 天津大学前沿技术研究院,天津 301700)
引 言
维生素A(vitamin A,VA)是首个被发现,并且在人体正常代谢网络中不可缺少,同时也是容易缺乏的脂溶性维生素。早在1000多年前,中国唐代医学家孙思邈在其著作《千金方》中就记载了动物肝脏可用于治疗夜盲,而巴西人发现鱼肝油可以治疗干眼病。当时人们对维生素并不了解,由于它是一种黄色黏稠的液体,因此其被命名成“脂溶性A”(A是德文干眼病“Augendarre”的首字母)。随着科学家们逐渐发现一些新的脂溶性物质,到1920 年,维生素A才被正式提出。
维生素A,其化学式为C20H30O。根据侧链连接官能团的不同(图1),可以分为类异戊二烯家族的视黄醇,视黄醛和视黄酸等疏水化合物[1]。这类化合物在体内既不是构成身体组织的基础材料,也不是能量的来源,而是一类具有调节作用的营养素,在代谢中起重要作用。维生素A在视觉、生殖、免疫系统和上皮细胞分化、骨骼正常生长发育等多种生理功能过程中至关重要[2]。当体内缺少维生素A 时会出现夜盲症、免疫力下降、生长受限等问题[3],维生素A缺乏症是一个值得全球关注的健康问题[4],据统计现有接近3亿学龄前儿童缺乏维生素A[5]。
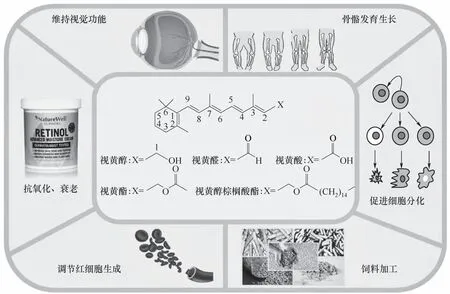
图1 维生素A结构及功能Fig.1 Structure and function of vitamin A
20 世纪末,全世界食品药品、营养保健品、化妆品、饲料等行业每年消耗的各种维生素原料的市值已达25 亿美元。维生素A 主要应用于保健品、医药品、动物饲养等,是国际市场上用途广泛、产销量巨大的维生素品种,与维生素C、维生素E 并列为维生素系列三大支柱产品[6]。维生素A 目前市场上供货紧缺,行业集中度较高,全球仅巴斯夫、帝斯曼、安迪苏、新和成、金达威、浙江医药6 家维生素A 生产企业(表1)。
维生素A 生产方式主要包括天然提取、化学合成和微生物合成。天然提取维生素A主要从鱼肝油中获得,主要成分为视黄醇,但存在资源相对分散、步骤复杂且成本较高等问题,因此商品维生素A 大多数都是化学合成产品。维生素A的化学合成主要有瑞士Roche 和德国BASF 两条合成工艺路线。两者主要以β-紫罗兰酮为起始原料,格氏反应为特征,选择加氢等一系列步骤生成维生素A 醋酸酯[7]。化学生产虽然可以大规模提供维生素A,缓解生产压力,但为了减少产物的分解,多在最后进行酯化反应,很难满足对维生素A组分的把控,同时由于国家对绿色发展的要求,化学合成也受到了限制。
随着全世界对环保以及可持续发展的重视,我国提出了“双碳”目标下的绿色转型升级之路的要求,人们开始将代谢工程应用到化学物质的生产,利用重组DNA、基因编辑等技术,对生物体的代谢网络进行定向修饰和改造,目前已实现氨基酸[8]、有机酸[9]和维生素[10-11]等产品的生物合成。近些年,维生素A 的生物合成已经有了很大进展。基于此,本文主要综述近年来维生素A 生物合成的相关情况,包括基本路径优化策略和发酵储存条件优化策略,并分析维生素A 的市场需求和生物合成前景,最后对生物合成维生素A 的现状进行总结与展望。
1 维生素A生物合成途径研究进展
1.1 维生素A的天然合成研究
天然维生素A 主要存在于动物和鱼类肝脏等,视黄醇大多存在于咸水鱼和动物肝脏中,视黄醛常常存在于淡水鱼肝脏中。维生素A的直接前体是天然类胡萝卜素[12],也称其为维生素A 原[13]。β-胡萝卜素作为主要的维生素A 原,其转化为维生素A 主要有两种途径:偏心裂解和中心裂解[14-15]。偏心裂解是β-胡萝卜素先转变为β-脱辅基-胡萝卜醛,经氧化变为视黄酸。而中心裂解是β-胡萝卜素在β-胡萝卜素15,15'-氧化酶的作用下产生两分子视黄醛,视黄醛经氧化或者还原生成视黄酸或视黄醇。一般认为,β-胡萝卜素转化为维生素A 主要依靠中心裂解途径[16]。β-胡萝卜素15,15'-氧化酶是一种溶解于细胞溶质的酶,最早是从大鼠肝脏与肠道发现[17]。随后的研究表明在一些动物的肝脏、肺、肾脏和皮肤组织中也存在该基因[18-19],但在人类的肝脏中未发现[20]。很多生物体内含有β-胡萝卜素15,15'-氧化酶且含量可观,例如斑马鱼[21]、老鼠[22]、果蝇[23]和人类[24]。
维生素A 的合成过程主要有以下步骤(图2):第一步是通过β-胡萝卜素15,15'-氧化酶切割β-胡萝卜素,合成视黄醛;第二步是在视黄醛脱氢酶或视黄醛还原酶催化下氧化或还原视黄醛,分别生成视黄酸或视黄醇[25]。在一些生物体内还会发生第三步,即卵磷脂视黄醇酰基转移酶LRAT 在视黄醇结合蛋白CRBP 的转运下[26],将视黄醇的羟基末端脂肪酰基酯化合成视黄醇酯,从而达到视黄醇在体内稳定储存的目的[27]。
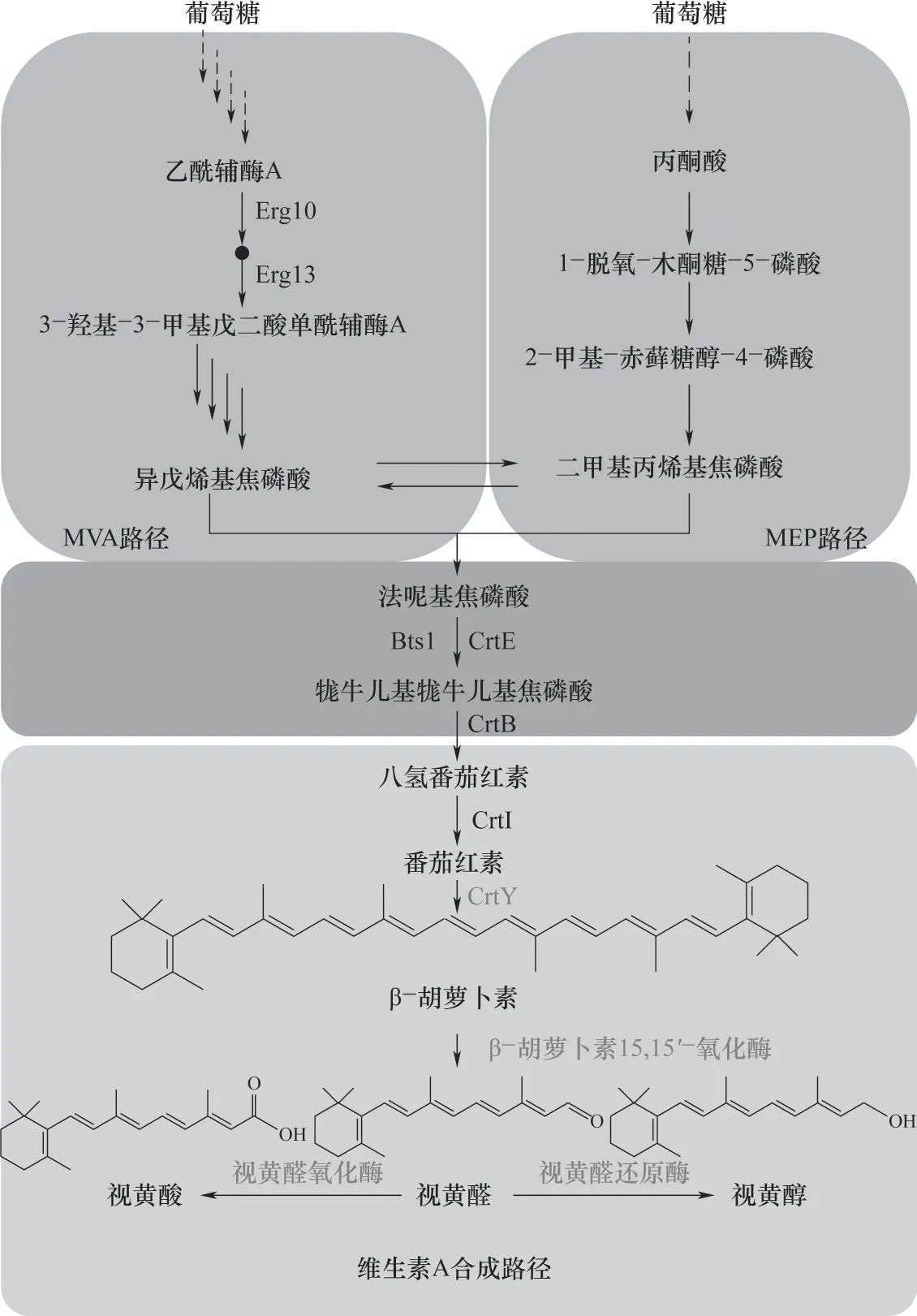
图2 维生素A生物合成路径Erg10—乙酰辅酶a C-乙酰转移酶;Erg13—羟甲基戊二酰辅酶a合酶;MVA—真核微生物和古细菌甲羟戊酸途径;MEP—原核微生物2-C-甲基-D-赤藓糖醇-4-磷酸途径;Bts1—法尼基转移酶;CrtE—GGPP合成酶;CrtB—八氢番茄红素合成酶;CrtI—八氢番茄红素脱氢酶;CrtY—番茄红素β-环化酶;实线箭头表示直接催化生成;虚线箭头表示部分路径信息省略;灰色标注表示维生素A合成基因Fig.2 Vitamin A biosynthetic pathway
β-胡萝卜素15,15'-氧化酶是主要的限速酶,关于该酶的性质和作用方式已有前人报道。Devery等[28]从仓鼠得到的β-胡萝卜素15,15'-氧化酶,能够将1 mol β-胡萝卜素裂解成1.5~2 mol 的视黄醛。Nagao 等[29]研究发现猪肠中1 mol β-胡萝卜素可以转化1.88 mol 视黄醛,与摩尔比2.0 的理论值接近。此外,Kim 等[30]将经过重组获得的鸡肝来源β-胡萝卜素15,15'-氧化酶通过His-Trap HP 和Resource Q层析纯化,转化得到了120%(mol∕mol)的产率。
β-胡萝卜素15,15'-氧化酶对于维生素A 的合成有着重要意义。Peck 等[31]通过分析盐杆菌NRC-1 基因组功能,发现与野生菌株对比,敲除brp和blh基因后,细胞内β-胡萝卜素水平升高,视紫红质积累量下降,对于此现象,认为盐生盐杆菌中视紫红质和视黄醛的合成需要brp和blh,它们通过编码类似的蛋白催化调节β-胡萝卜素转化为视黄醛。
1.2 维生素A的异源合成研究进展
随着合成生物学技术的不断成熟,细胞工厂逐渐应用于合成精细化学品和天然产物。以酵母和大肠杆菌为代表的模式生物具有遗传操作简单、代谢路径清晰、生长速率快等特点,在进行异源合成路径搭建时,此类底盘细胞会被优先考虑,并针对不同的天然产物开发特有的代谢改造途径。
在鉴定完维生素A 的生物合成关键基因后,目前已采取多种策略在异源底盘细胞实现维生素A的生产(表2)。Kim 等[32]成功地通过使用大肠杆菌系统优化反应条件表达活性酶进而实现工业酶法生产视黄醛,此外纯化的酶显示出最高比活性0.51 U∕mg。Jang 等[33]在大肠杆菌中构建维生素A 合成路径,并且对β-胡萝卜素15,15'-氧化酶来源进行筛选,基于海洋细菌66A03的细菌视紫红质蛋白类似物Blh合成视黄醇合成蛋白SR,结果表明SR显示出最高的β-胡萝卜素裂解活性,细胞内没有残留的β-胡萝卜素。在大肠杆菌原有2-C-甲基-D-赤藓糖醇-4-磷酸途径(methylerythritol-4-phosphate pathway,MEP)的前提下,为了提高代谢通量,引入外源甲羟戊酸途径(mevalonate pathway,MVA),产生了8.7 mg∕L 的视黄醛,产量提高4 倍。同时还发现视黄醇和乙酸维甲酸酯视黄醛衍生物的存在。为了防止细胞内维生素A 通过原位提取发生降解,发酵时采用了含有十二烷有机相的两相培养系统,经过72 h 摇瓶发酵,维生素A 产量达到136 mg∕L。Sun等[38]首次实现在酿酒酵母中维生素A的生产,通过将β-胡萝卜素生物合成途径和β-胡萝卜素15,15'-氧化酶(BCMO)编码基因blh引入酿酒酵母,最终获得的维生素A 产量为3350 mg∕L,其中包括2094 mg∕L 视黄醛和1256 mg∕L 视黄醇。Han 等[34]构建维甲酸生物合成途径,引入两个异源基因blhSR和RALDH2,实现模块化表达,删除内源编码醛还原酶的ybbO基因,采用mRNA 稳定区工程方法,利用mRNA 稳定序列对基因blhSR和raldhHS的50 个非翻译区进行了工程化,提高mRNA 表达水平,最后在生物反应器中优化维甲酸生产菌的培养条件(温度、pH、氧浓度),视黄酸产量达到(8.20±0.05)mg∕L。
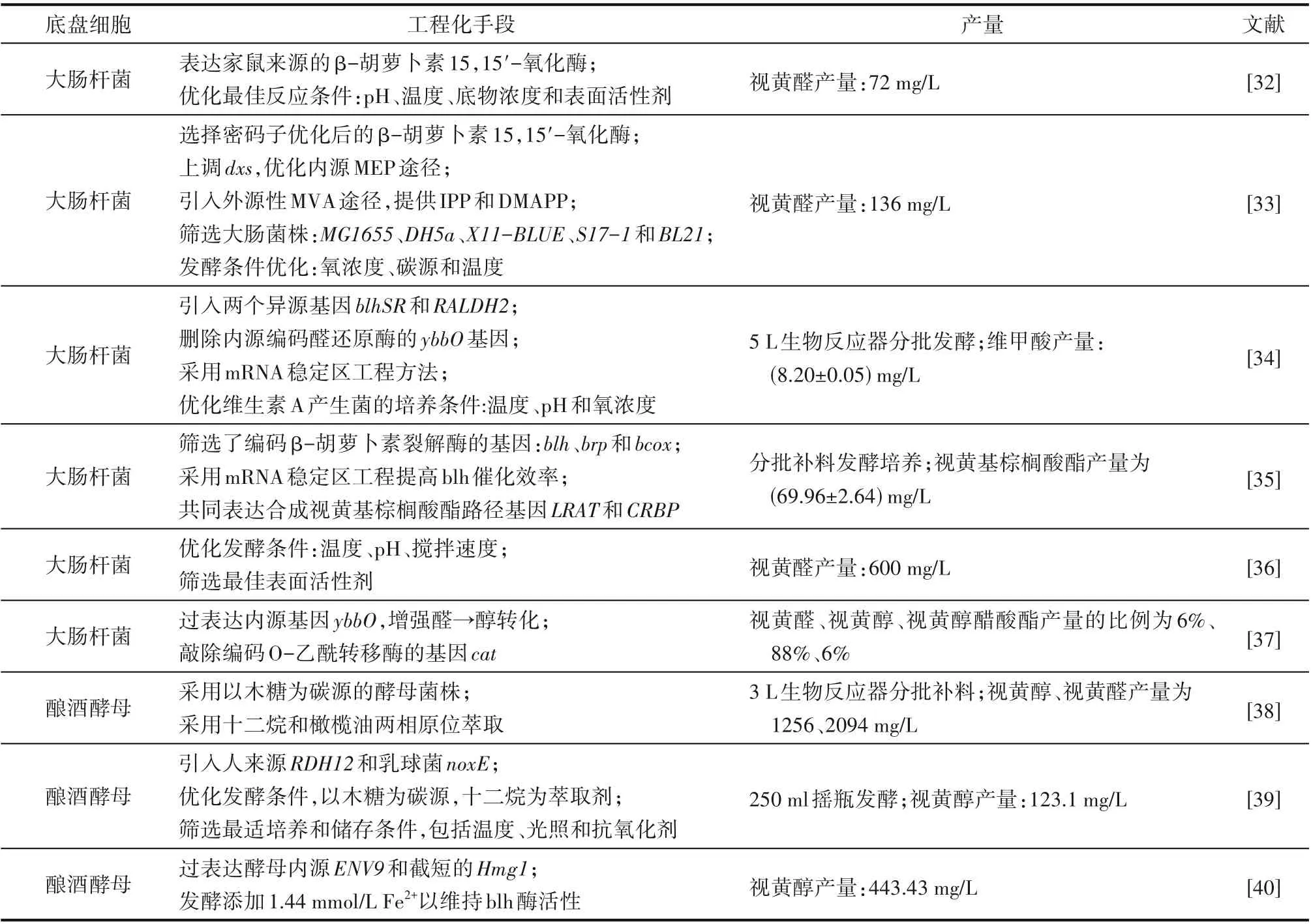
表2 维生素A相关的代谢工程改造进展Table 2 Progress in metabolic engineering transformation related to vitamin A
2 维生素A的生物合成优化
2.1 前体β-胡萝卜素合成路径的优化
目前已经从自然界中分离出来600多种天然类胡萝卜素,其中约有50 种具有维生素A 原活性[41]。β-胡萝卜素具有对称分子结构,由两个尾部相连的视黄醇分子构成,因此β-胡萝卜素是最具有维生素A原活性的前体物质。
β-胡萝卜素的产量对于维生素A 的生产起着直接作用。生产β-胡萝卜素不仅需要加强底物到目标产物的代谢,还需要减少不必要的副产品或中间代谢产物的积累。CrtE、CrtI、CrtZ 和CrtW 是经常被改造的限速酶[42]。Yamada等[43]通过使用来自酵母Xanthophyllomyces dendrorhous的CrtE,CrtYB和CrtI重复三轮δ 整合构建了工程菌株YPH499∕Mo3Crt79,在96 h 内产生52.3 mg∕L 的β-胡萝卜素,其值比CrtE,CrtYB和CrtI共表达的菌株更高。Larroude 等[44]通过筛选每个转录单位的最佳启动子-基因对,最终使耶氏解脂酵母中β-胡萝卜素的产量达到了6.5 g∕L(89.6 mg∕g DCW)。Wang 等[45]利用易错PCR构建转录因子Yl-SPT15的突变文库,调控胞内脂质积累,使β-胡萝卜素产量较原始菌株提高了4.7 倍。Zhao 等[46]考虑到酿酒酵母对于β-胡萝卜素和亲脂性化合物的生产能力有限,在底盘细胞内调节了脂质代谢路径[图3(a)],结果显示,磷脂酸磷酸酶(PAP)基因PAH1、DPP1、LPP1的缺失以及甾醇酯合成基因ARE1和ARE2的过度表达都可以增加β-胡萝卜素的积累,通过结合这两种策略,YZ30 菌株产生了8.98 mg∕g 干细胞重量的β-胡萝卜素,比起始菌株YZ03 高2.4 倍,这意味着脂质代谢网络的调节可以影响亲脂性β-胡萝卜素的生物合成。Ma 等[47]发现番茄红素环化酶的底物抑制可能是工程微生物生产化学品的主要障碍,为此采取了两种手段,通过完全失去底物抑制而不降低酶活性为结构导向对CarRB 酶进行突变,获得最佳突变体Y27R[图3(b)];通过建立转移代谢流量使其远离抑制性代谢物香叶基焦磷酸合酶介导的流量限制器[图3(c)],既高效形成产物,又可以免于底物抑制的困扰,得到了一株β-胡萝卜素生产率0.165 g∕(L·h)的菌株(比初始菌株提高1441 倍),产量为39.5 g∕L。
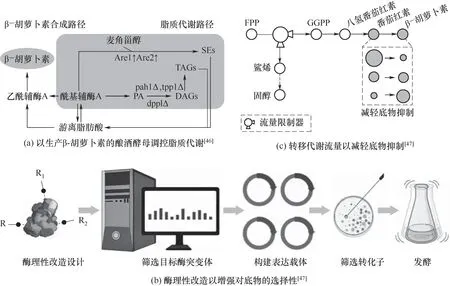
图3 维生素A前体β-胡萝卜素生物合成策略Are1,Are2—甾醇酰基转移酶;pah1,lpp1,dpp1—磷脂酸磷酸酶;PA—磷脂酸;DAG—二酰基甘油;TAG—三酰基甘油;SE—甾醇酯;FPP—法呢基焦磷酸;GGPP—牻牛儿基牻牛儿基焦磷酸;R—酶结构域Fig.3 Biosynthesis strategy of vitamin A precursor β-carotene
2.2 辅因子优化改造策略
维生素A 组分之间的转化多为氧化还原反应,氧化还原辅酶在路径代谢中发挥着重要的作用,细胞内的生物转化包含大量的反应并且需要特定的辅因子,而辅因子不足常常是限制因素,因此维持细胞内辅酶的平衡对于细胞的生长和产物的积累有着重要的意义。在辅因子家族中[48],氧化还原辅因子烟酰胺腺嘌呤二核苷酸[NAD(H)]和烟酰胺腺嘌呤二核苷酸磷酸[NADP(H)]能够维持氧化还原的平衡并以电子载体的形式提升酶的催化性能,参与多个化学反应,酵母中仅与NADPH 相关的反应就超过100 个,大肠杆菌中存在80 个NADPH 相关的酶[49],因此调控氧化还原辅因子代谢成为优化生物反应的重要手段[50]。
酿酒酵母中NADPH 的产生来源主要是磷酸戊糖途径(pentose phosphate pathway,PPP)的氧化部分以及异柠檬酸脱氢酶、乙醛脱氢酶和苹果酸酶的催化反应。但是操作PPP氧化部分实现NADPH上升,会消耗碳源导致产量下降。此外,中心代谢还可能会对细胞整体的代谢造成较大影响,而通过引入单独靶向辅因子的酶可以精准调控辅因子水平[51]。Lee等[39]在构建一株高效生产视黄醇的酵母菌株时,通过对发酵产物甘油产量的监测,发现细胞内存在氧化还原失衡的问题[图4(a)],引入乳球菌来源的NADH氧化酶的noxE,改造后的菌株甘油下降52%,视黄醇产量上升30%。Hu等[40]在选择生产维生素A亲本菌株时就考虑到了过表达截短的Hmg1(tHmg1),提升了异戊烯基焦磷酸盐(IPP)∕二甲基烯丙基焦磷酸盐(DMAPP)的比率,增大了MVA 路径的通量,该过程NADPH 作为辅助因子。除此之外,在亲本菌株中分别过表达NADP(H)氧化还原酶Zwf1 和YMR315W 及其转录因子Stb5,线粒体NADH 激酶Pos5,以及切除17 位氨基酸线粒体信号肽后的tPos5,结果显示,过表达tPos5效果最明显,视黄醇产量达到47.01 mg∕L,这意味着NADPH参与了内源性脱氢酶将视黄醛转化为视黄醇的过程。
E.coli作为研究最常用的模式生物之一,磷酸戊糖途径(PPP)[52]、三羧酸循环(TCA)和转氢酶系统是NADPH再生的三个主要来源,这三种途径已成为提高NADPH 利用率的常用方法[53-54]。Satowa 等[55]通过敲除编码磷酸葡萄糖异构酶的pgi基因,增加了细胞中的NADPH∕NADP+比率,促进了NADPH 再生。Xiong 等[56]将在生产ε-己内酯的大肠杆菌表达了乙醇脱氢酶(ADH)与环己酮氧化酶(CHMO),获得了一个自给自足的NADPH 辅因子再生系统[图4(b)],实现126 mmol∕Lε-己内酯的生产,摩尔产率高达0.78 mol∕mol。Du等[57]通过将来自枯草芽孢杆菌168的NADP+依赖性gapB和来自大肠杆菌MG1655的NAD 激酶yfjB,进一步加强细胞内NADPH 供应,该策略使细胞内NADPH 量增加了134.4%。维生素A产物的生物合成涉及多个氧化还原反应,NADPH作为参与此类反应的通用辅因子,其调控策略可以运用到维生素A 的生物合成中,提升维生素A 的生物合成效果。
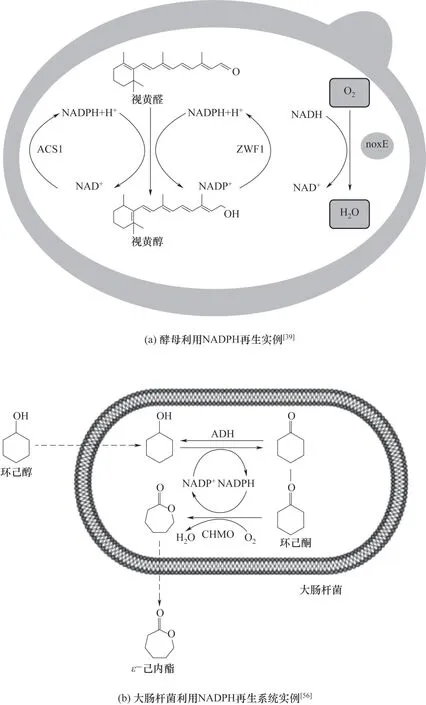
图4 维生素A辅因子改造优化策略ADH—乙醇脱氢酶;CHMO—环己酮氧化酶;ACS1—乙酰辅酶连接酶1;ZWF1—葡萄糖-6-磷酸脱氢酶;noxE—NADH氧化酶;NADH—烟酰胺腺嘌呤二核苷酸;NADPH—烟酰胺腺嘌呤二核苷酸磷酸Fig.4 Optimization strategy of vitamin A cofactor transformation
2.3 维生素A的组分调控
维生素A是由四个具有环状端基的类异戊二烯单元组成的化合物,端基的变化产生了不同类别的化合物[58]。由于不同组分的存在,维生素在机体发挥着多样的功能,视黄醇用于制造食品、药品、营养品和动物饲料添加剂等;视黄醛参与视觉循环[59];视黄酸可以保护成纤维细胞和其他皮肤细胞免受紫外线辐射(会引起皮肤损伤)[60];视黄酯是一种更稳定的视黄醇酯化形式,作为一种高效的抗衰老剂,是医药和化妆品中的活性成分[61],因此对于维生素A组分调控的研究意义重大[图5(a)]。
早在2015 年,Jang 等[37]在大肠杆菌中整合了β-胡萝卜素生物合成途径和BCMO 基因,构建了维生素A 的合成路径。由于大肠杆菌内源氧化还原酶ybbO 和编码氯霉素乙酰转移酶的氯霉素抗性基因cat的非特异性活性,同时也产生视黄醇和视黄醇醋酸酯。作者通过在重组大肠杆菌中增加ybbO基因的拷贝数和敲除cat基因,最终实现视黄醛、视黄醇、视黄醇醋酸酯的比例为6%、88%、6%,这表明未来选择性生产维甲酸的可行性。Choi等[35]筛选了三个编码β-胡萝卜素裂解酶的基因:blh、brp和bcox,采用mRNA 稳定区工程提高blh 催化效率,测试UTR12,UTR37 和UTR46 合成调控序列,以促进视黄醇的合成,共同表达合成视黄基棕榈酸酯路径基因LRAT和CRBP,最终视黄基棕榈酸酯产量为(69.96±2.64)mg∕L。Lee 等[39]在一株生产维生素A 的酿酒酵母中表达了人来源的RDH10和RDH12以及大肠杆菌来源的ybbO视黄醇脱氢酶,结果显示携带人来源RDH12的酿酒酵母视黄醛全部转化为视黄醇,产量为97.09 mg∕L。2022 年,Hu 等[40]在NCBI 基于与ybbO 的同源性选择了酵母内源的fSps19、YMR226C、Ifa38和Env9(同源性分别为:25.62%、41.34%、31.49%和29.49%)和来自M.tratuosa物种的AKR、AKR1B10 氧化还原酶以及大肠杆菌来源的ybbO基因进行测试,结果显示大肠杆菌来源的ybbO可以使95.79%的视黄醛转化为视黄醇。当Env9过表达时,视黄醇的产量明显提高,达到83.63 mg∕L,这表明酿酒酵母中Env9 具有视黄醛还原酶活性[图5(b)]。除此之外,当酵母内源Env9与大肠杆菌ybbO同时过表达时,视黄醇的产量高达115.28 mg∕L。
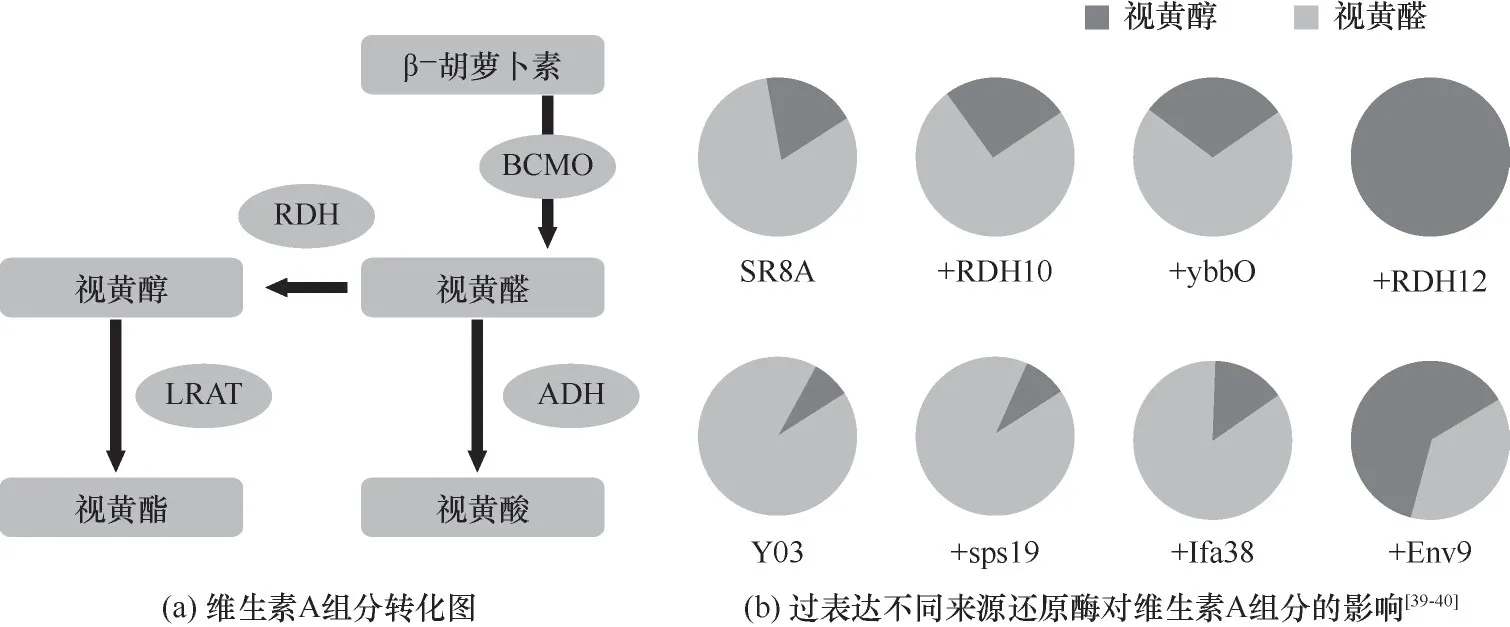
图5 维生素A组分调控优化策略RDH—视黄醇脱氢酶;ADH—乙醇脱氢酶;BCMO—β-胡萝卜素15,15'-氧化酶;LRAT—卵磷脂视黄醇酰基转移酶;SR8A—维生素A酵母生产出发菌株1;RDH10—人来源视黄醇脱氢酶10;ybbO—NADP+依赖型醛还原酶;RDH12—人来源视黄醇脱氢酶12;Y03—维生素A酵母生产出发菌株2;sps19—2,4-二烯酰辅酶a还原酶;Ifa38—极长链3-氧代酰基辅酶a还原酶;Env9—短链乙醇脱氢酶Fig.5 Optimization strategy of vitamin A component regulation
当底盘细胞引入β-胡萝卜素生物合成途径和β-胡萝卜素15,15'-氧化酶时,β-胡萝卜素15,15'-氧化酶可以将一分子的β-胡萝卜素切割成两个视黄醛分子,由于胞内氧化还原酶非特异性催化,视黄醛可以少量转化为视黄醇和视黄酯[38]。为了增强此过程的转化,可以通过挖掘和改造的方式获取更优异的候选酶,增加基因的拷贝数和采用不同强度的启动子等策略。
2.4 维生素A的生物发酵优化
发酵产量受多种因素影响,包括生产菌株、培养基组成(碳源、氮源和离子种类等)、发酵条件(pH、温度、搅拌速度和溶氧)以及发酵模式(分批、补料分批和连续发酵)[62]。为实现高效生产以满足商业需求,维生素A 生产菌株发酵条件的优化具有重要意义。
由于葡萄糖具有被吸收速度快的特性,它是所有微生物的主要碳源。除葡萄糖外,近些年来以其他糖或者碳水化合物作为碳源的微生物细胞工厂也取得了进展。其中木糖作为新兴碳源,是木质纤维素的组成成分,与葡萄糖作为碳源相比,酿酒酵母在利用木糖时,提高了细胞质内乙酰辅酶A 的通量。Sun 等[38]在酵母菌株SR8A 引入木糖代谢途径和维生素A生产路径,当以木糖为碳源时,其生长比使用葡萄糖时高57%,乙醇积累量微乎其微,产生60.90 mg∕L β-胡萝卜素和20.74 mg∕L 维生素A,是葡萄糖条件下生产水平的3 倍和5 倍。同时SR8A菌株木糖中麦角甾醇的含量高于葡萄糖(21.48vs17.32 mg麦角甾醇∕g DCW),再次证实了木糖条件下乙酰辅酶A 的供应以及MVA 途径的代谢通量高于葡萄糖条件(表3)。
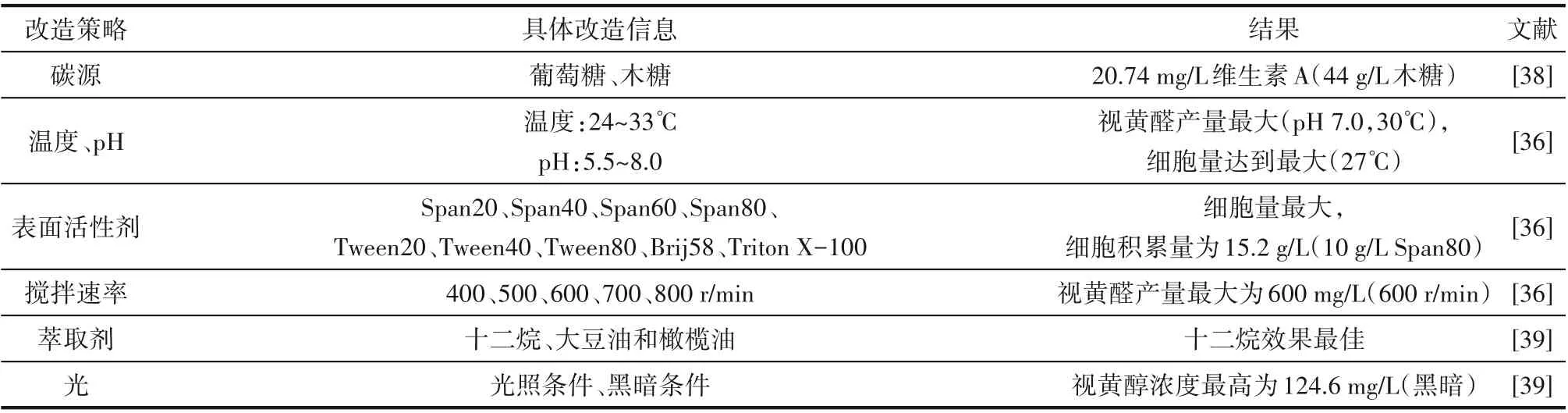
表3 维生素A生产下游改造策略Table 3 The downstream transformation strategy of vitamin A production
维生素A 属于亲脂性化合物,通过细胞膜的低渗透性和低溶解度阻碍产物分泌到胞外。油和表面活性剂常常被添加到亲脂性化合物发酵过程,调节菌株生长和生产产物过程[63]。Sun 等[38]发现维生素A 生产菌株加入十二烷时,促进β-胡萝卜素向维生素A 的转化,维生素A 产量比对照组高出2~4 倍。考虑到十二烷用于维生素A工业生产的可行性和安全问题,Sun等通过向发酵培养基中以1∶1的体积比添加橄榄油,发现工程菌的发酵曲线和产品产量情况与使用十二烷时相似,证明了橄榄油替代十二烷提取维生素A 的可行性,橄榄油可能比十二烷更适合用于营养、医药和化妆品产品。Lee等[36]发现表面活性剂Span80 浓度保持10 g∕L 时,对细胞生长最有效,细胞积累量为15.2 g∕L,比不含Span80 的培养基高2.7倍。
催化β-胡萝卜素转化为视黄醛的β-胡萝卜素15,15'-氧化酶,在酶催化时,Fe2+协调His-21、His-78、His-188 和His-192 活性位点[64]。Hu 等[40]考虑到亚铁离子在空气中容易被氧化为三价铁离子,在发酵36 h 后向培养物中添加1.44 mmol∕L Fe2+以保持blh 的催化活性。结果显示,β-胡萝卜素的积累减少,视黄醇产量进一步提高9.03%,达到443.43 mg∕L,占总维生素A的98.76%。
确定最佳生产工艺对于商业化生产至关重要,传统的发酵优化方法需要对每个因素进行单独处理,存在费力、不完整和耗时等弊端。现在新兴的实验析因设计可用于研究相互作用的因素,已成功应用于生物制造工艺的优化[65-66],未来可以与维生素A细胞工厂优化结合,有望提高其生产效率。
2.5 维生素A储存条件优化
视黄醇作为一种抗氧化剂,由于其结构中存在连续的共轭双键,当暴露在光、热和空气中,容易被氧化或异构化[67]。在一项关于维生素A抵抗UVA和UVB 射线的实验中,与固体脂质纳米粒、环糊精包合物和聚合物包封相比,抗氧化剂丁基羟基甲苯(butylated hydroxytoluene,BHT)表现出优异的保护功能[68],添加BHT是防止视黄醇降解的简单、经济和安全的方法[69]。
Hu 等[40]在多株工程改造的维生素A 酵母生产菌中添加抗氧化剂BHT,可以有效阻止视黄醇的氧化,显著提高维生素A 中视黄醇占比,并且维生素A总体产量也有所提升。在生产菌Y03-43 中加入BHT 后视黄醇产量达到401.65 mg∕L,这表明抗氧化剂对视黄醇易氧化产品生产及存储的必要性[图6(a)]。为了测试其他抗氧化剂是否对维生素A 生成具有促进作用,Hu 等[40]研究了其他疏水性抗氧化剂,如丁基羟基茴香醚(butyl hydroxyanisole,BHA)、绿茶多酚(green tea polyphenol,GTP)和没食子酸丙酯(propyl gallate,PG)对菌株生产维生素A 的影响,发现BHA 严重损害了细胞的生长,而GTP 和PG 也降低了两株试验菌株的单位OD,但GTP 和PG 的加入提高了维生素A 的产量,该研究意味着在实际生产中有必要选择对细胞生长影响较小的抗氧化剂。
Chmykh 等[70]发现用脂质体包封可提高视黄醇的稳定性[图6(b)],在这项研究中,比较了在紫外线或标准室内空气条件下,视黄醇在添加和不添加抗氧化剂的磷脂酰胆碱脂质体中的稳定性。BHT 和专有混合物(StoppOx)都将稳定性从小于10 d 提高到30 d 以上。在紫外线照射下,StoppOx 保护视黄醇的时间明显长于BHT。
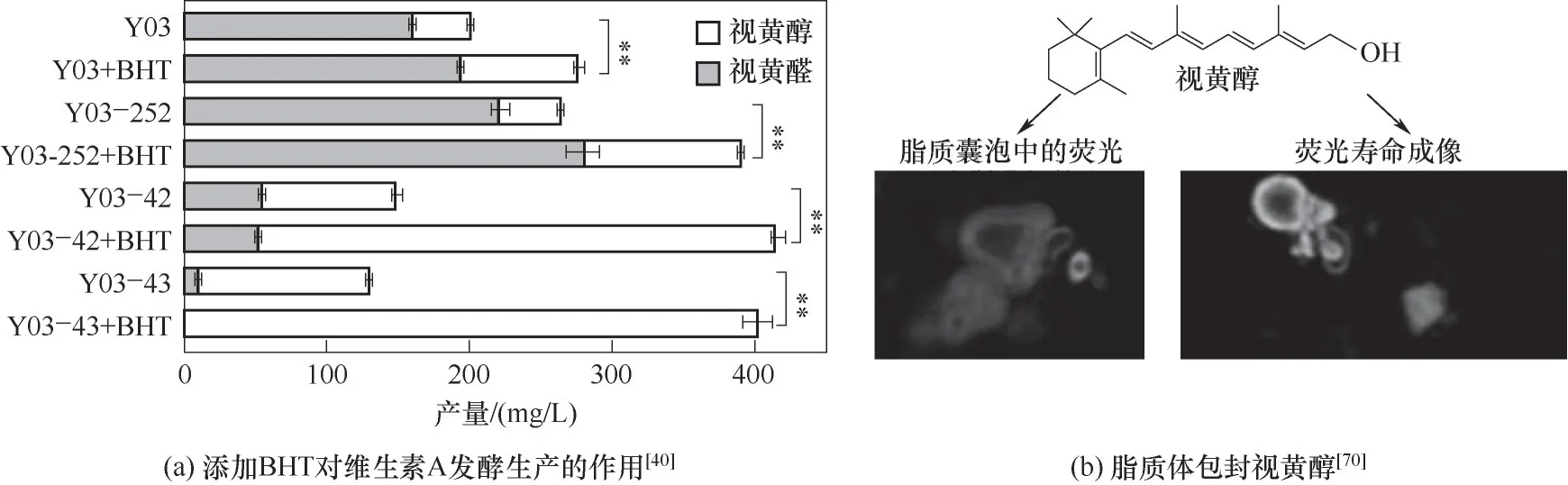
图6 维生素A储存条件优化策略Fig.6 Optimal strategy of vitamin A storage conditions
由于视黄醇对光和氧高度敏感,紫外线会导致其降解成各种潜在的有害产品,辐照后的视黄醇也能激活光敏剂,如叶绿素、孟加拉玫瑰红或核黄素[71],这些产品可能直接或间接损害DNA 和细胞膜,因此视黄醇储存条件的优化十分必要。
3 维生素A 的市场需求和生物合成前景
随着对维生素A 的研究越来越深入,其在市场上的需求量也越来越大[图7(a)]。据中国产业信息网统计,2018 年全球维生素A 需求量约2.7 万吨,较2017 年增长约5%,需求与产能比约为73%。假设2019~2022 年维生素A 需求量仍以5%的增速增长,则2022 年全球需求量约能达到3.3 万吨,2022 年全球市场规模将达到约10亿美元[图7(b)]。
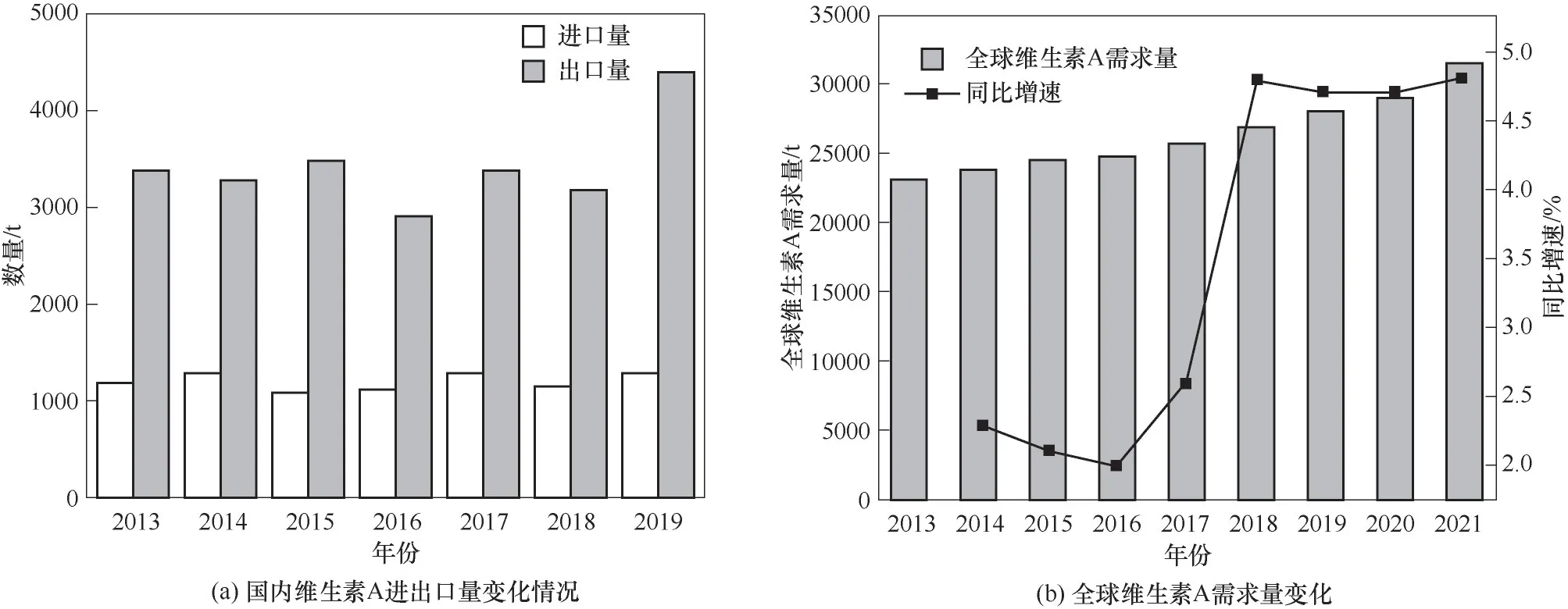
图7 维生素A市场供应情况Fig.7 Market supply of vitamin A
维生素A 虽然可以从动物组织中提取,但资源分散、步骤繁杂、成本高,目前维生素A 主要依靠化学合成。Roche 工艺技术成熟、收率稳定,但其缺陷是原辅材料多达40 种,反应步骤多,导致整体收率较低。BASF 工艺反应步骤少,工艺路线短,收率较高,但其核心技术难点Witting 乙炔化反应条件严苛,且该工艺中原料三苯基膦价格较高。
以可再生的糖为原料,微生物发酵生产维生素A可能比基于石化的生产工艺更具有成本效益和环境友好等优点。酿酒酵母工业生产维生素A具有优越性,包括易于遗传操作、方便规模发酵,目前维生素A 最高生产水平为在酵母细胞发酵120 h,维生素A 总 量 为2542.68 mg∕L,由97.51% 的 视 黄 醇(2479.34 mg∕L)和2.49%的维甲酸(63.34 mg∕L)组成,为工业化生产维生素A 提供了新的工程策略[40]。除此之外,Lee等[39]在使用橄榄油为萃取剂进行两相木糖培养时,发酵后获得含有166 IU∕ml维生素A 的橄榄油,可以被用作富含维生素A的营养品,提供了维生素A副产品的发展思路和策略。
4 总结与展望
维生素A 是人体必需的维生素,在维持视觉功能、调节细胞分化和凋亡、稳定上皮细胞形态和功能方面发挥着重要作用,可用作保健品、护肤品以及饲料营养素等,具有广阔的市场前景以及巨大的经济价值。
近年来,随着合成生物学、代谢工程、DNA 测序和组学分析等技术的快速发展,利用微生物构建细胞工厂合成维生素A 已经取得很大进展,但仍有很多挑战,如对天然合成途径及其中关键酶的认识较为浅薄,异源途径与底盘细胞环境的不适配,细胞工厂的生产能力与工业需求还存在差距等。
为了进一步提高微生物生产维生素A 的能力,可以采取以下方法:(1)通过对维生素A天然生产者的转录组、蛋白质组等深入研究,全面了解代谢网络和调控机制;(2)解析异源路径与底盘细胞之间的适配机制,通过代谢调控提高元件、模块、途径与底盘之间的适配性;(3)分析维生素A此类亲脂性化合物在底盘细胞中合成后的储存和转运机制,最大化利用胞内资源,从而在细胞自身代谢和异源产物合成中达到平衡,减少细胞的代谢压力,提高生产的可持续性;(4)搭建高通量、自动化以及智能化的合成生物学平台,多学科多领域交叉分析,如统计和数学方法结合产生的集合响应面法(response surface methodology,RSM)和 人 工 神 经 网 络(artificial neural network,ANN)[72],实现对代谢产物的实时监测,挖掘更多的代谢改造靶点,进而提升异源合成的效率,构建高效、稳定、可控的生产维生素A的微生物细胞工厂。

