分级介孔SiO2 空心微球氨基修饰及木瓜蛋白酶固定化
李群艳, 孙路瑶, 韩寿德, 伏 璇
(北京工业大学 材料与制造学部, 北京 100124)
1 前 言
固定化酶技术在工业生产、化学分析和医药等方面均有广阔的应用[1-4]。分级介孔SiO2材料具有多重孔径,较大的比表面积和特殊孔道结构,通过不同的吸附方式固定酶分子,如静电吸附、氢键作用和络合作用等,在酶固定领域有广泛的应用[5-8]。近年来,氨基修饰介孔SiO2材料用于酶固定已经成为研究者关注的重点[9-11]。氨基修饰介孔SiO2材料在酶固定化的科研领域作为一种新型的吸附剂,表现出吸附速率快、能耗小、吸附容量大的优点[12-15]。
由于氨基修饰过程中存在着反应条件复杂等诸多难题,近年来,广大科研工作者对应用在介孔SiO2表面的新型氨基功能试剂、简化氨基修饰条件和增加实际应用等方面进行了重点探究[16-18]。Bao 等[19]通过新型稳定微流体方法,制备出具有分级多孔结构的聚ε-己内酯/SiO2杂化微球,并将其应用于共固载牛血清蛋白和氯霉素乙酰转移酶。结果表明固定化后的酶性能比单固定化酶更优异,共价键结合的蛋白质/酶有更高的固定效率。但是,介孔孔道微观结构和氨基在孔道中的分布状态对其酶固定化性能的影响还缺乏细致的研究报道。
本研究采用间隔自组装水热法[20]和模板法制备出具有分级介孔结构的空心SiO2微球,并采用接枝法和原位法对分级介孔SiO2空心微球氨基修饰,进行木瓜蛋白酶固定,考察介孔孔道微观结构和氨基在孔道中的分布状态对其酶固定化性能影响机制。
2 实验(材料与方法)
2.1 实验材料与仪器
2.1.1 实验材料
聚环氧乙烷-聚环氧丙烷-聚环氧乙烷三嵌段共聚物PEG-PPG-PEG(P123,相对分子质量为5 800),分析纯,上海阿拉丁试剂有限公司;37% 浓盐酸,分析纯,北京通广精细化工公司;聚苯乙烯微球,分析纯,无锡瑞格生物技术有限公司;正硅酸乙酯(TEOS),分析纯,天津市福晨化学试剂厂;(3-氨丙基)三甲氧基硅烷(KH-540),分析纯,Alfa Aesar 公司;木瓜蛋白酶(3 000 U·g-1),麦克林公司;磷酸氢二钠,磷酸二氢钠,均为分析纯,天津市福晨化学试剂厂;酪蛋白、L-酪氨酸,均为99%,来自Sigma 公司;三氯乙酸,分析纯,天津市福晨化学试剂厂;L-半胱氨酸,99%,北京锁莱科技有限公司;乙二胺四乙酸,分析纯,北京化学试剂公司。百分数均为质量分数。
2.1.2 实验仪器
日本岛津XRD-7000 型X 射线衍射仪(XRD)、JEM-2010 型透射电子显微镜(TEM,工作电压为200 kV)、Micromeritics ASAP 2020 比表面全自动物理吸附仪、Thermo-NicoletAvatar370 型红外光谱仪、Thermo Evolution 600 紫外分光光度计。样品的孔结构参数是通过Micromeritics ASAP 2020 比表面全自动物理吸附仪对所制备的分级介孔SiO2空心微球进行N2吸附-脱附测试得到,利用BET 法计算样品的比表面积,利用BJH 法计算样品的孔径分布和平均孔径。
2.2 样品制备
(1) 分级介孔SiO2空心微球的制备:首先,将聚环氧乙烷-聚环氧丙烷-聚环氧乙烷三嵌段共聚物
PEG-PPG-PEG(P123)溶于去离子水中,配制成质量分数为10% 的P123 水溶液备用。取20.0 g 上述溶液,加入60.0 g 去离子水、11.9 g 浓盐酸和0.1 g 聚苯乙烯 (polystyrene,PS) 微球,将配制好的溶液记为溶液A。在溶液A 中第1 次加入2.6 g 正硅酸乙酯(TEOS),置于水浴锅中,温度保持在46 ℃,进行磁力搅拌。间隔3.5 h 后,第2 次加入1.6 g TEOS 并水浴搅拌24 h。然后在水热温度120 ℃下陈化24 h。陈化结束后,离心、抽滤、洗涤、沉淀至上清液pH 为7.0 左右,将所得样品置于烘箱干燥,于550 ℃煅烧4 h,获得最终样品分级介孔SiO2空心微球,命名为“HM120-un”。
(2) 接枝法氨基修饰:将质量分数为97% 的KH-540 溶于去离子水中,分别配制成质量分数为5%、10%、20%、50% 的(3-氨丙基)三甲氧基硅烷水溶液备用。分别称取20.0 g 上述溶液,并加入0.2 g 分级介孔SiO2空心微球超声分散20 min 后搅拌2 h,重复3 次。离心洗涤沉淀3 次,烘干得到氨基修饰后的分级介孔SiO2空心微球样品。分别命名为“HM120-5%、HM120-10%、HM120-20%、HM120-50%”。
(3) 原位法氨基修饰:在溶液A 中分别加入0.1、0.2、0.3、0.4 mol 的97% 的KH-540。按一定物质的量比n(KH-540):n(TEOS)重复第(1)步,分2 次加入TEOS,间隔时间为3.5 h,水热陈化、抽滤洗涤。所得产物在50 ℃下利用酸化乙醇进行2 次萃取,每次6 h,以去除表面活性剂。最后经无水乙醇和去离子水洗涤,进行抽滤、干燥,获得氨基修饰的分级介孔SiO2空心微球样品。物质的量比n(KH-540):n(TEOS)分别为0.5:1、1:1、1.5:1、2:1,并命名为HM120-0.5:1、HM120-1:1、HM120-1.5:1、HM120-2:1。
2.3 木瓜蛋白酶固定实验
利用pH=7.0 的磷酸盐缓冲溶液配制质量浓度为1.0 mg·mL-1的木瓜蛋白酶溶液。分别取0.01 g 分级介孔SiO2空心微球样品放入10 mL质量浓度为1.0 mg·mL-1的木瓜蛋白酶溶液中,在4 ℃搅拌吸附120 min后,离心取其上清液,并用磷酸盐缓冲液洗涤沉淀,将洗脱液与上清液混合形成剩余酶液,然后重复测定3 次剩余酶液的质量浓度,测定上清液在278 nm 处的吸光度,根据预先在278 nm 处测定的木瓜蛋白酶的标准曲线(相关系数为0.995 2),计算上清液中剩余木瓜蛋白酶的质量浓度。根据式(1)计算吸附在分级介孔SiO2空心微球上的木瓜蛋白酶量,并计算平均值和标准差,最后将离心所得的沉淀放入冰箱中干燥得到固定化酶。

式中:qt为木瓜蛋白酶在t时刻的吸附量(mg·g-1);ρ0为木瓜蛋白酶的初始质量浓度(mg·mL-1);ρt为t时刻木瓜蛋白酶的剩余酶质量浓度(mg·mL-1);V为溶液的总体积(L);m为载体材料的质量(g)。
2.4 分级介孔SiO2 空心微球固定化木瓜蛋白酶活力的测定
取0.03 g 固定化木瓜蛋白酶,加入5 mL 激活剂(2 mmol·L-1的半胱氨酸和1 mmol·L-1的乙二胺四乙酸在pH=7.0 的磷酸盐缓冲溶液中的混合液),在40 ℃下震荡反应10 min,然后加入5 mL,1.0 mg·mL-1的底物酪蛋白溶液,催化反应5 min 后,向混合溶液中加入5 mL 质量分数为5% 的三氯乙酸溶液终止反应,离心分离,用紫外可见分光光度计重复测定3 次上清液中酪氨酸在275 nm 处吸光度的变化值(根据预先在275 nm 处测定的酪氨酸标准曲线,相关系数为0.997 0),从而得到修饰前后分级介孔SiO2空心微球固定化木瓜蛋白酶的酶活力,并计算平均值和标准差。酶活力单位定义:在上述条件下,1 min 内木瓜蛋白酶催化分解酪蛋白产生1 μg 酪氨酸所需的酶量为1 个活力单位(U)。氨基修饰后载体的固定化木瓜蛋白酶的相对酶活力是氨基修饰后载体的固定化木瓜蛋白酶的酶活力与未修饰载体的固定化木瓜蛋白酶的酶活力的比值,通常以百分数表示。
3 实验结果与讨论
3.1 分级介孔SiO2 空心微球的微观结构
图1 是采用聚苯乙烯微球(PS 球)为空心硬模板,间隔自组装水热法结合制备的分级介孔SiO2空心微球的透射电镜照片。图1(a)是多个分级介孔SiO2空心微球的TEM 图片,可以看出空心微球分布均匀,说明成功制备出分级介孔SiO2空心微球。图1(b)是单个分级介孔SiO2空心微球透射电镜照片,从图中可以看出PS 球已经完全去除,空心结构未发生坍塌,有完整的球形结构。图1(c)是120 ℃水热温度下,分级介孔SiO2空心微球局部放大的透射电镜照片,可以在图中观察到不同尺寸的一、二级孔存在,已在图1(c)中用红色虚线标出。这表明,本研究以PS 球为空心硬模板,采用间隔自组装水热法[20]实现了分级介孔SiO2壳层,成功制备出分级介孔SiO2空心微球。其具体的形成机制为:第1 次加入的硅源与P123 之间发生自组装过程,形成较小一级孔。第2 次加入的硅源干扰了第一阶段自组装过程,同时重新开始自组装过程,这二者形成的胶束相互缠绕。第二级孔实际上是由一级孔材料堆积形成的SiO2颗粒之间的较大孔隙。

图1 分级介孔SiO2 空心微球(HM120-un)的TEM 照片Fig.1 TEM images of hierarchical mesoporous SiO2 hollow microspheres (HM120-un)
3.2 氨基修饰分级介孔SiO2 空心微球红外光谱表征
图2 为分别采用接枝法和原位法进行氨基修饰后的分级介孔SiO2空心微球样品的红外光谱图。从图2(a)和(b)中可以看出,接枝法和原位法修饰的分级介孔SiO2空心微球分别在波数1 641 和1 638 cm-1附近观察到微弱的吸收峰,相对于接枝法,原位法中氨基修饰后微球样品的吸收峰更加明显,这表明原位法修饰后的分级介孔SiO2空心微球孔道中有更多的氨基。在局部放大图中可以看到,由于氨基中N─H 变形振动的化学位移在1 600~1 640 cm-1,故判断此波动是由氨基中N─H 键的振动引起的,从而证明分级介孔SiO2空心微球的氨基修饰是成功的。经过对修饰后的样品多次洗涤,重复进行红外光谱谱图测试,并未发现氨基吸收峰强度的改变,表明样品中没有残留的(3-氨丙基)三甲氧基硅烷修饰剂,进一步证明氨基成功地修饰到分级介孔SiO2空心微球中。另外在750~1 200 cm-1的吸收峰则归属为Si─OH 和Si─O─Si 的振动。

图2 氨基修饰分级介孔SiO2 空心微球的FTIR 图及局部放大图Fig.2 FTIR spectra with partially enlarged areas of amino-modified hierarchical mesoporous SiO2 hollow microspheres
3.3 氨基修饰分级介孔SiO2空心微球的孔结构表征
从图3(a)和(b)可以看出,用接枝法和原位法制备出的不同修饰条件下氨基修饰的分级介孔SiO2空心微球的N2吸附-脱附曲线均为标准的第IV 类等温线,意味着制备的分级介孔SiO2空心微球具有典型的介孔结构。从图3 可见,所有的微球样品在相对压力p/p0=0.6~0.8 出现一个滞后环,这表明微球样品中存在介孔结构。其中未修饰和接枝法修饰制备的SiO2空心微球产生的滞后环更接近于H3 型,说明接枝法修饰并未对孔的形状产生影响。原位法修饰的SiO2空心微球与未修饰的相比,滞后环类型发生明显变化。原位法制备的2 组样品(HM120-1:1 与HM120-2:1)的滞后环接近于H1 型,HM120-0.5:1 与HM120-1.5:1的滞后环接近于H4 型。这说明在原位法氨基修饰后孔的形状发生了改变。这是因为在原位法中氨基修饰剂的早期加入影响了后面介孔自组装的形成过程,从而影响了介孔形状。在相对压力p/p0达到0.9 之后,又出现了1 个滞后环,表明二级孔出现。孔径分布图中均显示出2 个不同位置的峰。
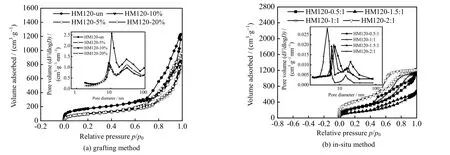
图3 氨基修饰分级介孔SiO2 空心微球氮气吸附脱附曲线及孔径分布图Fig.3 N2 adsorption-desorption curves and pore size distribution of amino-modified hierarchical mesoporous SiO2 hollow microspheres
从表1 中可以看出接枝法氨基修饰后的分级介孔SiO2空心微球比表面积显著下降,从630 下降到367 m2·g-1,且一级孔孔径变小,从10.65 减小到8.70 nm 左右,二级孔孔径受氨基修饰的影响不大,由28.88 增加到29.30 nm 左右,结合红外图谱分析说明氨基主要接枝在一级孔孔道上。而从原位法氨基修饰的分级介孔SiO2空心微球比表面与孔径参数可以看出氨基修饰后的分级介孔SiO2空心微球比表面积显著下降,从630 减小到296 m2·g-1,且一级孔、二级孔孔径均变小,一级孔从10.65 减小到4.47 nm,二级孔从28.88 减小到14.49 nm,结合红外图谱说明氨基在一级孔、二级孔上均完成了氨基修饰。

表1 接枝法及原位法氨基修饰的分级介孔SiO2 空心微球孔结构参数Table 1 Pore parameters of hierarchical mesoporous SiO2 hollow microspheres modified by grafting and in-situ amino methods
3.4 分级介孔SiO2空心微球的酶固定化性能研究
图4 是接枝法和原位法修饰前后分级介孔二氧化硅空心微球对木瓜蛋白酶固定量。从图4(a)中可以看出修饰前分级介孔SiO2空心微球对木瓜蛋白酶固定量为630 mg·g-1,接枝法5%、10%、20%、50%KH-540 修饰后分级介孔SiO2空心微球的木瓜蛋白酶固定量分别为650、702、630、620 mg·g-1。从图4(b)可以看出原位法n(KH-540):n(TEOS)分别为0.5:1、1:1、1.5:1、2:1 修饰后载体的木瓜蛋白酶固定量分别为680、750、620、600 mg·g-1。

图4 不同氨基修饰的微球对木瓜蛋白酶固定量Fig.4 Papain immobilized by microspheres under different amino modification methods
2 种方法氨基修饰后的分级介孔SiO2空心微球的木瓜蛋白酶的吸附量均高于未修饰的分级介孔SiO2空心微球,但并非修饰量越多,酶固定量越大。接枝法用10% KH-540 修饰后酶固定量达到峰值,702 mg·g-1。原位法中用n(KH-540):n(TEOS)为1:1 修饰后载体的酶固定量达到峰值750 mg·g-1。这是因为在分级介孔SiO2空心微球孔道中进行氨基修饰,一方面使其更容易与木瓜蛋白酶结合,另一方面同时会堵塞一部分介孔孔道。原位法氨基修饰的分级介孔SiO2空心微球最大木瓜蛋白酶固定量高于接枝法,这是因为原位法中一级介孔孔道和二级介孔孔道中均有氨基修饰,二级孔道中的氨基更容易与木瓜蛋白酶结合,而且更大的孔道不容易发生堵塞,从而有更高的酶固定量。
图5 是接枝法和原位法修饰前后载体的固定化木瓜蛋白酶在温度为40 ℃,pH 为7.0 时的相对酶活力数据。从图5 中可以看出,接枝法修饰中随着载体氨基修饰量增大到10% 时,固定化木瓜蛋白酶的相对酶活力升高到最大值116.5%,当载体中氨基修饰量进一步增大到50%,其固定化酶相对酶活力(99.0%)会略低于未修饰载体的固定化酶相对酶活力(100.0%)。原位法修饰随着载体氨基修饰量的增大,固定化木瓜蛋白酶相对酶活力也呈现先增大后减小的趋势,这是因为随着载体氨基修饰量增加,酶与载体的接触越充分,与底物的结合活性位点越多,固定化酶活力也越高,相对酶活力相应提高。当载体中氨基修饰量增大到一定程度时,由于氨基和酶的偶联反应更容易进行,酶的部分活性位点参与氨基偶联反应,导致酶与底物的结合活性位点变少,酶活力降低,相对酶活力下降。当载体中氨基修饰量n(KH-540):n(TEOS)为1:1 时,固定化木瓜蛋白酶的相对酶活力最大(121.0%)。

图5 不同氨基修饰微球中固定化木瓜蛋白酶的相对酶活力Fig.5 Relative enzyme activity of immobilized papain in different amino-modified microspheres
4 结 论
成功制备了具有大的比表面积(630 m2·g-1)和分级孔道结构(一、二级孔径分别为10.65 和28.88 nm)的SiO2空心微球。采用接枝法和原位法对分级介孔SiO2空心微球样品进行氨基修饰,氨基在分级孔道中呈现不同的微观结构分布。2 种方法进行氨基修饰后的分级介孔SiO2空心微球的木瓜蛋白酶的吸附量均高于未修饰的分级介孔SiO2空心微球。原位法氨基修饰的分级介孔SiO2空心微球最大木瓜蛋白酶固定量(750 mg·g-1)高于接枝法的固定量(702 mg·g-1),这可能是由于原位法中在一、二级介孔孔道中均有氨基修饰,更大的孔道不容易发生堵塞的同时,孔道中修饰的氨基更容易与木瓜蛋白酶结合,从而有更高的酶固定量。后接枝法和原位法修饰后载体的固定化木瓜蛋白酶的相对酶活力随着氨基修饰量的增大均呈现先增大后减小的趋势,后接枝法中当载体中氨基修饰量增大到10% 时,相对酶活力达到最大值116.5%,原位法中当载体中氨基修饰量为1:1 时,固定化木瓜蛋白酶的相对酶活力最大(121.0%)。

