TEAD4、SHP-2及Ang-2表达与口腔鳞癌病理参数和预后的关系
孟媛媛 赵亭亭 吕红娟
口腔鳞癌(oral squamous cell carcinoma,OSCC)是头颈部鳞癌中发病率最高的一种恶性肿瘤,据相关数据显示,OSCC 发病率近年有逐渐上升趋势[1]。临床中对于OSCC 患者的治疗方式包括外科手术、放/化疗以及其他辅助治疗,且获得了较好的临床疗效,但患者五年生存率仍在50%以下[2]。如何提高改善患者预后,寻找预后评估相关指标成为临床研究热点。组蛋白赖氨酸去甲基化酶4A(Histone lysine demethylase 4,TEAD4)属于TEA结构域DNA 结合转录因子家族(TEA domain transcription factor,TEAD)中的核心成员,在人体疾病以及各种生物学反应中具有重要的作用[3]。蛋白酪氨酸磷酸酶-2(Protein tyrosine Phosphatase-2,SHP-2)在组织、细胞中均广泛表达,与胚胎发育、细胞迁徙、繁殖、分化等均有密切的联系,有研究显示,SHP-2 的异常表达与多种癌症发生具有密切联系[4]。促血管生成素-2(Angiopoietin-2,Ang-2)是促肿瘤血管生成的相关因子,对病理性血管生成及发育有调节作用,可影响肿瘤的恶性发展[5]。本研究将通过分析TEAD4、SHP-2 及Ang-2在OSCC 患者中的表达情况,了解三者与患者病理参与及预后的关系,现报道如下。
1 资料与方法
1.1 一般资料
收集2019年12月至2020年12月于河北北方学院附属第一医院行外科手术治疗或活检的的OSCC 患者121 例,其中男72 例,女49 例,平均年龄为(59.59±4.16)岁,根据国际抗癌联盟(Union for International Cancer Control,UICC)[6]中分期标准分为:Ⅰ~Ⅱ期55 例,Ⅲ~Ⅳ期66 例;68 例淋巴结转移;组织分化:低分化74 例,中-高分化47 例;肿瘤直径≥3 cm 57 例,<3 cm 64 例。纳入标准:①均经临床病理诊断确诊为OSCC,符合《口腔鳞状细胞癌时辰化疗中国专家共识》中相关诊断标准[7];②在检查前均未进行放疗或化疗;③患者知情且同意;④临床资料完整。排除标准:①存在血液系统或免疫系统疾病者;②合并存在心、肝、肾等严重原发性疾病者;③合并其他肿瘤者;④存在严重并发症者。以患者术中病理送检组织作为OSCC 组,癌旁组织(距离癌组织>5 cm)为对照组。本研究经院医学伦理委员会批准通过。
1.2 方法
1.2.1 资料收集
收集患者临床资料,包括年龄、性别、肿瘤直径、病理特征等,病理特征包括:临床分期(Ⅰ~Ⅱ期、Ⅲ~Ⅳ期)、组织分化(低分化、中高分化)、淋巴结转移。并对患者进行为期12 个月随访,以电话、短信、回院复查等方式了解患者预后情况,随访时间:2021年1月1日至2022年1月1日,根据患者预后情况进行分组:预后良好(无复发、转移、死亡),预后不良(死亡、转移、复发等)。
1.2.2 TEAD4、SHP-2 及Ang-2 检测
TEAD4、SHP-2 及Ang-2 均使用免疫组化法进行检测。获取病理标本,使用4%甲醛固定,常规石蜡包埋,行4 mm 厚连续切片,用于后续检查。TEAD4 以兔抗人KDM4A 多克隆抗体Abnova(上海煊翎生物科技有限公司)为一抗;SHP-2 使用兔抗人SHP-2 多克隆抗体(英国Abcam 公司);Ang-2 以兔抗人Ang-2 单克隆抗体标记Ang-2 蛋白(武汉博士德公司)。每组实验均设阳性对照和用PBS 缓冲液代替一抗作阴性对照,阳性对照为已知染色阳性切片。
结果判定[6]:由2 名经验丰富病理科医生在双盲情况下对结果进行判断,TEAD4 表达阳性为细胞膜或胞浆内有棕色颗粒为阳性,SHP-2 阳性为细胞质中出现棕黄色颗粒,Ang-2 以细胞质内出现棕黄色颗粒为阳性细胞。在高倍镜下(×400)随机选择5 个视野对切片进行观察,一个视野200 个细胞,一共计数1 000 个细胞。采用4 级半定量法评分。着色程度:基本不着色为0 分、淡黄色为1 分、黄色为2 分、棕黄色为3 分;阳性细胞百分比:选取有代表性的10 个高倍镜视野,随机计数100 个细胞,计算阳性细胞百分比,<5%得0 分、5%~25%得1 分、25%~50%得2 分、50%~75%得3 分、>75%得4 分;每张切片的最后得分为着色程度与阳性细胞百分比乘积,≥3 分为阳性。
1.3 统计学方法
采用SPSS 18.0 统计软件进行统计分析,计数资料采用n(%)表示,采用χ2检验;并采用多元Logistic回归分析TEAD4、SHP-2 及Ang-2 与OSCC 患者预后关系,以P<0.05 为差异具有统计学意义。
2 结果
2.1 不同组织中TEAD4、SHP-2 及Ang-2 表达情况比较
OSCC 癌组织中TEAD4、SHP-2 及Ang-2 阳性表达均明显高于对照组,差异均有统计学意义(P<0.05)。见表1、图1。

表1 不同组织中TEAD4、SHP-2 及Ang-2 表达情况比较[n(%)]Table 1 Comparison of TEAD4,SHP-2 and Ang-2 expression in different tissues[n(%)]
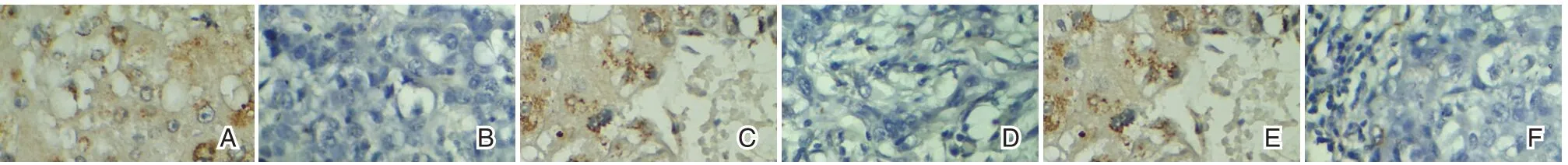
图1 TEAD4、SHP-2 及Ang-2 免疫组化图(SP,×400)Figure 1 Immunohistochemistry of tead4,SHP-2 and Ang-2(SP,×400)
2.2 TEAD4、SHP-2 及Ang-2 与OSCC 患者病理特征的关系
TEAD4 在有淋巴结转移、临床分期为Ⅲ~Ⅳ期患者中阳性表达占比高于无淋巴结转移、临床分期为Ⅰ~Ⅱ期患者,SHP-2 在有淋巴结转移、临床分期为Ⅲ~Ⅳ期、组织分化为低分化患者中阳性表达占比高于无淋巴结转移、临床分期为Ⅰ~Ⅱ期、组织分化为中高分化患者,淋巴结转移者Ang-2 阳性表达明显高于淋巴结未转移者,差异均有统计学意义(P<0.05)。见表2。
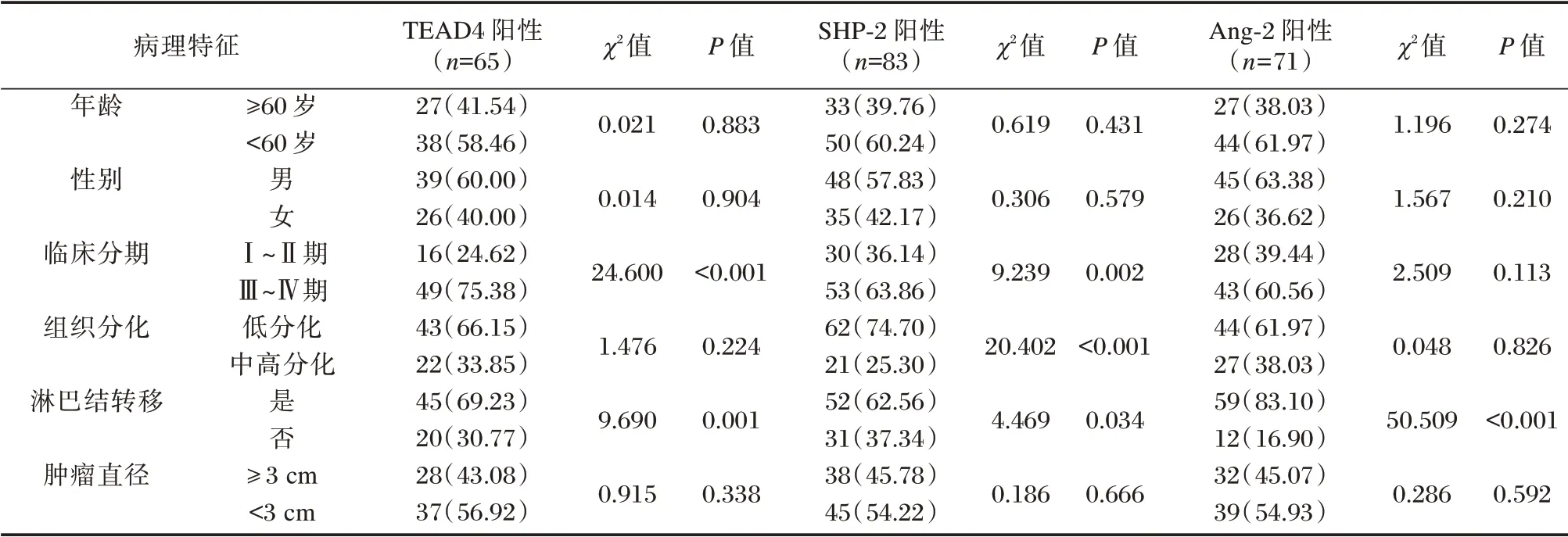
表2 CEA、AFP、CYFRA21-1 与NSCLC 患者病理特征的关系[n(%)]Table 2 The relationship between CEA,AFP,CYFRA21-1 and pathological characteristics of NSCLC patients[n(%)]
2.3 TEAD4、SHP-2 及Ang-2 与OSCC 患者预后关系
121 例患者预后良好87 例,预后不良34 例,预后不良组临床分期为Ⅲ~Ⅳ期、组织分化为低分化、有淋巴结转移者组织中TEAD4、SHP-2、Ang-2阳性表达明显高于预后良好组,差异均有统计学意义(P<0.05)。见表3。
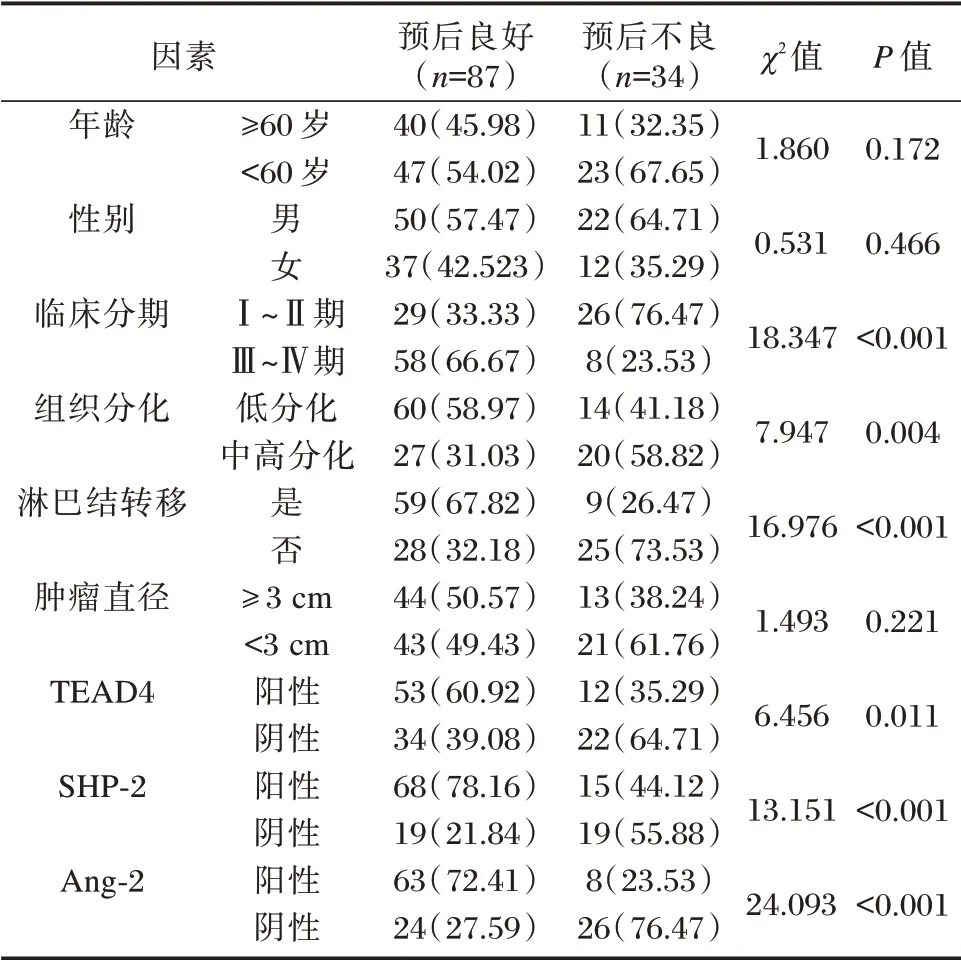
表3 TEAD4、SHP-2 及Ang-2 与OSCC 患者预后关系[n(%)]Table 3 Relationship between TEAD4,SHP-2 and Ang-2 and prognosis of OSCC patients[n(%)]
2.4 影响OSCC 患者预后相关因素分析
待分析因素的意义及赋值见表4,经多元Logistic回归分析可知,临床分期、组织分化、淋巴结转移、TEAD4、SHP-2、Ang-2 是影响OSCC 患者预后不良的独立危险因素(P<0.05)。见表5。

表4 待分析因素的意义及赋值Table 4 Significance and assignment of factors to be analyzed
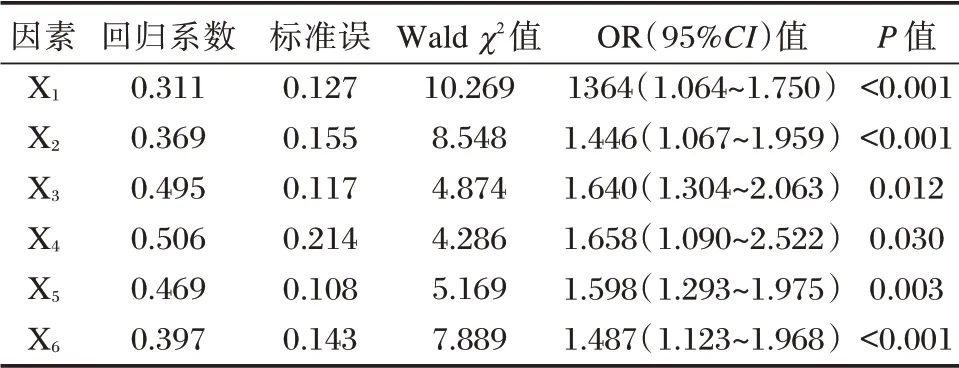
表5 影响OSCC 患者预后多因素Table 5 Multiple factors affecting the prognosis of OSCC patients
3 讨论
以往研究显示,Hippo 信号通路可参与恶性肿瘤的发生,TEAD4 则是其中重要的转录因子,可与Hippo 通路中的核心成员Yes 相关蛋白(Yes-associatedprotein,YAP)/ 转录共激活因子PDZ 结合基序(transcriptional co-activator with PDZ-binding motif,TAZ)形成转录复合物,进而调控下游基因的表达[8]。而基因的异常表达也常被认为是恶性肿瘤发生、发展中的一个重要因素。有研究显示,在前列腺癌中TEAD4 表达异常,在对患者使用特异性小分子阻断剂抑制TEAD4 表达后,患者的癌细胞增殖也受到明显抑制,癌细胞凋亡明显增加[9]。本研究结果显示,TEAD4 在OSCC 患者癌变组织中表达阳性率明显升高,这表明TEAD4 或许可影响OSCC 发生发展。而TEAD4 表达与患者临床分期及淋巴结转移密切相关,说明TEAD4 可能促进癌细胞增殖、转移,进而增加肿瘤的侵袭能力,与以往研究结果相符[10]。
SHP-2 属于蛋白酪氨酸激酶与蛋白酪氨酸磷酸酶(protein tyrosine phosphatase,PTPs)中的一员,参与细胞的分化、增殖。以往研究显示,SHP-2 与多种肿瘤的发生、发展存在相关性[11]。有研究显示,在乳腺癌、胃癌、宫颈癌组织中SHP-2 为高表达,且SHP-2 突变与白血病之间密切相关[12]。何芳等[13]研究则发现,SHP-2 具有促进细胞迁移、黏附及运动的作用,侧面说明SHP-2 在恶性肿瘤发展中扮演重要角色。本研究结果显示,SHP-2 在OSCC 癌组织中为高表达,且与患者临床分期、淋巴结转移、组织分化程度均存在密切的联系,说明SHP-2 可能参与OSCC 的增殖与转移,SHP-2 或许可作为淋巴结转移预测的相关指标。
有研究显示,OSCC 患者的恶性进展和其肿瘤血管生成之间存在密切联系,但有关OSCC 患者血管生成的调控机制尚未明确[14]。Ang-2 属于促血管生成素中的一员,是近年来发现与血管生成、成熟的相关因子之一。在正常人组织中,Ang-2 主要表达于女性胎盘、卵巢组织的血管重建中,在机体正常组织中并无表达或为极低表达。在多数恶性肿瘤中,如胃癌、脑胶质瘤、肝癌等患者中Ang-2阳性表达率升高,且其表达异常发生于癌变的早期,与肿瘤侵袭程度、预后均有密切的联系[15-16]。本研究结果显示,Ang-2 在OSCC 癌变组织中表达上调,在正常组织中表达较低,与以往研究结果一致[17],分析原因可能与肿瘤发展过程中新生血管生成,进而引起Ang-2 的表达增加有关。而Ang-2与患者淋巴结转移情况密切相关,说明随着肿瘤恶性程度增加,Ang-2 表达上调,Ang-2 可能通过参与OSCC 患者的血管生成,进而在肿瘤浸润及转移中发挥着作用。
通过分析患者预后情况可知,TEAD4、SHP-2、Ang-2 在预后不良患者中均为高表达,且三者与淋巴结转移、临床分期、组织分级均属于影响OSCC患者预后的相关因素,与以往研究结果相符[18],说明TEAD4、SHP-2、Ang-2 表达情况对患者预后情况评估有一定参考价值,临床对存在相关危险因素者需引床重视,及时采取干预措施,对TEAD4、SHP-2、Ang-2 高表达者在手术治疗后可合理辅助其他手段来提高患者预后。
综上所述,TEAD4、SHP-2 及Ang-2 在OSCC癌组织中均异常高表达,与患者病理特征及预后均存在相关性,三者或许可成为OSCC 诊断及预后的相关肿瘤标记物,对临床诊疗方案制定也有一定参考价值。

