新型炎症反应标志物对老年股骨转子间骨折术后下肢深静脉血栓的预测价值
胡建华,黄 洁*,肖 莹,程喜荣,刘 雯,熊春红,李 勇,李 慧,余 虹
1.江西中医药大学附属医院,江西 330006;2.江苏省第二中医院;3.兴国县人民医院;4.南昌大学第二附属医院
股骨转子间骨折是老年人最常见的骨质疏松性骨折之一,多由低能、坠落损伤引起,占所有骨折的10%~20%,占髋部骨折的50%~65%。骨折发生后,因血液高凝状态、创伤后应激及机体炎症免疫反应使病人的深静脉血栓形成(deep venous thrombosis,DVT)风险增高。据报道,转子间骨折本身是DVT 的危险因素,与股骨颈骨折相比,DVT 发生风险增加2.5倍[1]。DVT 会导致慢性疼痛及继发性静脉曲张、溃疡,严重影响病人术后康复及生活质量,甚至导致致命的肺栓塞[2]。由于沉默性、复杂性和缺乏主体症状和临床体征,DVT 无法被准确预测,可能会延误预防和治疗。识别术后发生下肢DVT 的高危病人,提供及时、有效的预防及治疗策略是关键。临床中主要通过检测D-二聚体(D-dimer,D-D)水平来预测DVT 风险,但准确性并不令人满意[3]。近年来,炎症被认为是多种危险因素触发DVT 的共同途径,炎症可释放各种促炎和促氧化细胞因子,促进凝血和抑制纤溶;也会对血管壁造成伤害,使病情恶化[4]。因此,多种炎症反应标志物,如高敏C 反应蛋白(high-sensitivity C-reactive protein,hs-CRP)和白细胞介素-18(interleukin-18,IL-18)已经被报道与DVT 相关[5]。此外,从术前全血计数中获得的几个参数,如中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)和血小板与淋巴细胞比值(platelet to lymphocyte ratio,PLR)、淋巴细胞与单核细胞比值(lymphocyte to monocyte ratio,LMR)、单核细胞与高密度脂蛋白比值(monocyte to high-density lipoprotein ratio,MHR)被认为是系统性炎症反应标志物,并被报道与DVT 相关[6-7]。同时,部分炎症反应标志物与转子间骨折术后感染及死亡风险相关[8-9],这促使研究者探索NLR、PLR、LMR 和MHR 在预测老年转子间骨折术后下肢DVT 的临床诊断价值;此外,单独炎症反应标志物未必能全面反映老年转子间骨折术前的机体状态,本研究试图整合炎症反应标志物并开发新型炎症反应标志物评分;最后,结合新型炎症反应标志物评分构建预测老年转子间骨折术后下肢DVT风险的Nomogram 模型,便于临床使用。
1 资料与方法
1.1 一般资料 选取江西中医药大学附属医院2019年1 月—2021 年11 月进行手术治疗的老年转子间骨折病人。纳入标准:年龄60 岁及以上;低能量创伤所致单侧、闭合性转子间骨折;伤后7 d 内入院。排除标准:术前存在下肢DVT 病人;高能量损伤、开放性骨折、转子下骨折、多处骨折及病理性骨折病人;延迟入院(骨折后超过7 d 入院)病人;既往髋关节手术史病人;近期1 个月内接受抗凝治疗病人,如使用过阿司匹林、肝素、低分子肝素或其他药物;急性肾衰竭、接受血液透析治疗病人;心脏病病人,如心力衰竭、急性冠脉综合征、心律失常和心脏瓣膜疾病;自身免疫性疾病、急性或者慢性感染、败血症和接受影响白细胞数量药物治疗病人;精神药物依赖或成瘾病人;临床资料不全病人。最终纳入病人315 例。本研究获得医院伦理委员会批准通过。
1.2 方法
1.2.1 数据收集 ①收集病人一般临床资料,包括年龄、性别、体质指数(body mass index,BMI)、美国麻醉师协会(American Society of Anesthesiologists,ASA)分级、基础疾病[高血压、糖尿病、冠心病、慢性肾脏疾病及慢性阻塞性肺疾病(COPD)]、吸烟、骨折类型[国际内固定研究学会/矫形创伤协会(AO/OTA)分类系统]、术前卧床时间及预防性抗凝。②血液指标及炎症反应标志物,包括清蛋白(albumin,ALB)、D-D、空腹血 糖(fasting blood glucose,FBG)、红 细 胞 沉 降 率(erythrocyte sedimentation rate,ESR)、hs-CRP、NLR、PLR、LMR 及MHR。预防性抗凝是指使用低分子肝素进行预防(4 100 U,每日1 次)。对于血流动力学不稳定病人,一旦稳定就给予低分子肝素。D-D 阳性为阈值>0.5 μg/mL;FBG 阳性为阈值>6.10 mmol/L;ESR 阳性为阈值>20 mm/h;hs-CRP 阳性为阈值>8.00 mg/L。
1.2.2 DVT 诊断标准 根据中华医学会《深静脉血栓形成的诊断和治疗指南(第3 版)》[10]诊断DVT。术后常规对双侧肢体股总静脉、股浅静脉、股深静脉、腘静脉、胫前静脉、胫后静脉和腓静脉进行多普勒超声扫描。诊断标准:静脉腔不能受压;腔内固体回波;管腔血流信号充盈缺损;远端肢体血流增强或减弱。排除浅表性或孤立性小腿肌肉静脉血栓形成。腘静脉和近端血栓(股浅静脉、股深静脉和股总静脉)被归类为近端DVT;胫前静脉、胫后静脉和腓静脉血栓被归类为远端血栓。近端血栓和远端血栓病人归为下肢DVT 组。
1.3 统计学方法 本研究数据采用SPSS 22.0 统计学软件进行处理。定性资料用例数、百分比(%)表示,采用χ2检验;等级资料采用非参数秩和检验。符合正态分布的定量资料采用均数±标准差(±s)表示,采用独立样本t检验。采用受试者工作特征(ROC)曲线分析相关变量的最佳截断值;采用Logistic 回归模型分析病人发生下肢DVT 的危险因素;采用Hmisc 及rms 等构建Nomogram 模型并进行内部数据集校正分析、ROC 分析及决策曲线分析。以P<0.05 为差异具有统计学意义。
2 结果
2.1 DVT 病人与无DVT 病人临床资料比较 最终纳入病人315 例。315 例病人中,67 例病人出现术后下肢DVT,发生率为21.3%。DVT 组病人年龄、ASA 分级(Ⅲ级)比例、吸烟比例、术前卧床时间、D-D 阳性比例、hs-CRP 阳 性 比 例、NLR 及PLR 高 于 无DVT 组 病人(P<0.05),ALB、LMR 及MHR 低于无DVT 组病人(P<0.05),见表1。
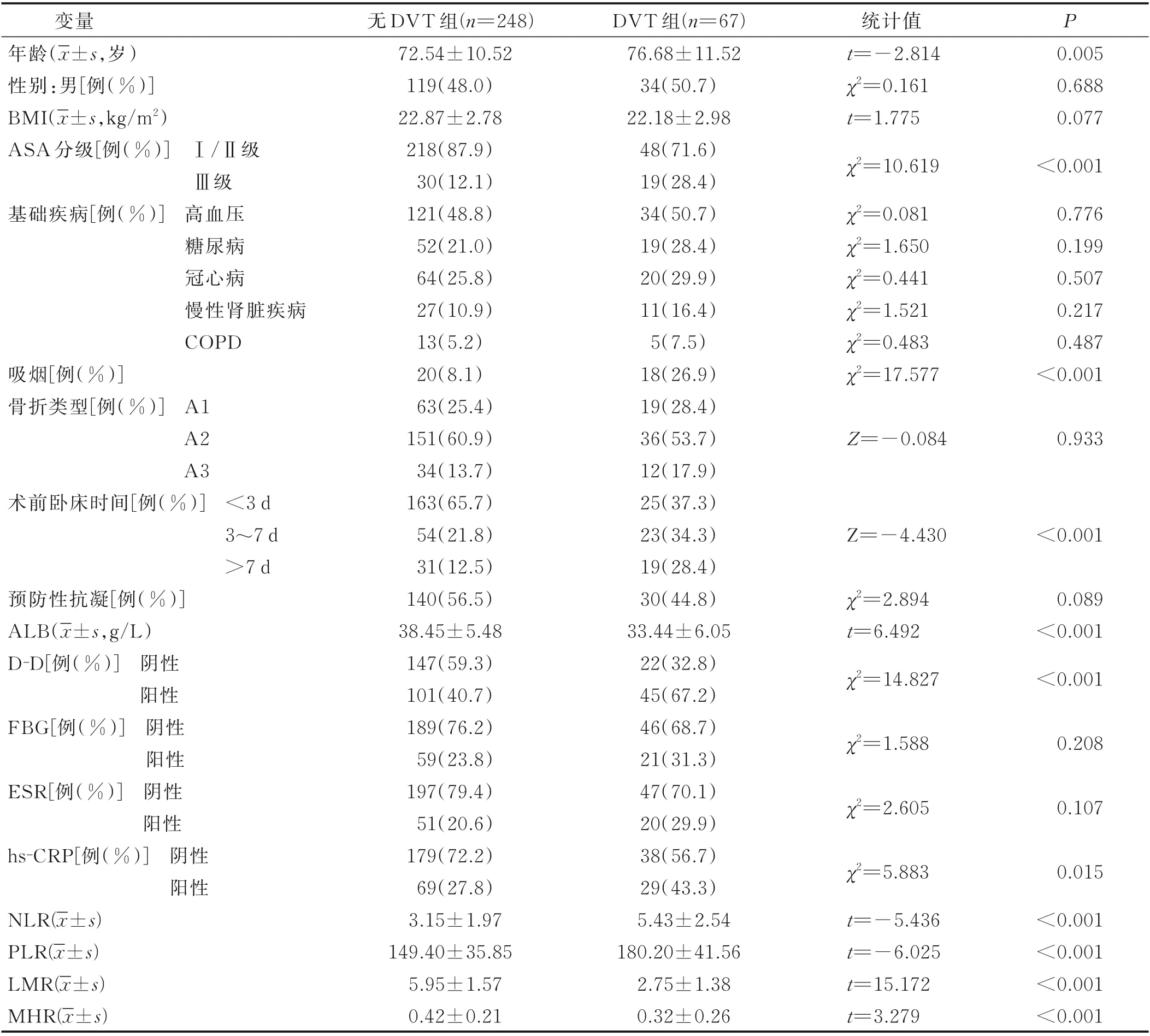
表1 DVT 病人与无DVT 病人临床资料比较
2.2 NLR、PLR、LMR 及MHR 的ROC 分析及新型炎症反应标志物评分构建 NLR、PLR、LMR 及MHR的曲线下面积(AUC)分别为0.716,0.716,0.731 及0.716,最佳截断值分别为5.32,189.58,2.57,0.29。基于4 种炎症反应标志物的最佳截断值,开发一种新型炎症反应标志物评分:NLR-PLR-LMR-MHR 评分(NLR-PLR-LMR-MHR score,NPLMS),评分标准见表2。无DVT 组NPLMS 为(0.45±0.59)分,DVT 组(1.88±0.99)分,两组比较差异有统计学意义(P<0.05)。NPLMS 的AUC 为0.770,高 于NLR、PLR、LMR 及MHR 的AUC。

表2 NPLMS 具体评分标准
2.3 影响老年股骨转子间骨折术后发生下肢DVT 的多因素Logistic回归分析 结果显示,年龄、吸烟、术前卧床时间、D-D(阳性)及NPLMS是老年股骨转子间骨折术后发生下肢DVT的独立危险因素(P<0.05),见表3。

表3 老年股骨转子间骨折术后发生下肢DVT 影响因素的Logistic 回归分析
2.4 基于危险因素构建老年股骨转子间骨折术后发生下肢DVT 的Nomogram 模型 将年龄、吸烟、术前卧床时间(>7 d)、D-D(阳性)及NPLMS 这些变量作为预测因子构建Nomogram 模型,见图1。
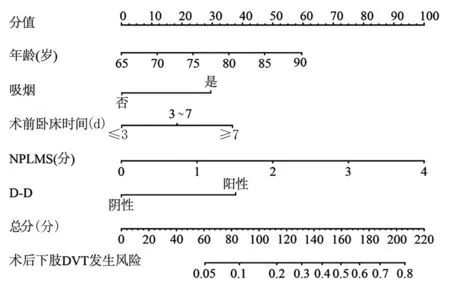
图1 预测老年股骨转子间骨折术后发生下肢DVT 的Nomogram 模型
2.5 Nomogram 的校正分析、ROC 分析及决策曲线分析 校正分析结果显示,一致性指数(concordance index,C-index)为0.879,见图2;ROC 分析结果显示,AUC 为0.882,见图3;当预测下肢DVT 发生风险阈值为0.06~0.78,Nomogram 模型提供显著临床净收益且收益程度均高于其他临床指标,见图4。
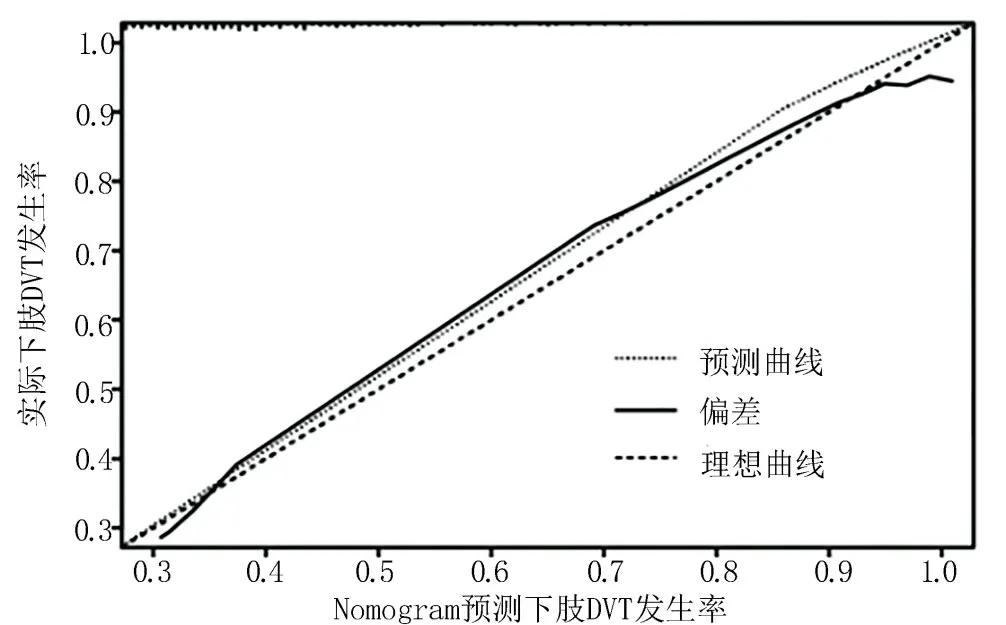
图2 Nomogram 的校正分析
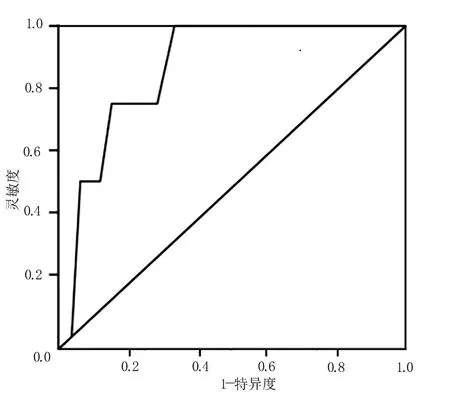
图3 ROC 分析
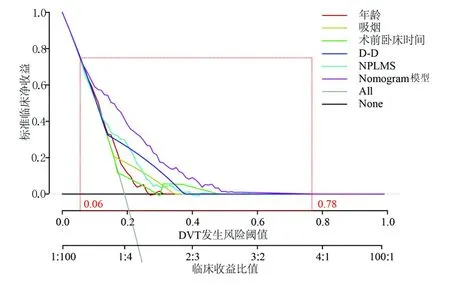
图4 决策曲线分析
3 讨论
有研究显示,6.1%~31.0%的老年髋部骨折病人会出现术后DVT[11-12]。本研究观察到315 例病人中有67 例病人出现术后下肢DVT,发生率为21.3%。临床实践经验表明,老年转子间骨折手术治疗病人中预防DVT 比治疗更为关键[13]。虽然影响DVT 的因素不仅限于凝血系统,但临床证据强调免疫系统也参与其中[14-16]。炎症反应可使机体进入高凝状态,促进血栓形成[15];血栓形成产物可诱发炎症反应,导致恶性循环[16]。因此,炎症反应在DVT 发病机制中起关键作用。基于这种联系,本研究旨在探讨临床常见炎症反应标志物NLR、PLR、LMR 及MHR 与老年转子间骨折术后发生下肢DVT 关系。ROC 分析结果显示术前NLR、PLR、LMR 及MHR 水平对术后下肢DVT 风险有较高预测价值。基于NLR、PLR、LMR 及MHR 开发出一种新型炎症反应标志物评分(NPLMS),同时证实该评分与术后DVT 风险相关;随后,基于NPLMS 评分结合其他风险变量构建一种直观、便于临床使用的Nomogram 模型来预测个体病人术后DVT 风险,通过内部数据集证实该模型预测效能较高。因此,本研究可为医护人员在评估老年人股骨转子间骨折术后DVT 风险时提供切实可行工具,并有助于识别高危病人。
血栓形成中,激活的内皮细胞表达P-选择素,其是一种介导白细胞和血小板附着的黏附分子;此外,内皮细胞分泌促炎细胞因子招募先天免疫细胞,特别是中性粒细胞和单核细胞[17]。而中性粒细胞在早期血栓中大量存在,在内皮附近形成簇或层,引起血小板黏附。激活单核细胞与受损内皮细胞相互作用,分泌促炎细胞因子和黏附分子,导致血栓形成。此外,淋巴细胞与单核细胞之间失衡,加剧炎症反应和血栓形成趋势[18]。事实上,炎症反应过程中淋巴细胞数目是减少的,这源于机体应激反应[19]。高密度脂蛋白通过抗炎和抗氧化作用改善内皮功能,也可通过调节单核细胞激活、黏附和转移来减弱血栓形成能力[20-21]。结合上述研究背景,可以得知NLR、PLR、LMR 及MHR 在DVT 相关炎症反应中的机制存在交叉且也存在区别。因此,单一的炎症反应标志物的使用似乎很难对DVT相关的炎症反应进行全面描述。因此,本研究对4 种炎症反应标志物进行ROC 分析,基于最佳截断值开发出NPLMS 评分,该评分反映每种炎症反应标志物所代表的炎症反应特点。进一步研究结果显示,NPLMS 评分的AUC 为0.770,高于NLR、PLR、LMR及MHR 的AUC,且也是老年转子间骨折术后发生下肢DVT 的独立危险因素。这些结果强调NPLMS 评分预测下肢DVT 风险的准确性优于单一炎症反应标志物。本研究也发现,年龄、吸烟、术前卧床时间、D-D是老年转子间骨折术后发生下肢DVT 的独立危险因素。大多数血栓预防指南将年龄增加纳入血栓栓塞风险评估中[22],DVT 发病率和流行率与年龄密切相关,从每年15 岁以下儿童每10 万例不到5 例增加到80 岁成人每10 万例450~600 例[23],其原因可能是老年病人机体功能障碍,包括活动能力降低、肌肉张力降低和血管损伤等所致[24]。吸烟会增加血液凝固性,损害内皮功能和纤维蛋白溶解,增加DVT 风险[25]。术前卧床时间越长,限制病人活动,可能导致淤血从而引起DVT[26]。尽管有些研究确定老年转子间骨折术后下肢DVT 发生的相关因素[27-28],但没有建立明确评分系统,使得这些相关因素难以在临床中被简易使用。
Nomogram 模型是在回归分析基础上,将多个预测因子进行整合,然后根据一定比例对预测因子进行打分,是一种直观、个体化预测风险的预后模型,被广泛运用于临床[29]。本研究基于NPLMS 评分结合年龄、吸烟、术前卧床时间、D-D 构建了一种新型的预测老年转子间骨折术后下肢DVT 风险的Nomogram 模型。重要的是,该模型中使用的预测因子在临床实践中很常见且易获得。内部数据集的校正分析结果显示C-index 为0.879;ROC 分析结果显示AUC 为0.882;当预测发生风险阈值为0.06~0.78,Nomogram 模型提供显著临床净收益且收益程度均高于其他临床指标。这些验证结果强调Nomogram 模型在老年转子间骨折术后下肢DVT 风险中具有很强的预测能力。根据该模型计算老年转子间骨折病人术后DVT 风险,一方面可以提高外科护士预防病人DVT 的临床意识,可提前采取体位[30]或冰敷[31]等预防策略降低DVT 风险;另一方面,可指导医生提前进行药物干预治疗。需要指出的是,这项研究突出炎症反应在DVT 中的作用,但目前抗凝治疗方案并不包含抑制炎症的药物。笔者认为联合选择性药物靶向免疫/炎症介质在预防DVT 中可能提供额外预防或治疗收益,但需要更多的临床数据或者动物实验来证实。
4 本研究的局限性
综上所述,本研究基于常见的临床炎症反应标志物开发出NPLMS 评分,并结合其他危险因素构建了一种新型Nomogram 模型,该模型可以用于指导老年转子间骨折术后下肢DVT 的一级预防决策。但本研究存在一定的局限性:首先,本研究入组对象来源于单一医疗中心,可能对Nomogram 模型预测性能及推广产生影响;其次,本研究中未对下肢DVT 位置进行细分,可能需要进一步的亚组分析;最后,因样本量问题,无法对Nomogram 模型进行外部数据集验证。

