小麦型饲粮中添加木聚糖酶对藏羊羔羊生长性能、瘤胃挥发性脂肪酸、细菌组成及肉质性状的影响
周 力,高占红,张峰硕,侯生珍,桂林生*
(1.青海大学农牧学院,西宁 810016;2.宁夏大学农学院,银川 750021)
伴随我国养羊业规模化持续推进,对能量(重点是玉米)饲料原料需求也日益增加。我国玉米资源稀缺,主要依赖进口且需求量极大。小麦价格低廉且蛋白质、氨基酸含量较高,是替代玉米的理想能量饲料资源[1]。使用小麦替代饲料中部分玉米,可缓解玉米短缺压力,增加养殖效益。但因小麦中含有较多非淀粉多糖(主要以阿拉伯木聚糖和β-葡聚糖较多)等抗营养因子,动物饲料中应用受限[2]。众所周知,木聚糖酶在高效水解木聚糖方面发挥重要作用。通过添加木聚糖酶可分解细胞壁释放包裹基中的养分,消除抗营养作用[3]。邢勇等研究发现在日粮中添加1×106U·t-1木聚糖酶可显著提高其生产性能[4]。靳愉琳研究以植物性蛋白原料为主,在日粮中添加木聚糖酶,结果发现木聚糖酶可提高草鱼生产性能,促进肠道生长,同时优化肠道微生物,增强对肠炎抵抗能力[5]。木聚糖酶还可改善仔猪肠道物理屏障与免疫屏障功能,促进体外营养物质消化率[6]。目前,木聚糖酶广泛应用于禽类、水产以及单胃动物研究中。现阶段有关木聚糖酶与反刍动物(尤其是绵羊)生长发育和胃肠道关系的报道较少。
瘤胃作为反刍动物独特的消化器官,内含丰富的细菌、真菌、原虫等微生物,可消化饲料中粗纤维,利用非蛋白氮(Non protein nitrogen,NPN)合成微生物蛋白(Microbial protein,MCP)[7]。微生物之间的相互作用对维持反刍动物瘤胃内环境平衡和降解饲料至关重要。饲粮组成是影响反刍动物瘤胃微生物生长的关键条件,酶制剂是重要因素之一[8]。挥发性脂肪酸(Volatile fatty acid,VFA)作为瘤胃微生物发酵降解产物,成分主要为乙酸、丙酸和丁酸等,为反刍动物提供能量,可维持瘤胃内环境稳态,促进机体发育[9]。添加外源木聚糖酶是否改变反刍动物瘤胃中挥发性脂肪酸比例以及影响瘤胃微生物区机理尚不明确。肌肉营养价值与其抗氧化能力是评价反刍动物肉质优劣重要指标[10]。因此,假设小麦型饲粮中添加木聚糖酶,可能通过影响高原型藏羊瘤胃微生物菌群结构改变肉质性状。
基于此,本研究拟以高原型藏羊为试验对象,采集瘤胃内容物与背最长肌,分析小麦型饲粮中添加木聚糖酶对育肥期藏羊生长性能、瘤胃挥发性脂肪酸、微生物菌群结构以及肉品质的影响,以期为外源酶制剂在绵羊生产中的合理应用提供理论参考。
1 材料与方法
1.1 试验设计
试验选取胎次一致、体重相近[(19.35±2.18)kg]且健康状况良好的2~3月龄高原型藏羊公羔60只,按组间体重无差异原则将其随机分两组,每组30只,每组5个重复,每个重复6只羊。其中一组饲喂含有小麦型饲粮(HW),另外一组在含有小麦型饲粮基础上添加0.2%木聚糖酶(EW)。试验持续100 d,饲养试验结束时,分别从每组中随机选择5只试验羊屠宰。
1.2 基础饲粮组成及饲养管理
试验期间,HW组试验羊饲喂含有小麦型饲粮(青海香咔梅朵饲料厂,营养水平见表1),EW组试验羊则在含有小麦型饲粮基础上添加0.2%木聚糖酶(湖北武汉新华扬生物股份有限公司,活性100 000 U·g-1)。试验分为两个阶段,第一个阶段为0~30 d(精料∶粗料=6∶4),第二个阶段为31~90 d(精料∶粗料=7∶3)。粗饲料由燕麦青干草+燕麦青贮组成(以干物质1∶1计)。所有试验羊分栏饲养,每天饲喂两次(08:00和17:30),自由采食与饮水,按照牧场常规管理作免疫、驱虫等处理。
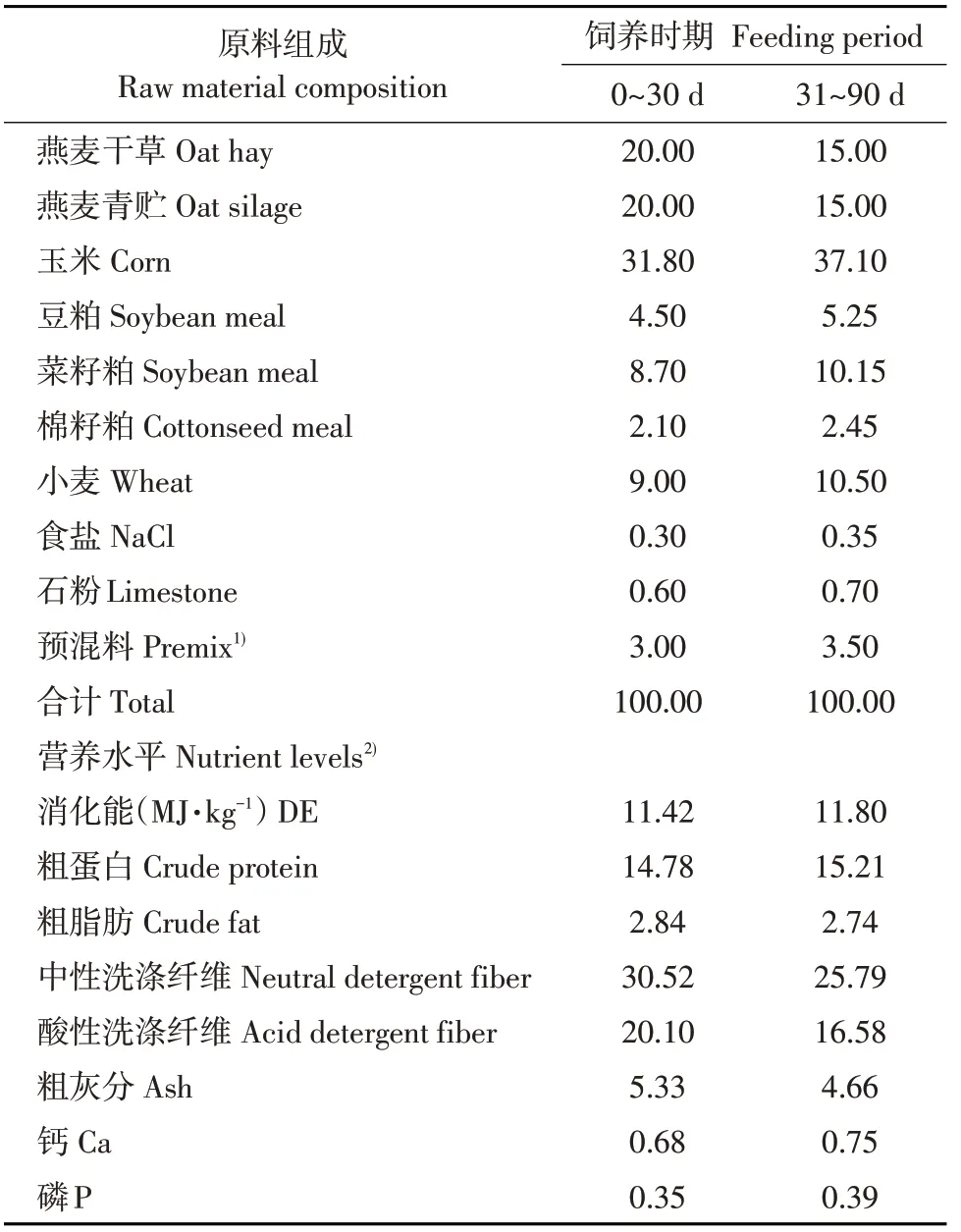
表1 基础饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of basal diets(DM basis) (%)
1.3 样品采集及处理
试验结束时,每组随机选择5只试验羊进行屠宰,迅速分离瘤胃,瘤胃液经4层纱布过滤后,将滤液分装于无菌冻存管中,迅速投入液氮速冻,采集背最长肌样品,剔除表面筋膜与脂肪,评定肉品质。
1.4 测定指标及方法
1.4.1 生长性能测定
试验开始与结束时对所有试验羊空腹称重,分别作为初始体重和终末体重。每日饲喂前准确记录投料量,同时定时收集剩料并称重,计算分析试验羊平均日增重(Average daily gain,ADG)、平均日采食量(Average daily feed intake,ADFI)和料重比(Feed to gain,F/G),相关公式如下所示:
平均日增重=(终末体重-初始体重)/试验天数;
平均日采食量=(投料量-剩料量)/试验天数;
料重比=平均日采食量/平均日增重。
1.4.2 挥发性脂肪酸
利用日本岛津(GC-2010 plus)气相色谱仪测定挥发性脂肪酸。
1.4.3 瘤胃微生物区系
选用DNA提取试剂盒(E.Z.N.A.®Stool DNA Kit)提取,并通过琼脂糖凝胶电泳检测DNA提取质量,同时采用紫外分光光度计对DNA进行定量。瘤胃液DNA扩增目的片段为V3+V4区,其扩增引物 序 列 为341F:5'CCTACGGGNGGCWGCAG3';805R:5'GACTACHVGGGTATCTAATCC3'。PCR扩增反应条件为:98℃30 s,98℃10 s,54℃30 s,72℃45 s,72℃10 min,4℃∞,共35个循环;PCR扩增反应体系为:Phusion Hot start flex 2X Master Mix 12.5 μL,Forward Primer 2.5 μL,Reverse Primer 2.5 μL,Template DNA 50 ng,补ddH2O到25 μL。将扩增得到PCR产物经2%琼脂糖凝胶确证。PCR产物由AMPure XT beads(Beckman Coulter Genomics,Danvers,MA,USA)纯 化,Qubit(Invitrogen,USA)定量。扩增子池用于测序,扩增子文库大小和数量分别利用Agilent 2100生物分析仪(Agilent,美国)和Illumina(Kapa Biosciences,Woburn,MA,美国)文库定量试剂盒作评估。NovaSeq PE250平台上进行排序。
1.4.4 肌肉营养成分
羊肉中水分含量检测参照GB 5009.3-2016《食品中水分的测定》;粗蛋白含量检测参照GB 5009.5-2016《食品中蛋白质的测定》;粗脂肪含量检测参照GB 5009.6-2016《食品中脂肪的测定》;粗灰分含量测定参照GB 5009.4-2016《食品中灰分的测定》。
1.4.5 肌肉抗氧化能力
超氧化物歧化酶(Superoxide dismutase,SOD)过氧化氢酶(Catalase,CAT)以及谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)活性,丙二醛(Malondialdehyde,MDA)含量以及总抗氧化能力(Total antioxygenic capacity,T-AOC)含量测定均按照相关试剂盒说明操作,试剂盒均购自江苏酶标生物有限公司。
1.5 数据处理与分析
试验结果以“平均值±标准差”表示。使用Excel 2019对原始数据进行初步整理,通过T检验进行分析,以P<0.05表示为差异显著。
2 结果与分析
2.1 小麦型饲粮中添加木聚糖酶对高原型藏羊生长性能的影响
藏羊生长性能结果如表2所示,两组间藏羊平均日增重、平均日采食量和料重比差异均不显著(P>0.05)。
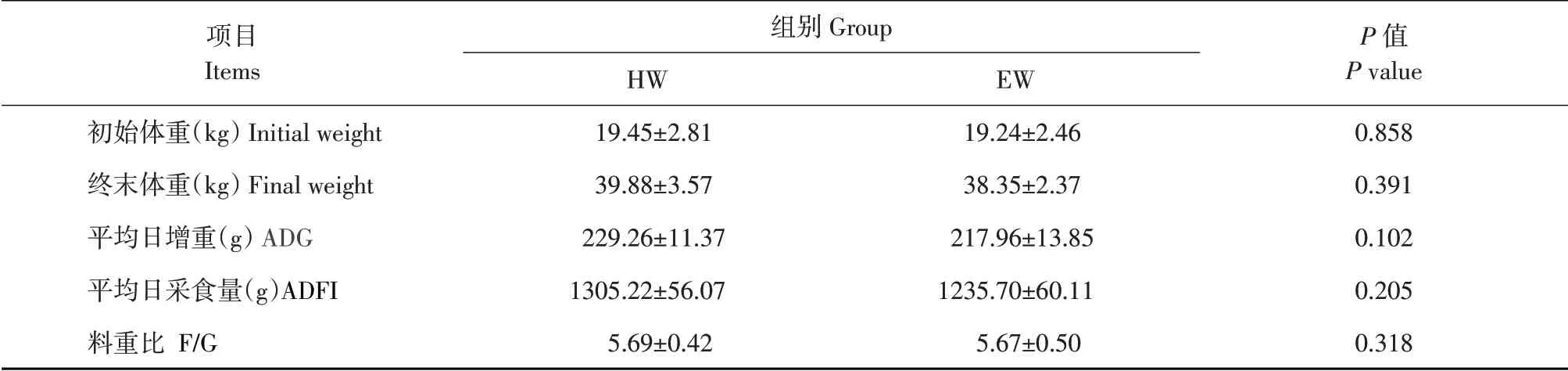
表2 木聚糖酶对藏羊生长发育的影响Table 2 Effects of xylanase on growth development of Tibetan sheep
2.2 小麦型饲粮中添加木聚糖酶对高原型藏羊瘤胃挥发性脂肪酸的影响
藏羊瘤胃挥发性脂肪酸结果如表3所示,两组间乙酸、丙酸、异丁酸、丁酸、异戊酸以及戊酸含量差异不显著(P>0.05)。说明木聚糖酶对藏羊瘤胃挥发性脂肪酸影响较小。
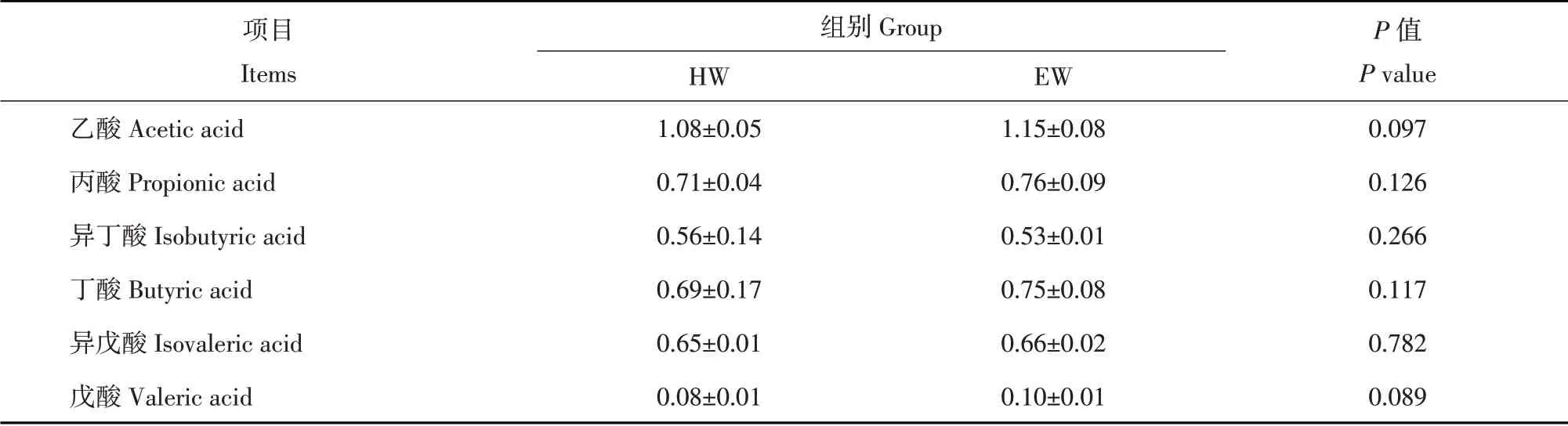
表3 木聚糖酶对藏羊瘤胃挥发性脂肪酸含量的影响Table 3 Effects of xylanase on the content of volatile fatty acid in rumen of Tibetan sheep (mmol·L-1)
2.3 小麦型饲粮中添加木聚糖酶对高原型藏羊瘤胃微生物菌落的影响
2.3.1 测序结果与质量评估
应用Illumina Mi Seq平台对试验羊瘤胃液内容物10个样本中16S rDNA的V3~V4区进行检测(见表4),结果共获得685 041条有效序列,所有样本Q30均在81.03%以上,GC含量也均在53.03%以上,说明测序结果良好,可用于下一步分析。
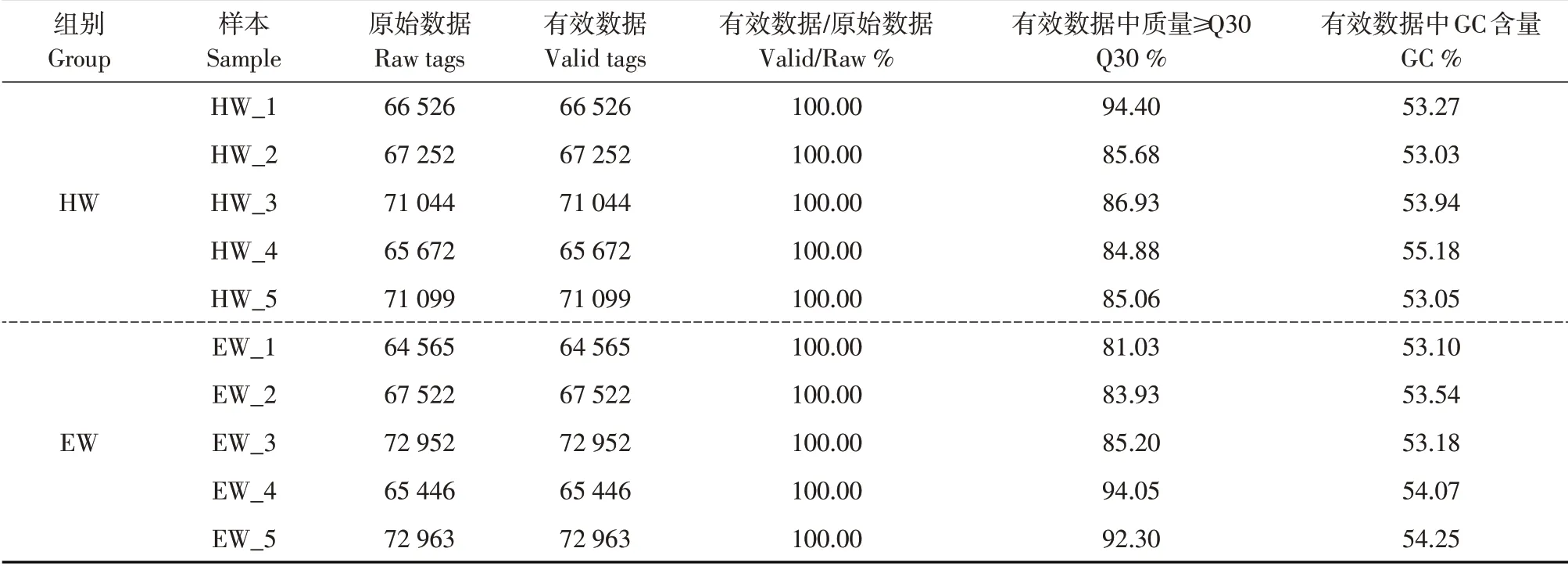
表4 测序有效数据统计Table 4 Statistics of valid sequencing data
2.3.2 韦恩图与稀释曲线
韦恩图(Venn figure)可直观表明不同组间有效序列聚类成OTU(Operational taxonomic unit)的情况。由图1A可知,基于相似性>97%原则,共获得5 397个OTU,两组间共有551个,其中EW组独有2 897个,HW组独有1 949个。稀释曲线(Rarefaction curve)可直接反映测序数据量合理性,间接反映样品中物种丰富度。由图1B可知,各样品稀释曲线趋于平坦,表明测序数据量渐进合理。
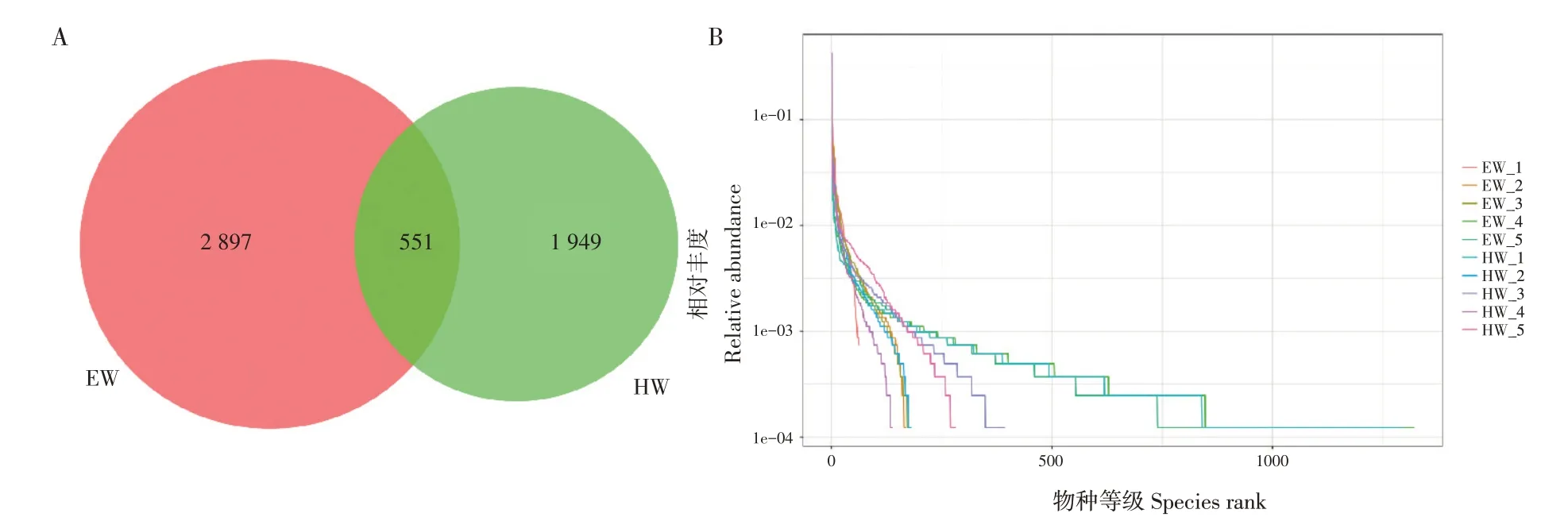
图1 韦恩图(A)与稀释曲线(B)Fig.1 Venn figure(A)and rarefaction curve(B)
2.3.3 Alpha多样性分析
Alpha多样性用于反映物种丰富度、均匀度及测序深度。由表5可知,所有样本OTU覆盖率均达98%以上,说明本次试验所建立文库能够覆盖样本中绝大部分物种信息。两组间指数Simpson、Shannon和Ace指数差异不显著(P>0.05),但HW组Chao1指数显著小于EW组(P<0.05),表明HW和EW组藏羊瘤胃菌群丰富度存在显著差异。
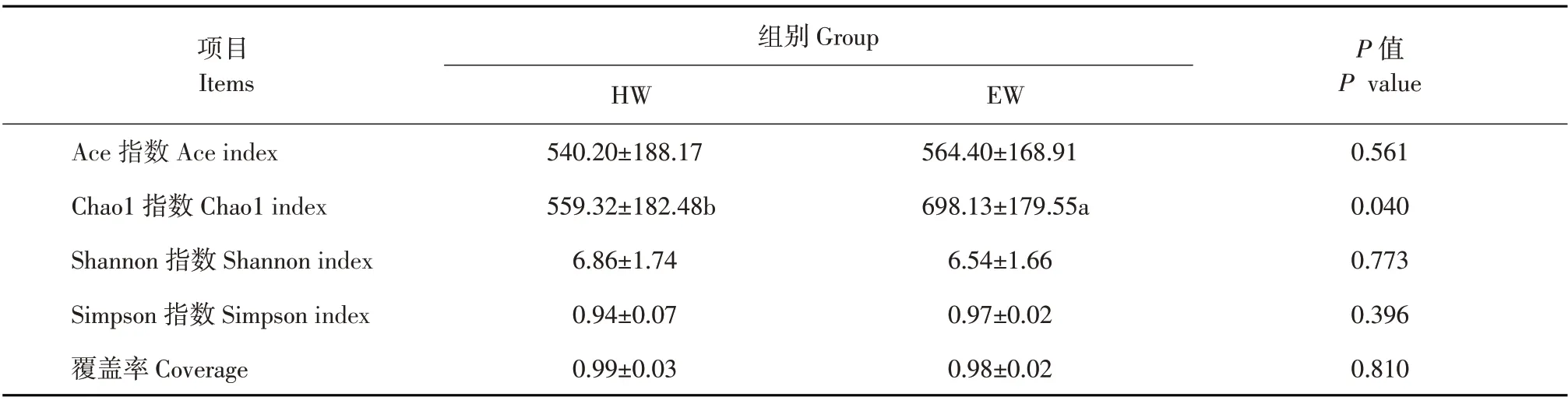
表5 Alpha多样性指数分析Table 5 Alpha diversity index analysis
2.3.4 门水平上细菌组成
在门水平,瘤胃主要物种组成丰度依次为厚壁菌门(Firmicutes,53.20%)、拟杆菌门(Bacteroidetes,34.43%)、变形菌门(Proteobacteria,8.29%)、未分类(Unclassified,1.05%)、髌骨细菌门(Patescibacteria,1.00%)。由图2可知,10个样品中优势菌群均以厚壁菌门、拟杆菌门及变形菌门为主,其中EW组拟杆菌门显著高于HW组(P<0.05),变形菌门则相反(P<0.05),厚壁菌门在两组中无显著差异(P>0.05)。
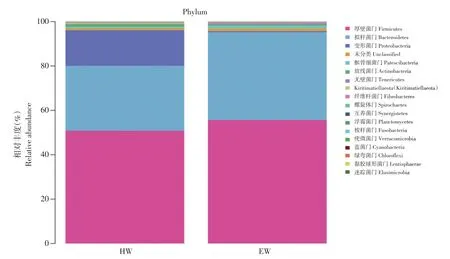
图2 门水平上细菌分布Fig.2 Distribution of bacteria at phylum level
2.3.5 属水平上细菌组成
在属水平,瘤胃主要物种组成丰度依次为普雷氏菌属_1(Prevotella_1,10.46%);瘤胃球菌科_NK4A214群(Ruminococcaceae_NK4A214_group,7.96%);F082_未分类(F082_unclassified,6.79%);解琥珀酸菌属(Succiniclasticum,6.39%);瘤胃球菌属_2(Ruminococcus_2,5.20%)等。由图3可知,10个样品中优势菌群均以普雷氏菌属_1、瘤胃球菌科_NK4A214群以及F082_未分类为主,且两组中普雷氏菌属_1、瘤胃球菌科_NK4A214群以及F082_未分类差异均不显著(P>0.05)。
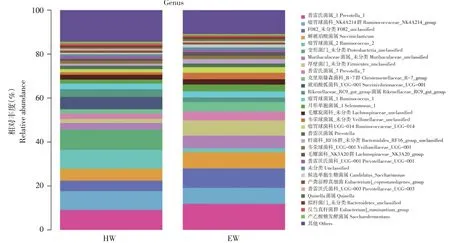
图3 属水平上细菌分布Fig.3 Distribution of bacteria at genus level
2.3.6 功能预测
基于PICRUSt2功能预测根据t-test差异检验,P<0.05阈值,同时功能数据库中丰度数据统计学上差异显著的功能(置信区间95%),可初步推测藏羊瘤胃菌群主要与D-fructuronate degradation(D-果糖醛酸降解)、L-methionine biosynthesis III(L-蛋氨酸生物合成III)、palmitate biosynthesis II(Bacteria and plants)(棕榈酸生物合成II(细菌和植物))等功能有关(见图4)。
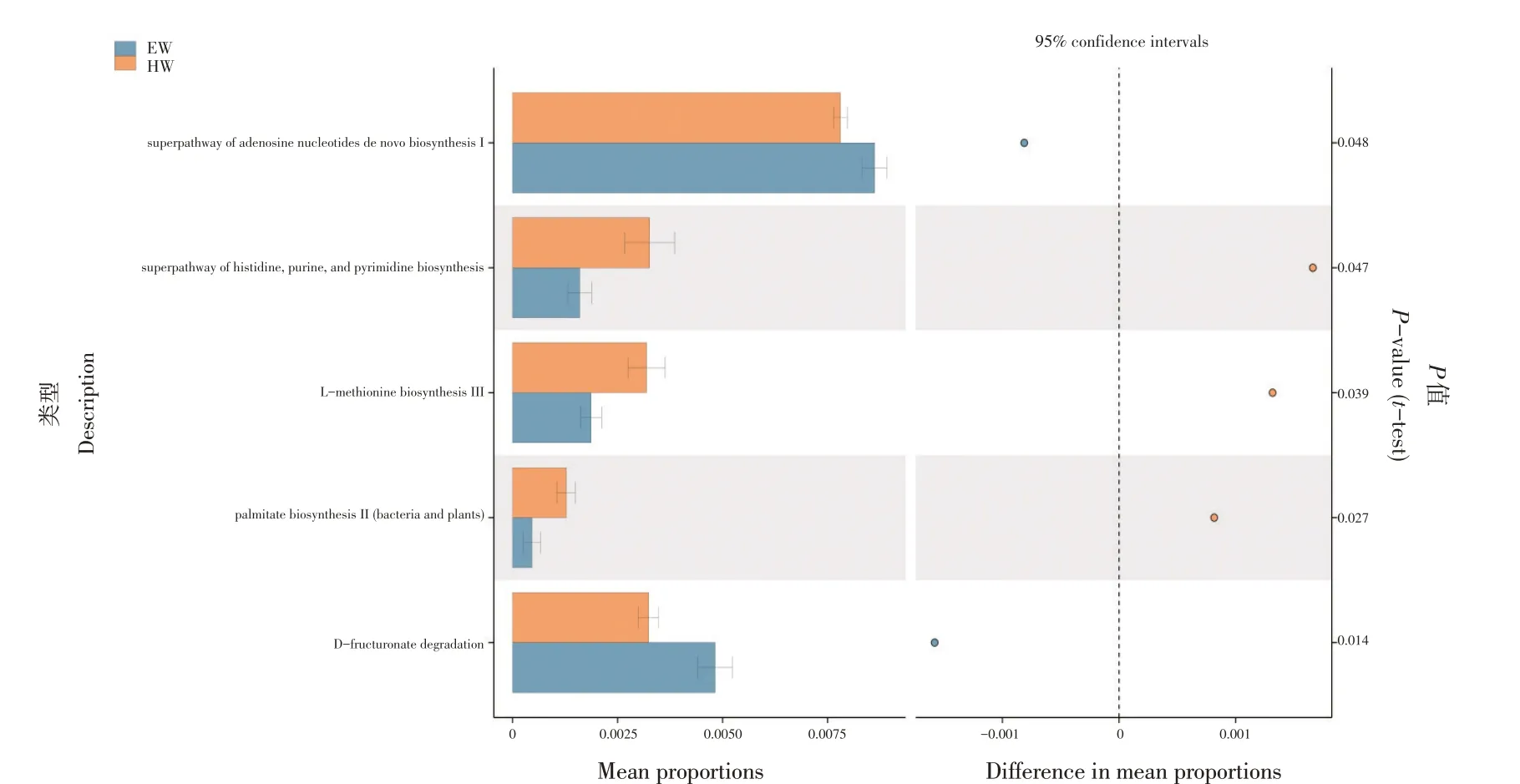
图4 KEGG功能预测Fig.4 KEGG function prediction
2.4 小麦型饲粮中添加木聚糖酶对高原型藏羊肉质特性的影响
藏羊肌肉营养分析结果如表6所示,两组间水分、灰分差异不显著(P>0.05),而HW组粗蛋白、脂肪则显著小于EW组(P<0.05)。
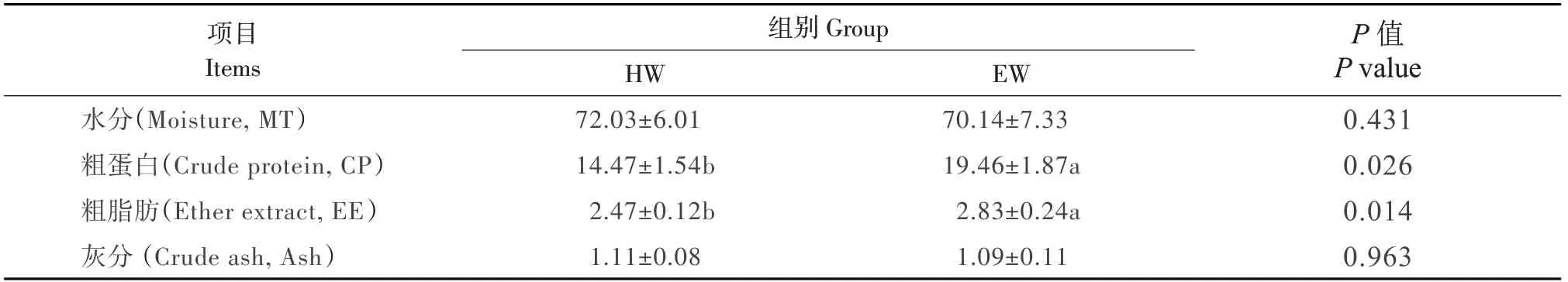
表6 木聚糖酶对藏羊肌肉营养成分的影响Table 6 Effects of xylanase on muscle nutritional component of Tibetan sheep (%)
藏羊肌肉抗氧化能力结果见表7。
由表7可知,两组间超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶活性及总抗氧化能力含量差异不显著(P>0.05),但EW组丙二醛含量却显著小于HW组(P<0.05)。
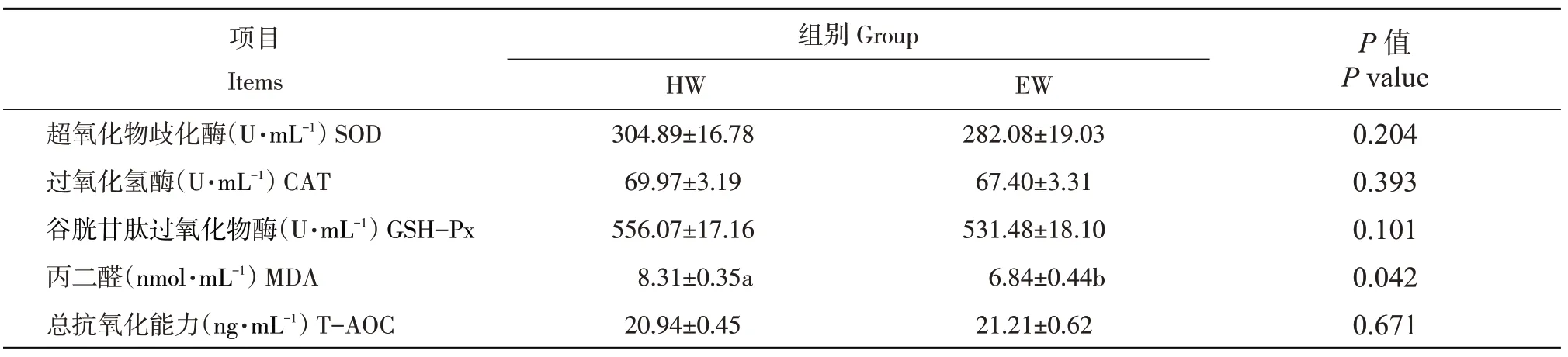
表7 木聚糖酶对藏羊肌肉抗氧化性能的影响Table 7 Effects of xylanase on muscle antioxidant performance of Tibetan sheep
3 讨论
3.1 小麦型饲粮中添加木聚糖酶对高原型藏羊生长性能的影响
木聚糖酶主要通过两种机制发挥作用,包括破坏细胞壁并释放细胞内营养物质、降低食糜黏度及促进食糜和酶混合[11]。Kiarie等研究发现,添加木聚糖酶可显著改善1~21日龄鸡体重和饲料转化率[12]。赵亚鹏等在饲粮中添加100 g·t-1木聚糖酶和寡糖复合物可降低蛋鸡小肠食糜黏度及pH,增强机体免疫机能,对其生产性能和蛋品质无显著影响[13]。Mejicanos等试验发现,在小麦与小麦-菜籽粕日粮中添加木聚糖酶可提高断奶仔猪营养物质消化率和食糜pH,但不影响其生长性能[14]。在本试验中,与HW组相比,EW组藏羊平均日增重与料重比均无显著差异,表明断奶羔羊饲料中添加0.2%木聚糖酶不显著,原因可能与动物品种、饲粮类型、添加剂量和饲养环境等有关,与Taylor等研究结果相似[15]。
3.2 小麦型饲粮中添加木聚糖酶对高原型藏羊瘤胃挥发性脂肪酸的影响
饲料中碳水化合物经瘤胃微生物降解生成大量挥发性脂肪酸,其含量变化直接评估反刍动物对养分的消化吸收能力,还可为机体活动提供70%~80%能量。挥发性脂肪酸主要有乙酸、丙酸、丁酸等[16]。其中乙酸通过三羧酸循环过程释放ATP为机体提供能量,丙酸作为葡萄糖合成前体物质,其含量较多时意味着反刍动物可得到更多能量用于生长[17]。丁酸在瘤胃吸收过程中,大部分转变为β-羟丁酸为动物肌肉提供能量来源[18]。从本试验结果看,两组间挥发性脂肪酸含量差异不显著,可能与木聚糖酶添加量不足未能充分降解小麦抗营养因子有关。本试验也发现藏羊瘤胃发酵后主要产生乙酸、丙酸和丁酸等。
3.3 小麦型饲粮中添加木聚糖酶对高原型藏羊瘤胃微生物菌落的影响
试验通过16S rDNA高通量测序技术可较好反映反刍动物瘤胃中细菌真实情况。当样本覆盖率高于97%时说明测序样本取样较充分[19]。本试验发现样本覆盖率高于98%,证实此次测序结果可真实反映藏羊瘤胃微生物区系。OTU代表反刍动物瘤胃菌群种类和数量,本试验从瘤胃液中共获得5 397个OTU,其中2 897个为EW组独有,1 949个为HW组独有,该结果表明在饲粮中添加0.2%木聚糖酶增加藏羊瘤胃细菌种类与数量。Alpha多样性指数中,Ace与Chao1指数反映微生物丰富度,Shannon与Simpson指数体现微生物多样性[20]。本试验中两组间Ace、Simpson和Shannon指数差异均不显著,但EW组Chao1指数显著大于HW组,进一步揭示小麦型饲粮中添加木聚糖酶可提高藏羊瘤胃微生物丰富度。
曾钰等研究表明,舍饲牦牛瘤胃优势菌门为拟杆菌门、厚壁菌门和变形菌门[21]。新生羔羊优势菌群为拟杆菌门、变形菌门和厚壁菌门[22]。本试验发现厚壁菌门、拟杆菌门和变形菌门是藏羊瘤胃液中三大优势菌群,与前人结论一致。本研究中,与HW组相比,EW组厚壁菌门、拟杆菌门相对丰度较高,其中拟杆菌门差异显著,说明添加0.2%木聚糖酶可明显促进藏羊瘤胃消化吸收能力。同时HW组变形菌门相对丰度显著高于EW组,进一步表明HW组瘤胃菌群结构稳定性比EW组差。
本试验结果表明,与HW组相比,EW组普雷氏菌属_1相对丰度提高。原因可能是木聚糖酶降解小麦细胞壁,消除其抗营养因子,释放养分,反刍动物瘤胃中需更多细菌进行分解。瘤胃球菌科_NK4A214群(Ruminococcaceae_NK4A214_group)是厚壁菌门一种,主要功能是降解纤维物质。本试验发现,两组间瘤胃球菌科_NK4A214群相对丰度差异不显著,提示饲粮中添加木聚糖酶未对藏羊瘤胃中瘤胃球菌科_NK4A214群产生明显影响。基于PICRUSt2功能预测,本研究初步推测D-果糖醛酸降解、L-蛋氨酸生物合成III、棕榈酸生物合成II(细菌和植物)为藏羊瘤胃主要通路。
3.4 小麦型饲粮中添加木聚糖酶对高原型藏羊肉质特性的影响
本试验结果表明,EW组粗蛋白含量显著高于HW组,提示在饲料中添加木聚糖酶明显提高藏羊肌肉中粗蛋白质含量,可满足人类对优质膳食的需求。适宜的脂肪含量可有效提高羊肉风味、嫩度以及多汁性等,过高或过低脂肪均对肉质产生不利影响[23]。一般情况下,脂肪含量在2.5%~3.5%时最为理想。本试验发现HW组粗脂肪含量显著低于EW组,说明木聚糖酶添加可明显促进藏羊肉脂肪沉积,增加口感。水分通常占羊肉70%左右,且水分含量与肉色、风味物质及嫩度等指标密切相关[24]。而粗灰分代表肌肉中矿物质与维生素的含量,本试验中,两组间粗灰分与水分含量差异均不显著,表明饲粮中添加木聚糖酶对舍饲藏羊肌肉中水分和粗灰分含量无不利影响。提示今后可通过在小麦型饲粮中额外添加0.2%木聚糖酶达到改善肉质的目的。
本研究发现,两组间过氧化氢酶、超氧化物歧化酶及谷胱甘肽过氧化物酶活性无显著差异,说明木聚糖酶对藏羊肌肉酶活性无显著性变化。总抗氧化能力是机体抗氧化能力的总体评价指标。从本试验结果看,两组间总抗氧化能力水平差异不显著。丙二醛可反映机体脂质过氧化程度,其含量越高说明氧化损伤越严重。本试验中,HW组丙二醛含量却明显高于EW组。推测可能是因木聚糖酶降解小麦型饲料中木聚糖,有利于促进养分消化吸收,减轻小麦抗营养作用,达到缓解机体氧化应激目的。由此可知,饲粮中添加木聚糖酶可明显抑制藏羊肌肉脂质过度氧化作用,减少氧自由基侵害。
4 结论
综上,在小麦型饲粮中添加0.2%木聚糖酶可明显提高藏羊瘤胃细菌丰富度,有效改善肉质特性,但对其生长性能和挥发性脂肪酸无显著影响。

