青蒿琥酯通过TLR4/NF-κB信号通路抑制人胃癌裸鼠移植瘤生长及对PCNA和ZNF139表达的影响Δ
刘晓蕾,马立东,张朵朵
(1.邯郸市第一医院老年病一科,河北 邯郸 056000; 2.邯郸市第一医院消化一科,河北 邯郸 056000; 3.河北省优抚医院内一科,石家庄 050062)
胃癌是我国死亡率居前3位的恶性肿瘤,极大地危害患者的生命健康。由于缺乏特殊临床表现,胃癌早期诊断率低,确诊时多为中晚期,该类患者手术治疗效果不佳,化疗敏感性低,5年生存率普遍<30%[1]。相较于西医治疗,中药可作用于胃癌发生、发展多个环节,具有多环节、多靶点的特点,同时不良反应小、耐药性低,是我国治疗恶性肿瘤的特色疗法。青蒿琥酯是中药青蒿中分离得到的抗疟疾有效单体青蒿素的衍生物,具有抗感染、抗疟、免疫调节和抗肿瘤等多种生物活性[2-3]。增殖、侵袭转移是胃癌演变过程中的重要步骤,也是造成患者预后差的主要原因,增殖细胞核抗原(PCNA)与DNA合成密切相关,在细胞增殖周期中作用关键;锌指蛋白(ZNF)家族成员对多种基因的转录调控发挥着重要作用。本实验以人胃癌裸鼠移植瘤动物模型为研究对象,分析青蒿琥酯对人胃癌裸鼠移植瘤生长及对PCNA和ZNF139表达的影响,探讨其可能的作用机制。
1 材料与方法
1.1 实验动物和细胞株
SPF级BALB/c裸鼠40只,8周龄,雌雄各半,体重(22±5) g,购自广东省医学实验动物中心,动物许可证号为SCXK(粤)2019-0035。适应性饲养1周,室温20~22 ℃,通风良好,自由饮水进食,12 h明暗交替。人胃癌细胞株SGC7901购自中科院上海细胞所。
1.2 仪器
CKX53型光学显微镜(日本Olympus公司);LF-31DS型琼脂糖凝胶电泳设备(北京龙方科技有限公司);MQ-PYZ-82型电热恒温培养箱[中科美其(北京)科技有限公司];Fluocycle型荧光定量聚合酶链反应(PCR)仪(上海科华生物工程股份有限公司)。
1.3 药品与试剂
注射用青蒿琥酯(桂林南药股份有限公司,国药准字H10930195,规格为60 mg);注射用顺铂(齐鲁制药有限公司,国药准字H37021358,规格为10 mg);氯化钠溶液(四川科伦药业股份有限公司,国药准字H20083400,规格为500 mL∶4.5 g);10%胎牛血清(FBS,澳大利亚Ausbian公司,货号为VS100TZ);RPMI 1640培养基(美国Thermo Fisher公司,批号为187256);Trizol Reagent(美国Invitrogen 公司,批号为18572)。
1.4 实验方法
1.4.1 细胞培养:人胃癌细胞株SGC7901接种于1640培养基(10%FBS),5%CO2、37 ℃和95%湿度条件下培养,每3 d换液1次,待细胞生长汇合时按1∶ 3传代,每周1~2次。经0.25%胰蛋白酶-0.02% EDTA混合消化液消化后收集对数生长周期细胞。
1.4.2 人胃癌裸鼠移植瘤模型建立:将收集的对数生长周期细胞按800 r/min离心(离心半径为13.5 cm)分离4 min,弃置上清液后配制为单细胞悬液(2×107个/mL)。无菌条件下接种于裸鼠腋下,剂量为0.2 mL/只,继续饲养1周观察状态。以裸鼠皮下出现直径约5 mm的结节为模型建立成功标准,40只裸鼠均建模成功,成瘤率为100%,
1.4.3 实验分组及干预方法:将40只建模成功裸鼠随机分为模型组、顺铂组、青蒿琥酯组和联合组,每组10只。顺铂组给予顺铂4 mg/kg,青蒿琥酯组给予注射用青蒿琥酯100 mg/kg,联合组给予顺铂4 mg/kg+注射用青蒿琥酯100 mg/kg,模型组给予等量0.9%氯化钠溶液。所有大鼠均瘤体内注射给药,给药体积为0.01 mL/g,每周给药2次,持续4周。
1.4.4 标本处理:停药次日称重,摘眼球取血,处死裸鼠,取瘤体,剥离中心坏死组织和周围结缔组织,分为4份,1份采用甲醛固定进行病理检测,2份以液氮快速冰冻后于-80 ℃保存待检,1份研磨成细胞悬液进行原代细胞培养。
1.5 观察指标及检测方法
1.5.1 一般情况观察:从药物干预开始直至停药,每日观察裸鼠食欲、活动度和精神状态等情况。
1.5.2 抑瘤作用观察:取各组裸鼠瘤体称重,计算抑瘤率=(模型组瘤体平均重量-干预组瘤体平均重量)/模型组瘤体平均重量×100%。
1.5.3 病理检测:固定后肿瘤组织常规石蜡包埋切片,采用苏木精-伊红染色法观察病理状态。石蜡切片经二甲苯、无水乙醇脱水后进行苏木素染色10 min,自来水冲洗;分化液分化30 s,温水浸泡5 min,伊红染色2 min;脱水、透明后封片,由病理科医师在光学显微镜下观察切片病理情况,每张切片选取5张无重复视野图像,采用盲式阅片,依据阳性细胞比例判定。
1.5.4 噻唑蓝法(MTT)检测原代细胞生长:将新鲜瘤体组织加入适量PBS溶液匀浆,移动细胞悬液至离心管,1 000 r/min离心(离心半径为13.5 cm)5 min后弃置上清液,以PBS溶液冲洗3次,接种细胞培养至培养基,37 ℃、5%CO2条件下培养;收集对数生长细胞,采用RPMI 1640培养基制成单细胞悬液,以5×104/mL浓度接种于96孔板,以实验分组进行分组,设置4个复孔,相同条件下培养48 h。完成后加入MTT溶液(5 mg/mL)20 μL,培养4 h;吸取各孔上清液后加入二甲基亚砜200 μL,震荡15 min后采用酶标仪检测吸光度(OD)值(490 nm),计算抑制率(IR)=(1-阳性孔均值/对照孔均值)×100%。
1.5.5 逆转录PCR检测PCNA、ZNF139、Toll样受体(TLR)4、髓样分化因子(MyD88)和核因子κB(NF-κB)的mRNA表达水平:-80 ℃条件下取肿瘤标本加入研磨器,加入Trizol试剂1 mL,冰上快速充分研磨;转移组织匀浆至EP管,静置15 min后加入氯仿200 μL,震荡充分混匀后静置15 min;4 ℃条件下以10 800 r/min离心(离心半径为13.5 cm)15 min;弃置上清液后加入75%乙醇洗涤,晾干沉淀后加入无RNA酶水溶解沉淀。取适量RNA和上样缓冲液混合后,1.5%琼脂糖凝胶电泳(40 mA,80 V)30 min,紫外透射仪下观察条带,检测RNA完整性;吸取样品1 μL,使用微量核酸蛋白检测仪检测浓度和纯度,-80 ℃保存。5 μg为总RNA模板,构建逆转录体系,合成cDNA,-20 ℃保存;以cDNA为米板,扩增目的基因。PCR反应条件为cDNA和上、下游引物1 μL,DEPC水7 μL,绿色体系10 μL。引物序列及PCR反应条件如下,(1)PCNA(326 bp),上游引物为5′-CGTCTGG GCAGTGCGGCTC-3′,下游引物为5′-TGCTC GCCGCAGTAC TGCT-3′;94 ℃、3 min,90 ℃、30 s,55 ℃、50 s,72 ℃、45 s,35个循环,72 ℃、5 min。(2)ZNF139(482 bp),上游引物为5′-CCGTCTGCTA GAGTGCGCATG-3′,下游引物为5′-GCTGACTCA GCGCTGACTCCG-3′;94 ℃、3 min,95 ℃、30 s,58 ℃、40 s,72 ℃、30 s,30个循环,72 ℃、5 min。(3)β-actin(540 bp),上游引物为5′-GTCCCCGGGG AGGCTA CCA-3′,下游引物为5′-CTCCGGC TTAAAGTGGCAGCCTTCC-3′;94 ℃、5 min,95 ℃、30 s,58 ℃、40 s,72 ℃、30 s,30个循环,72 ℃、5 min。获得PCR产物后进行凝胶电泳,条件同上,以β-actin基因为内参,采用凝胶成像系统分析软件扫描灰度值分析mRNA水平。
1.5.6 蛋白质印迹法检测PCNA、ZNF139、TLR4、MyD88和NF-κB相对蛋白表达水平:-80 ℃条件下取肿瘤标本加入RIPA裂解液,冰上充分裂解,4 ℃条件下以12 000 r/min离心(离心半径为13.5 cm)20 min;取定量上清液,采用BCA法测定蛋白浓度;总蛋白上样,10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶,每孔加入样品电泳后将凝胶转印至PVDF膜,以5%脱脂奶粉封闭;稀释蛋白抗体(1∶ 1 000)4 ℃孵育过夜,第2日用TBST冲洗PVDF膜,每次5 min,共3次;加入二抗后室温孵育1 h,TBST冲洗,每次5 min,共3次;膜上加入ECL显示液,凝胶成像系统曝光显色,记录内参条带和目的条带灰度值,以β-actin为内参分析蛋白表达水平。
1.6 统计学方法

2 结果
2.1 一般情况比较
药物干预期间,各组裸鼠均未出现死亡。模型组裸鼠瘤体长势明显,进水、进食均明显减少,运动量减少,精神状态差,有嗜睡情况。顺铂组和青蒿琥酯组裸鼠肿瘤生长速度慢于模型组,食欲较好,运动量一般,精神状态和反应能力影响较小,有轻微嗜睡情况。联合组裸鼠肿瘤生长速度最低,食欲、运动、精神和反应能力未见明显影响。
2.2 病理结果比较
模型组胃癌细胞核细胞核增大、深染,可见明显的病理性核分裂象和恶性增殖,细胞量大、生长旺盛,紧密排列;与模型组比较,顺铂组胃癌细胞出现不同程度的凋亡,病理性核分裂象和恶性增殖明显减少,细胞排列分散,密度明显较低,可见明显空泡;青蒿琥酯组胃癌细胞病理性核分裂象和恶性增殖较模型组明显减少,细胞密度高于顺铂组,排列分散;联合组胃癌细胞病理性核分裂象和密度均低于顺铂组和青蒿琥酯组,见图1。
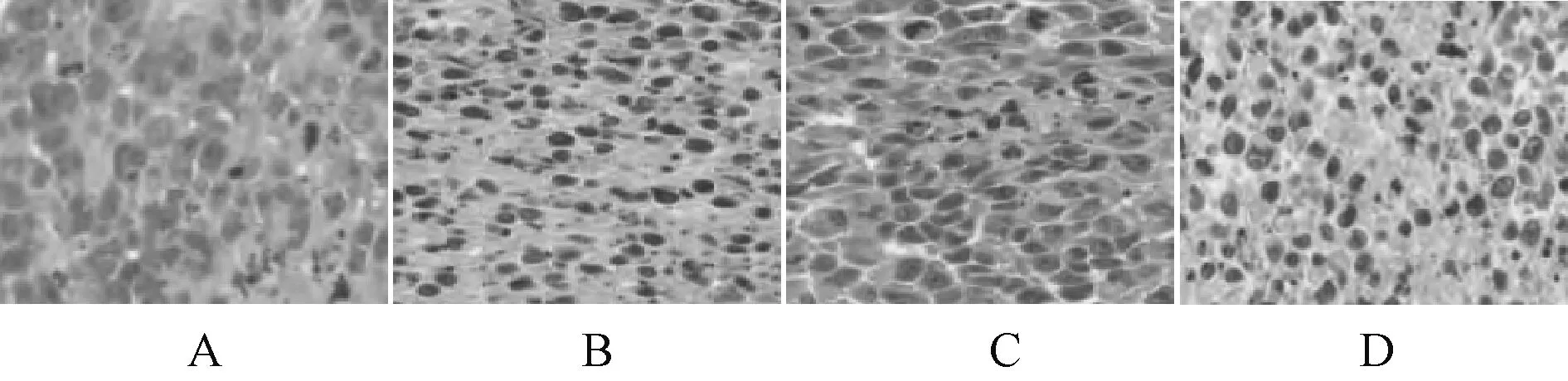
A.模型组;B.顺铂组;C.青蒿琥酯组;D.联合组A. model group; B. cisplatin group; C. artesunate group; D. combination group图1 病理结果比较Fig 1 Comparison of pathological results
2.3 移植瘤瘤重及抑瘤率比较
与模型组比较,顺铂组、青蒿琥酯组和联合组平均瘤重明显降低;与顺铂组比较,青蒿琥酯组平均瘤重升高,抑瘤率降低;联合组平均瘤重低于顺铂组和青蒿琥酯组,抑瘤率高于顺铂组和青蒿琥酯组,上述差异均有统计学意义(P<0.05),见表1、图2。

表1 四组裸鼠移植瘤瘤重及抑瘤率比较Tab 1 Comparison of tumor weight and tumor inhibition rate among four groups

图2 治疗4周后的裸鼠移植瘤瘤体Fig 3 Transplanted tumor in nude mice after 4 weeks of treatment
2.4 移植瘤细胞生长抑制率比较
培养48 h后,顺铂组、青蒿琥酯组和联合组的OD值均低于模型组;联合组的OD值低于顺铂组和青蒿琥酯组,抑制率高于顺铂组和青蒿琥酯组,上述差异均有统计学意义(P<0.05),见表2。

表2 四组移植瘤细胞生长抑制率比较Tab 2 Comparison of growth inhibition rate of transplanted tumor cells among four groups
2.5 PCNA、ZNF139、TLR4、MyD88和NF-κB mRNA表达水平比较
与模型组比较,顺铂组、青蒿琥酯组和联合组PCNA2、ZNF139、TLR4、MyD88和NF-κB mRNA表达水平均明显降低;顺铂组PCNA2、ZNF139、TLR4、MyD88、NF-κB mRNA表达水平低于青蒿琥酯组;联合组PCNA2、ZNF139、TLR4、MyD88和NF-κB mRNA表达水平低于顺铂组和青蒿琥酯组,上述差异均有统计学意义(P<0.05),见表3。

2.6 PCNA、ZNF139、TLR4、MyD88和NF-κB 蛋白表达水平比较
与模型组比较,顺铂组、青蒿琥酯组和联合组PCNA2、ZNF139、TLR4、MyD88和NF-κB蛋白表达水平均明显降低;顺铂组PCNA2、ZNF139、TLR4、MyD88和NF-κB蛋白表达水平低于青蒿琥酯组;联合组PCNA2、ZNF139、TLR4、MyD88和NF-κB蛋白表达水平低于顺铂组和青蒿琥酯组,上述差异均有统计学意义(P<0.05),见表4、图3。


A.模型组;B.顺铂组;C.青蒿琥酯组;D.联合组A. model group; B. cisplatin group; C. artesunate group; D. combination group图3 蛋白电泳图Fig 3 Protein electrophoresis
3 讨论
作为世界范围内常见的恶性肿瘤,胃癌的发生发展与多种因素相关。很多胃癌患者在发现时已经错过最佳治疗时期,不适用于内镜或手术治疗,主要采取以化疗为主的综合治疗方案。对于晚期胃癌的治疗,尤其是多线治疗时可选择的药物并不多,而且不良反应大,疗效也欠佳[4]。寻找高效、低毒的药物治疗意义重大。
近年来,多种体外研究结果表明,青蒿琥酯对胃癌细胞的抑制和杀伤作用较为明显[5-6]。本研究通过建立人胃癌细胞株SGC7901裸鼠移植瘤模型,探讨青蒿琥酯对于胃癌裸鼠移植瘤生长的影响,并分析其可能的作用机制。研究结果显示,经过青蒿琥酯干预的裸鼠瘤重明显减轻,抑瘤率和移植瘤细胞生长抑制率均明显提高,虽然效果不及顺铂,但也能证实青蒿琥酯可抑制裸鼠移植瘤生长。通过青蒿琥酯与顺铂联合应用发现,相较于顺铂单独用药,联合用药能够更好地抑制肿瘤生长。
TLR是一类天然免疫受体家族,能特异性地识别病原相关的分析模式,在激活天然免疫的同时能够调节获得性免疫,被认为是连接天然免疫和获得性免疫的桥梁,其相关的信号通路在免疫调节和炎症中具有重要的作用[7-8]。相关研究结果证实,TLR4/NF-κB通路相关分子在胃癌组织中的表达与胃癌恶性行为显著相关,猜测该通路是促进胃癌发生发展的重要机制[9]。MyD88在TLR信号转导通路中起着至关重要的信号转导作用,其在胃癌组织中高表达,可促进肿瘤细胞的增殖、侵袭和转移。TLR4能通过MyD88激活下游的NF-κB调节血管内皮生长因子以及IL-8等炎症因子的表达,参与炎症反应、细胞增殖和凋亡等过程的调控。本研究中,青蒿琥酯组裸鼠TLR4、MyD88和NF-κB mRNA水平均低于模型组,证实青蒿琥酯能够抑制TLR4/NF-κB通路激活。在干预的三组中,联合组TLR4、MyD88和NF-κB mRNA和相对蛋白表达水平最低,提示青蒿琥酯能够增强化疗药的效果,其机制可能与抑制TLR4/NF-κB通路激活有关,是治疗胃癌的重要方法。
在肿瘤侵袭转移过程中,多种基因发挥着调控的作用,ZNF家族与肿瘤的侵袭、转移具有密切的关系[10-11]。相关研究结果证实,ZNF139在胃癌组织高表达,推测其参与胃癌的发生、发展及胃癌多药耐药的调控[12-13]。赵群等[14]的研究结果显示,胃癌转移过程中ZNF139促进MMP-2、MMP-7的表达,使得肿瘤细胞具有更强的侵袭能力。李振兴[15]将重组质粒siRNA-ZNF139转染至胃癌移植瘤裸鼠肿瘤中,阻断其表达后发现肿瘤细胞增殖受到明显的抑制,说明ZNF139在肿瘤增殖中的地位十分重要。本研究结果显示,经过药物干预,肿瘤组织中的ZNF139表达明显降低,证实通过药物干预能够降低肿瘤组织中ZNF的表达,从而抑制肿瘤增殖,减缓肿瘤生长速度。作为影响肿瘤进展速度的重要因素之一,细胞增殖的无限性是恶性肿瘤的重要特征[16-17]。PCNA存在于细胞核内,蛋白质相对分子质量为3.6×104,与细胞DNA合成密切相关,且表达水平与DNA合成量变化呈现一致性[18]。测定细胞内PCNA水平可反映细胞增殖的水平,可作为评价细胞生长的重要指标[19]。有研究结果证实,PCNA在癌旁组织中表达较低,而在恶性肿瘤组织内具有高表达[20]。本研究结果显示,与模型组比较,各干预组PCNA mRNA水平明显降低,提示青蒿琥酯可以抑制PCNA基因表达,从而抑制肿瘤细胞DNA合成,影响肿瘤的生长。从联合组PCNA mRNA水平显著低于青蒿琥酯组(P<0.05)也可以看出,青蒿琥酯与顺铂联合应用具有协同趋势。
综上所述,青蒿琥酯可能通过抑制TLR4/NF-κB信号通路激活抑制人胃癌肿瘤细胞的生长,同时能下调PCNA和ZNF139的表达,影响肿瘤增殖、侵袭和转移。

