钆基无机纳米粒子磁共振造影剂设计的研究进展
赵 硕,周治国
(上海师范大学化学与材料科学学院,上海 200234)
0 引言
磁共振成像(MRI)因具有无电离辐射、多参数成像、高对比度成像等优点,已成为临床医学最常见的影像学检测手段之一.受制于当前的技术,部分条件下无法有效区分病变组织和正常组织之间的信号差异.为实现更精确的诊断,人们开始研究磁共振造影剂(MRI CAs).MRI CAs可以显著降低体内局部组织中水质子的弛豫时间,提高正常组织与患病组织的成像对比度.目前,临床上使用的纵向弛豫(T1)造影剂(即T1CAs)多为钆离子(Gd3+)螯合物.Gd3+螯合物在体内的循环时间较短且无特异性,长时间监测具有一定的局限性.此外,Gd3+螯合物的另一个缺点是其弛豫率相对较低,为更好满足MRI对比度的要求,需要高剂量注射造影剂.但高剂量注射会导致Gd3+部分游离,游离的Gd3+因与钙离子(Ca2+)半径接近从而进入细胞,对人体造成巨大危害.在各种类型的MRI CAs中,基于钆基无机纳米粒子(Gd IONPs)的MRI CAs有它们独特的电子、磁性和光学特性,易于细胞内的吸收和积累,并且具备出色的体内稳定性.Gd IONPs的高表面积也大大提高了它们的化学反应性,利于表面修饰,以上特点使Gd IONPs成为MRI CAs未来的设计方向之一.
1 T1造影剂作用原理
T1CAs能够显著缩短水分子的T1时间,从而产生造影效果[1-2].通常,T1CAs用于增加信号强度,所以T1加权MRI中的正对比度增强(产生的图像更亮).纵向弛豫率(r1)是造影剂缩短水分子T1时间的能力的评价方式,其定义为r1与CAs物质的量浓度的曲线的斜率[3]:

其中,r10表示没有造影剂的弛豫率,CCAs是造影剂的物质的量浓度(mmol·L-1).r1的值通常用于评估纳米粒子CAs的MRI弛豫率.
根据所罗门-布罗伯根-摩根理论[4-6](简称SBM理论),基于水质子与磁性金属中心之间的结合关系,可将r1分为3个部分,如图1所示:1)内界水rIS(Inner sphere),直接与金属离子结合的水分子;2)第二层水rSS(Second sphere),通过氢键与配体相互作用的水分子;3)外界水rOS(Outer sphere),扩散在造影剂周围的水分子.

图1 水质子与磁性金属中心之间的结合关系示意图
r1可以用式(1)表示:

因为第二层水分子的寿命非常短,且它们到金属中心的距离很长,rSS通常可以忽略不计.因此,r1可表示为:


其中,q是内界水的数目;CH2O表示水的物质的量浓度;T1m是水质子在内界的T1弛豫时间;τm是水分子在内界的结合时间;μ0是玻尔磁子常数;γI是质子的旋磁比;g是电子g系数;S是相应顺磁物种的自旋量子数;rGdH是内界水分子中的氢质子到金属离子之间的距离;τc是描述波动磁偶极子的相关时间;τR是造影剂的分子旋转相关时间;ωs是电子的拉莫尔角频率;μB是玻尔磁子,μB=9.274×10-24J·T-1.
根据式(3)~(5)可知,有3个主要因素影响造影剂弛豫率:1)q值;2)τR值;3)τm值(内球体中水交换率的倒数kex=1/τm).
2 Gd IONPs的r1影响因素
纳米技术的进步促进了纳米粒子CAs的快速发展.随着研究的深入,人们对如何设计高弛豫率的Gd IONPs有了更多了解.通常有3种方式会对Gd IONPs的弛豫率产生影响:形貌、尺寸以及表面修饰.此外,通过引入氧空位也可以有效提升弛豫率.
2.1 形貌
不同的形貌对纳米粒子会产生较大的影响,形貌的改变影响了纳米粒子表面积与体积的比值(S/V),从而改变纳米粒子的弛豫率,如图2所示.
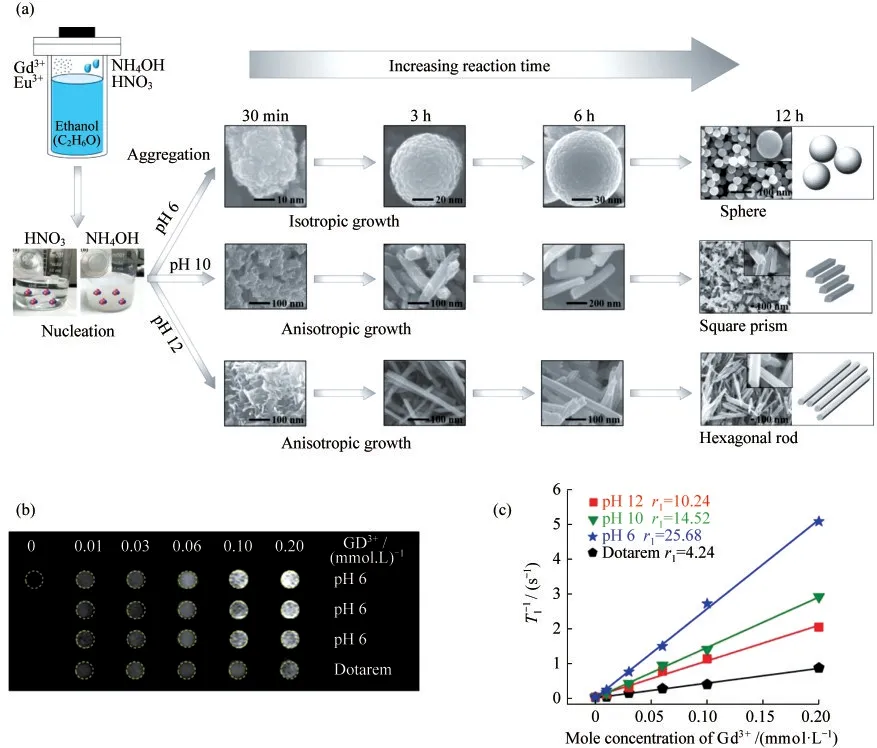
图2 不同形貌Gd2O3∶Eu3+的合成及其磁共振性质.(a)Gd2O3∶Eu3+在不同反应时间和pH值下的形貌形成过程示意图;(b)Gd2O3∶Eu3+@SiO2和商业造影剂(Dotarem)的T1加权成像;(c)不同pH值下Gd2O3∶Eu3+的Gd3+的弛豫率
PARK等[7]制备了具有球形、方形棱柱、六角棒形状的立方结构氧化钆:铕@二氧化硅(Gd2O3:Eu3+@SiO2)样品.其中球形结构弛豫率明显高于其他形貌.这种现象可以通过粒径、表面积和r1的关系来理解.在相同的Gd3+物质的量浓度下,大表面积的样品比小表面积的Gd3+多,暴露在表面加快了水质子的自旋弛豫过程.
ZHENG等[8]合成了具有菱形形状的均匀氟化钆纳米粒子(GdF3NPs).为解释形貌带来的影响,构建了2个几何模型(2D板和球体)分别代表GdF3NPs和传统的球体纳米粒子.将板模型的3个维度的尺寸与GdF3NPs成比例设置,并且将2个模型的体积归一化.将S定义为表面积,将a定义为流体动力学半径.根据计算,在原子数量保持不变的情况下,2D板结构的S/V值比球结构相对更高.同时,2D板结构也具有比第一个球体更长的τR.
2.2 尺寸
无机纳米粒子具备独特的尺寸依赖效应,通过控制成核和生长从而调控纳米粒子的尺寸,并对纳米材料尺寸与弛豫率的相关性进行研究,以此合理设计高r1值的Gd IONPs CAs.研究表明:NPs的S/V值是r1主要的影响因素,大部分情况下会随着NPs尺寸的减小而增加,从而提高r1,如表1所示.
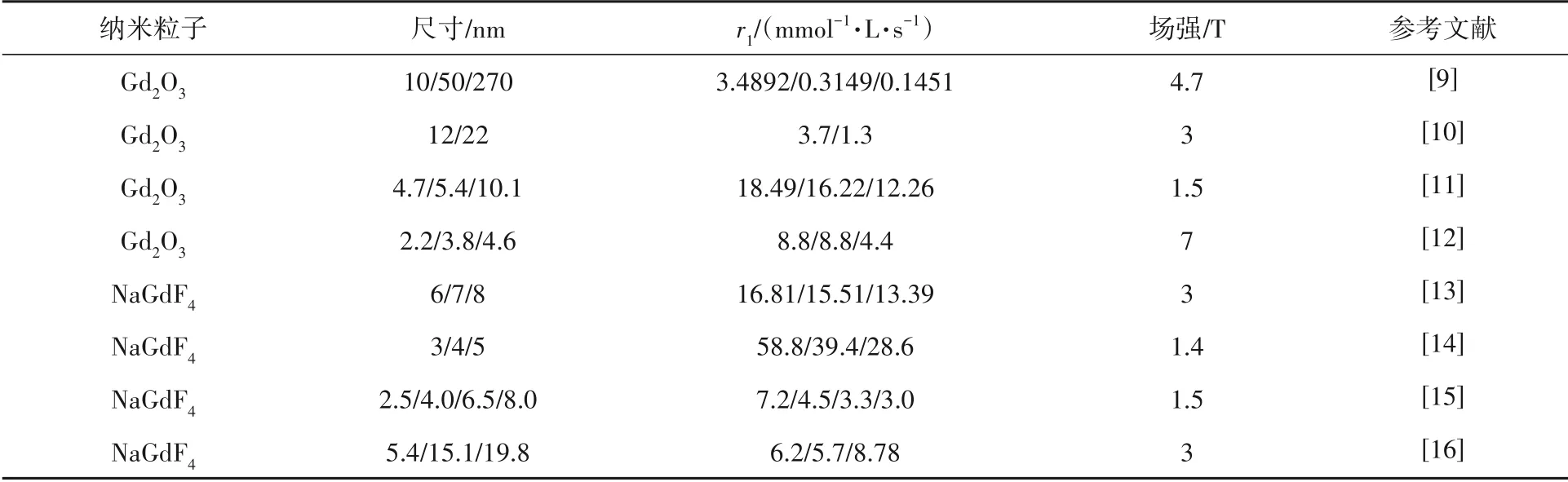
表1 部分Gd IONPs尺寸对弛豫率的影响
ZHOU等[9]通过改变反应体系中甘油的剂量调控纳米粒子的尺寸,并测量了不同尺寸Gd2O3纳米粒子的弛豫率.随着纳米粒子尺寸的增加,弛豫率也在不断下降.较大尺寸粒子中弛豫率的降低是因为纳米粒子的表面积减小,CHATURVEDI等[10-12]也证实了Gd2O3纳米粒子尺寸越小,弛豫率越高.
在氟钆酸钠(NaGdF4)纳米粒子中也观察到相同规律,JOHNSON等[15]通过调节反应条件合成了不同尺寸的NaGdF4纳米粒子,其r1也随尺寸下降而提高,并发现S/V值并非影响弛豫率的唯一因素.LIU等[13-14]也证实了弛豫率随NaGdF4纳米粒子尺寸下降而升高.HOU等[16]首次合成了超过10 nm的NaGdF4,但发现对应尺寸的纳米粒子弛豫率并非完全随尺寸减小而增大,虽然15.1 nm减小到5.4 nm时,弛豫率减小,但增加到19.8 nm时弛豫率却提升了,此时弛豫率因受τR影响而提升.
2.3 表面修饰
除尺寸影响之外,基于SBM理论的3种水分子(内界水、第二层水、外界水)可以通过表面修饰改变3种水分子对r1的贡献.对于Gd IONPs表面修饰,可以调整水质子到Gd IONPs表面的距离来增强水与中心顺磁离子的距离,从而产生比单独使用小分子造影剂更高的弛豫率.提高程度取决于有机配体的种类、尺寸、链长和官能团、碳材料的修饰以及二氧化硅(SiO2)壳的厚度,如表2所示.
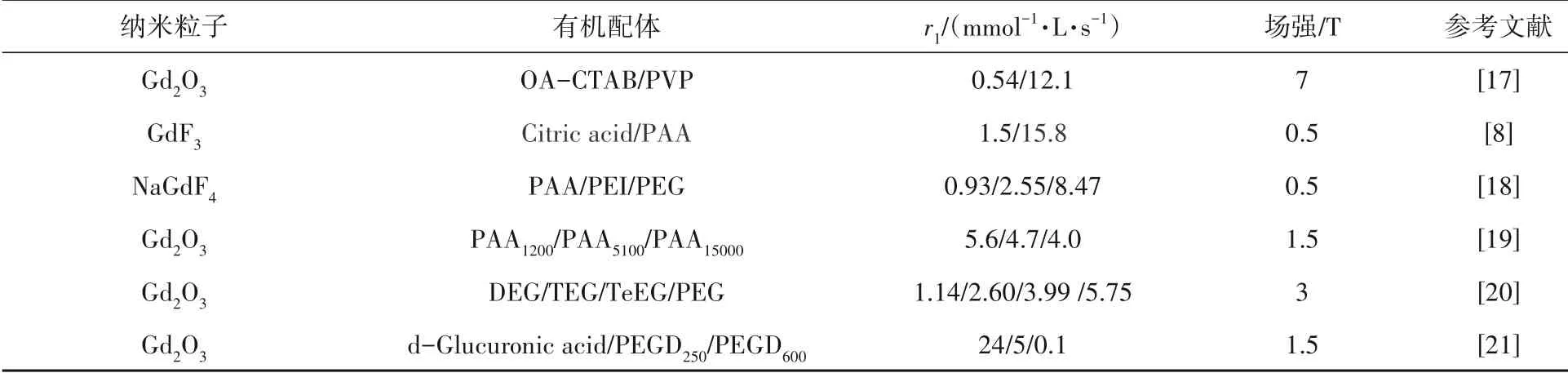
表2 部分有机配体修饰对Gd IONPs弛豫率的影响
2.3.1 有机配体修饰
FANG等[17]合成了油酸(OA)和十六烷基三甲基溴化铵(CTAB)共包覆的Gd2O3、亲水涂层的聚乙烯吡咯烷酮(PVP)包覆的Gd2O3.后者r1远高于前者,前者的低r1值是由于双层长疏水链阻止了水质子接近纳米颗粒核心中的Gd.对于后者,长PVP链向上滚动并将Gd2O3核心包裹在里面.PVP的每个单体中的极性C=O基团允许水分子穿过涂层,并与Gd2O3相互作用,从而提高了r1.
ZHENG等[8]利用柠檬酸与聚(丙烯酸)(PAA)2种有机配体改善GdF3水溶性,研究表明:PAA改性弛豫率远高于柠檬酸改性.柠檬酸分子链相对较短,改性后的纳米粒子具有较小的流体动力学半径.因此,它们的τR相对较小,不利于弛豫增强.
ZHENG等[18]选择带有羧基的阴离子PAA、带有氨基的阳离子聚乙烯亚胺(PEI)和带有醚基的中性聚乙二醇(PEG)改善NaGdF4的水溶性,PAA包裹的纳米粒子弛豫率明显高于其他2种聚合物.结合能(BE)计算表明,PAA对水分子的结合能力远强于PEG和PEI,有机配体的官能团对弛豫率也有显著影响.此外,还发现弛豫率与有机配体分子量并无正相关联系.
MIAO等[19]合成了2.0 nm Gd2O3,并用不同分子量的亲水性生物相容性聚丙烯酸改善水溶性.改善后的水溶性纳米粒子粒径随分子量的增加而增加,r1随着粒子半径增大而减小.造成这一现象的原因是表面Gd(Ⅲ)和水质子之间的磁偶极相互作用,随着流体动力学直径的增加而减弱.
GULERIA等[20]合成了表面包覆有二甘醇、三甘醇、四甘醇和PEG的Gd2O3纳米粒子.合成纳米颗粒的尺寸与多元醇的链长呈线性相关,并随链长增加而增大,弛豫率也随之增长.同时也证实了弛豫率依赖于涂层表面的亲水性,对于亲水性更高的PEG涂层,观察到最高的MRI对比度增强.
KIM等[21]选择d-葡萄糖醛酸、PEGD-250和PEGD-600 3种配体探究了超小Gd2O3纳米粒子的配体大小依赖性,发现配体尺寸越小弛豫率越高.
2.3.2 碳修饰
KUANG等[22]将Gd2O3纳米颗粒装载到介孔碳纳米球(OMCN)中制备了Gd2O3@OMCN,Gd2O3@OMCN的弛豫率远高于Gd-DTPA,OMCN的孔径(2.8 nm)适合限制超小Gd2O3纳米粒子(2.6 nm)的旋转和水分子的扩散,因此Gd2O3@OMCN弛豫率提升明显,如图3所示.

图3 Gd-DTPA,Gd2O3,Gd2O3@OMCN,Gd2O3@OMCN-PEG和Gd2O3@OMCN-PEG-RGD在0.5 T下的(a)弛豫率及(b)不同浓度下的黑白信号图像
YUE等[23]在水溶液中合成了碳层包覆(使用葡萄糖对碳层进行修饰)的超小氧化钆(Gd2O3@C)核壳纳米粒子(Gd2O3@C NPs),其具有优异的胶体稳定性、非常高的r1值(16.26 mmol-1·L·s-1).由于碳表面含有来自葡萄糖的羟基,可以与其周围水分子相互作用,从而提高弛豫率.
2.3.3 SiO2修饰
CHEN等[24]研究了致密二氧化硅壳(d-SiO2)和中孔二氧化硅壳(m-SiO2)及其厚度对基于Gd3+的上转换纳米粒子(UCNP)的MRI弛豫的影响,如图4所示.研究结果表明:对于m-SiO2其壳厚并不影响弛豫率;对于d-SiO2其壳厚影响弛豫率的变化.造成该现象的原因是SiO2修饰的UCNP主要受外界水扩散的影响,水分子在介孔通道中的扩散不受m-SiO2壳层厚度增加的影响;不存在大孔道的d-SiO2壳层中水分子的扩散会受到壳厚的限制,导致其更长的扩散时间,从而影响弛豫率的变化.

图4 不同厚度的m-SiO2和d-SiO2修饰的上转换纳米粒子(UCNP)对弛豫率的影响.(a)用m-SiO2和d-SiO2修饰UCNP-1的示意图;(b)不同厚度的UCNP-1@m-SiO2的透射电子显微镜(TEM)图;(c)不同厚度的UCNP-1@d-SiO2的TEM图;(d)r1和横向弛豫率(r2)与m-SiO2壳层厚度的关系图;(e)r1和r2与d-SiO2壳层厚度的关系图
YIN等[25]设计并制备了均匀且单分散的核壳SiO2Gd2O3纳米颗粒(CSSGNPs),其具有90 nm的核和1.5~20 nm的可控壳厚度,其T1值比T1造影剂:马根维显(Gd-DTPA)大1.8~7.3倍.研究表明:核壳纳米粒子的弛豫性与壳层厚度成反比关系.核壳纳米颗粒的S/V值较大,对其弛豫增强起着主导作用;Gd3+与水质子之间的距离也有助于弛豫率的变化.
2.4 氧空位
最近,有研究表明可以通过氧空位实现弛豫率的提升,其原理为表面氧空位通过将水分子的氧原子与Gd3+结合使材料与更多的水分子接触从而提高弛豫率,如图5所示.

图5 0.5 T下紫外线照射对GdTi-SC NPs弛豫率的影响.(a)GdTi-SC NPs溶液在3个紫外光处理/暗处理(UV/Dark)循环期间的T1变化;(b)不同条件下T1加权的MRI;(c)0.5 T不同条件下的r1;(d)GdTi-SC NPs表面的光诱导超亲水辅助(PISA)效应示意图
LIU等[26]通过顺序生长方法,并涂有柠檬酸钠,合成了亲水性Gd掺杂二氧化钛(TiO2)椭圆形纳米粒子(GdTi-SC NPs)(如图5所示).这些NPs在紫外线照射后r1显著增加(35%).在紫外线照射下,GdTi-SC NPs表面会形成局部超亲水区域(PISA效应).这种变化增加了水分子在内球和第二球中的有效配位数和驻留时间,以及水分子在外球中的扩散时间,提高顺磁弛豫(PRE)效率,并导致r1升高.
NI等[27]合成了掺杂Gd3+的钠钨青铜(NaxWO3)后经过PEG水溶性改善的PEG-NaxGdWO3纳米棒,PEG-NaxGdWO3纳米棒的高r1归因于氧空位与Gd3+结合的水分子中的氧原子结合,从而导致内界水(q)分布增加.在低氧空位浓度下,上述相互作用减弱,导致弛豫性降低.
SHAO等[28]开发了Gd掺杂二氧化铈(CeO2∶Gd)纳米粒子作为CAs,CeO2∶Gd纳米粒子表面的晶格氧空位,可以结合大量水分子以提高r1值,从而实现出色的动态对比度增强灌注加权成像性能,用于测量微血管通透性.
3 总结与展望
临床上使用的T1造影剂Gd-DTPA在体内的循环时间较短、弛豫率较低且Gd3+容易游离,易对人体造成巨大危害,而Gd IONPs合成方法简单且可控,并具备良好的生物相容性,可以更好地解决以上问题.本文作者总结了影响Gd IONPs CAs弛豫率的因素,在设计Gd IONPs时应选择适当的形貌、合理的尺寸、合理的修饰方式(选择不同的修饰方式时使用更佳的修饰条件),以及引入氧空位等,通过调整相关设计方法,未来Gd IONPs CAs在生物医学领域将迎来更广阔的发展空间.

