适应性设计随机对照临床试验
杨凯璇,周齐,姜英玉,谷鸿秋
随机对照临床试验作为医学研究中效应评价的金标准,为医疗研究的进步做出了巨大贡献。传统的随机对照临床试验根据“研究设计-执行-分析”三步走的策略进行,这种策略直观且清晰,但缺乏必要的灵活性。与之相反,适应性设计增加了一个“审视-调整”的循环环节,形成“研究设计-循环(执行-审视-调整)-分析”策略,从而改善了研究的灵活性[1]。
适应性设计是提高随机对照临床试验效率的一种手段,试验的参与者和未来的患者均有可能受益,同时可降低成本,提高发现真实受益干预措施的可能性[2]。本文将重点从历史渊源、基本概念、设计类型、设计特点、案例解读、统计分析及报告规范等方面对适应性设计进行简要介绍。
1 历史渊源
1952年,美国数理统计学家Herbert Robbins首先提出成组序贯设计,引入适应性设计这一思想。20世纪60年代,众多统计学家将贝叶斯方法多阶段设计引入适应性设计中。21世纪初,人们发现生物医学研究支出的增加并没有提高药物/临床研究的成功率。因此,美国食品药品监督管理局(Food and Drug Administration,FDA)于2004年启动了关键路径计划倡议[3],以探明可能原因并寻求解决方案,希望该倡议能够提高制药或临床研究的效率以及成功的概率。2006年,FDA发布了一份关键路径机会列表,以期减小生物医学新发现的快节奏与这些发现转化为治疗的慢节奏之间的差距。这份机会列表包含6个方面的主题,其中就包括适应性设计。自此,适应性设计这一临床试验设计方法获得了制药行业和学术界的广泛关注和讨论。
为了更好地监管、指导适应性设计临床试验,不同国家的监管部门相续发布了相关的指导文件。欧洲药品管理局于2007年发布了反思临床试验中适应性设计的方法学问题的文件,并于2008年和2009年与欧洲制药工业协会联合会共同组织了两次关于“验证性试验中的适应性设计”的研讨会[4]。2010年,FDA起草了关于药物和生物制品的适应性设计监管文件,并于2019年正式发布[5-6]。2016年,FDA还发表了医疗器械临床研究的适应性设计指南[7]。我国的国家药品监督管理局药品评审中心也于2020年正式发布了《药物临床试验适应性设计指导原则》的征求意见稿[8]。
2 基本概念
关于适应性设计的概念,不同的学者、机构有不同的定义。2005年,杜克大学的生物统计学教授周贤忠将适应性设计定义为一种在试验开始后允许试验程序或统计程序做适应性调整,而不会破坏试验的有效性和完整性的设计[9]。2006年,美国药品研究与制造商协会将适应性设计定义为在不破坏试验的有效性和完整性的前提下,利用积累的数据来决定如何修改研究各个方面的研究设计[10]。2010年2月,FDA发布的适应性设计临床试验指南草案中,适应性设计被定义为一种允许基于对研究对象的数据分析(通常是期中数据),对研究设计和假设的一个或多个特定方面进行前瞻性、有计划地修改的研究形式[5]。
虽然,不同的学者、机构对适应性设计的具体定义有所差异,不过其背后的涵义都大同小异。其中,有两点共同元素值得注意:一是所有的调整都是计划性调整,需要事先规定;二是所有的调整不能破坏试验的有效性和完整性。
3 设计类型
适应性设计既适用于探索性临床试验,也适用于确证性临床试验。探索性临床试验的适应性设计主要是为了确定安全的有效剂量或剂量-反应模型,将更大比例的受试者分配到表现良好的治疗组,减少表现不佳治疗组的参与者数量。此外,适应性设计还可以评估比非适应性设计更大的剂量范围,从而为确证性研究阶段选择更有效的剂量。
在确证性试验中,根据适应性设计对试验累积数据所做的分析,对正在进行试验的未来实施步骤做出预先计划性的更改,与此同时不降低结论的统计学效度。具体包括以下几种类型。
(1)适应性随机化。适应性随机化分为协变量适应性随机和反应变量适应性随机。协变量适应性随机是根据试验组中已入组受试者的协变量和分组信息动态决定下一例受试者的组别,以保证均衡处理组间关键协变量因素。反应变量适应性随机的基本思想是基于前期受试者的处理结果,将试验后期受试者分配到效果较好的组别,尽可能地让受试者受益。适应性随机化设计在样本量相对较小的试验或短期结果的试验中有更好的应用价值,但不适用于治疗时间相对较长的大型试验[11]。
(2)样本量再估计。样本量再估计指预先设定利用累积的试验数据重新计算样本量,以保证最终的统计检验能达到预先设定的目标,以解决初始样本量计算基于历史参考数据或信息不够充分从而导致的样本量估算不够准确的问题。样本量再估计可以采用基于总体数据的盲法,也可以采用基于变异大小的非盲法。非盲态下,可知晓干预效应,可以依据干预效应及变异大小重估样本量,因此需处理Ⅰ类错误膨胀。在盲态下,无法知晓干预效应,只能依据变异大小重估样本量,因此对Ⅰ类错误没有影响。
非盲态下样本再估计的公式为:
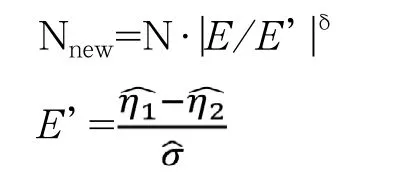
其中,N为初始估计的样本量,Nnew为重新估计的样本量,δ为任一指定常数,E为预估的效应大小,E’为基于以观察数据的效应大小,、、分别表示试验组处理效应大小、对照组处理效应大小及两组共同的标准差[12]。
盲态下样本再估计的公式为公式为:
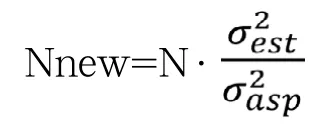
其中,N为初始估计的样本量,Nnew为重新估计的样本量,为预期的处理效应总体方差,为试验进行中累计的效应的总体方差[12]。方差的估计可采用EM算法把已观察的n个受试者的处理组别视为随机缺失,E步骤计算第i个受试者在给定的主要疗效指标观察值的情况下,被分到试验组的概率。M步骤依据E步骤的条件概率更新试验组别,进一步计算各组均数、总体方差的极大似然估计。不断迭代直到各组均数,总体方差收敛。
更多关于本量再估计的方法,策略及注意事项,请见Wang[13]、Lai[14]等学者的阐述。
(3)适应性成组序贯。适应性成组序贯是最常用的适应性设计,指方案中预先计划在试验过程中进行一次或多次期中分析,依据每一次期中分析的结果做出后续试验的决策。可在期中分析时根据事先设定的规则因有效、无效、安全性而提前终止,提高了效率并且更符合伦理[15-16]。
(4)劣效组舍弃/优效组加入。劣效组舍弃/优效组加入是一种多阶段设计,可根据上一阶段结果决策舍弃劣效组/修改治疗组/增加治疗组,在Ⅱ期临床试验中有重要作用,为后期试验找到合适的剂量和给药频率。
(5)适应性剂量反应。适应性剂量反应通常用于早期临床开发,以确定最大耐受剂量。传统试验常用的“3+3”设计,患者需要经历多个治疗周期且可能在多个周期中经历毒性事件[16]。近年来,研究者们提出了新的适应性设计方法用于早期识别最大耐受剂量,以加速剂量发现试验。适应性剂量反应一般使用连续重估法结合贝叶斯方法,根据从试验中收集的累积数据,持续评估剂量-反应关系。然后将下一个进入试验的患者分配到潜在的最大耐受剂量组[17-19]。
(6)生物标志物适应性设计。生物标志物适应性设计通常用于探索性研究,指结合适应性临床试验设计的生物标志物试验[19]。可用于识别对试验治疗作出反应的患者群体,识别疾病的自然病程,早期检测疾病及辅助开发个体化药物。
(7)适应性治疗转换。适应性治疗转换指允许研究者在有证据表明初始治疗缺乏疗效,疾病进展或安全问题的情况下,将患者的治疗从初始分配转换为替代治疗。出于伦理考虑,适应性治疗转换在肿瘤临床试验中较常见[20]。
(8)适应性假设检验。适应性假设检验指根据中期分析结果修改假设,但基于累积数据修改正在进行的临床试验的假设会对Ⅰ类错误率产生影响。包括由单一假设到复合假设/多个假设,原假设与备择假设预先计划的切换以及主要研究终点和次要终点之间预先计划的切换。
(9)无缝衔接(Ⅰ/Ⅱ或Ⅱ/Ⅲ)。无缝衔接指将两期试验(Ⅰ期/Ⅱ期或Ⅱ期/Ⅲ期临床试验)无缝连接,在前期试验结束时做剂量选择,并将所选剂量用于后期试验。相比常规独立的探索性和确证性研究,适应性无缝剂量选择可缩短试验间隔、减少总样本量、提高试验效率[21]。
(10)多重适应性设计。联合采用上述多种适应性调整方法即为多重适应性设计。
4 适应性设计的特点
适应性设计具有预先设定和基于累积数据的自我学习的特点。其优点包括①具有灵活性:适应性设计使研究者可以在试验进行中纠正错误的假设,尽早选择最有希望的选项,并可更早地对意外情况(积极或消极)作出反应;②可提高试验成功的可能性;③缩短开发时间,节约成本;④更符合伦理[11,21-22]。
尽管适应性设计可以对试验不同阶段进行方法学调整,提高试验效率,但适应性设计较传统试验更为复杂,易引入偏倚,增加Ⅰ类错误概率,因此在设计、操作、分析时须更为严谨[23]。
适应性设计由于其灵活性,能够节约研发成本和时间,在一些情况下也更加符合伦理的要求,因此在药物临床试验中,对其研究和应用越来越广泛。但在使用这一设计时还需注意:①考虑计划开展的试验的适用性,不应滥用、误用适应性设计;②方案中提前明确所有可能进行的适应性调整;③试验总体Ⅰ类错误率能否得到控制,能否确保试验结果的可信度、可解释性和说服力;④控制试验操作可能带来的偏倚;⑤需要正确的统计推断,以保证不同阶段间的一致性;⑥保持试验的完整性,要按照预先设定的计划对方案进行调整并保持期中分析结果的盲态[4]。在研究规划阶段进行模拟试验,作出适当的适应性决策,以及适当的统计规划是适应性临床试验成功的关键[21]。
5 案例解读
5.1 协变量适应性随机化 一项研究神经保护剂治疗急性缺血性卒中的临床试验应用了协变量适应性随机化的方法。该试验是一项多中心、双盲、随机对照试验,研究涉及8个国家,48家医院,共纳入发病12 h内的大动脉闭塞急性缺血性卒中患者1105例,采用动态、分层、最小随机化的方法将患者1∶1随机分配到静脉注射神经保护剂组与安慰剂组(生理盐水)。试验结果发现,两组受试者90 d时预后良好(mRS 0~2分)及死亡等结局并无显著差异[24]。
该研究先将受试者按照溶栓和取栓的治疗方式进行分层,每层再根据性别、年龄、基线NIHSS等特征进行动态最小随机化,有效地保证了组间协变量的均衡。需要注意的是,最小化随机化不是完全随机化,因此在进行后续分析时,应校正参与最小随机化的协变量。
5.2 反应变量适应性随机化 一项为期18个月的、多中心、双盲、安慰剂对照的Ⅱ期临床试验,旨在评估lecanemab治疗早期阿尔茨海默病患者的安全性和有效性[25]。研究采用了反应变量适应性随机化的设计,分为1个安慰剂对照组和5个lecanemab不同剂量的试验组。前期196名受试者采用固定随机化进行分组后(安慰剂组56例;每个lecanemab剂量组28例),实施反应变量适应性随机化,每增加50名受试者进行盲态期中分析,更新剂量组分配概率,从而将更多的受试者分配到效果更好的剂量组中。最终共有854名随机受试者接受了治疗(lecanemab组609例、安慰剂组245例),通过贝叶斯方法对1年后阿尔茨海默病综合评分(Alzheimer’s disease composite score,ADCOMS)、阿尔茨海默病认知评估量表(Alzheimer disease assessment scale-cognitive,ADAS-Cog)、脑脊液核心生物标志物的变化以及总海马体积等结局进行分析。研究最终确定lecanemab的90%有效剂量为每两周10 mg/kg。
另一项关于左卡尼汀辅助治疗感染性休克的临床试验采用前瞻性、随机、盲法、安慰剂对照的设计,同样使用了反应变量适应性随机化[26]。研究将18岁或以上的感染性休克和中度器官功能障碍患者分配到安慰剂对照组和低、中、高3个不同剂量的左卡尼汀试验组,对每组患者的48 h序贯器官衰竭估计(sequential organ failure assessment,SOFA)评分和28 d死亡率进行分析。最初40名受试者采用随机的方法进行分配,随后入组每12名患者进行一次期中分析。每次期中分析后,对3个试验疗组的相对分配概率进行调整,使患者SOFA评分得到最大改善。研究最后发现即使最有效的高剂量组也没有显著减少48 h内的累积器官衰竭。
5.3 盲态下样本量再估计 一项研究替格瑞洛与阿司匹林治疗TIA预后的临床试验采用多中心、随机、双盲、平行对照的设计[27-28]。研究在33个国家674个中心招募缺血性卒中或TIA患者,并将研究对象1∶1随机分配到替格瑞洛治疗组与阿司匹林治疗组,分别接受为期90 d的药物治疗。研究设计阶段,根据已有的研究资料假设结局发生率为10%,替格瑞洛的HR为0.8,据此估计样本量约为9600。盲态下的期中分析发现主要结局发生率约为6.4%,低于预期值,因此对样本量进行重新估计,将样本量调整为13 600。研究最后并未发现替格瑞洛在改善90 d内卒中复发、心肌梗死或死亡方面优于阿司匹林。
该研究团队又对替格瑞洛联合阿司匹林与单独使用阿司匹林治疗急性缺血性卒中或TIA的疗效进行了临床试验,研究同样采用多中心、随机、对照、双盲的研究设计[28]。受试者为非心源性轻、中度卒中患者及未接受溶栓/取栓治疗的TIA患者,受试者1∶1随机分配到联合治疗组与单抗组,联合治疗组患者同时服用替格瑞洛与阿司匹林,单抗组患者服用阿司匹林与安慰剂。研究开始根据双抗组HR为0.8,检验功效0.85的假设,预估试验至少需要770个受试者出现结局事件,样本量约为13 000。根据2019年5月新的临床数据,研究者对样本量进行了重新估计,将HR值调整为0.77,检验功效调整为0.9,计算大概需要647个受试者出现结局事件。研究发现联合治疗组在30 d内卒中复发或死亡的风险低于单抗组,但2组的残疾发生率无显著差异,替格瑞洛更易导致严重出血。
6 统计分析与工具
对于传统随机对照试验统计分析,通常报告估计的治疗效应值及其95%CI和P值。适应性设计试验的统计分析涉及不同试验阶段的数据,可以使用逆正态方法、P值组合测试或条件误差函数等方法进行分析[29]。
目前,一些软件应用程序已经可以满足成组序贯试验设计和适应性设计的计算需要,如适应性设计的专用软件EAST、ADDPLAN应用程序;一些常用的通用统计软件,如R软件的软件包(gsDesign、GroupSeq、adaptTest、asd);SAS软件中的成组序贯设计(PROC SEQDESIGN)和分析(PROC SEQTEST)过程等[30]。
7 适应性设计报告规范
2020年,适应性设计试验报告统一标准拓展组(Adaptive Designs Consolidated Standards of Reporting Trials Extension,ACE)通过德尔菲法制定并发布了适应性设计试验报告统一标准声明(拓展),以提高适应性随机试验的透明度并规范其报告,提高试验结果的可解释性以及方法、结果和推断的可重复性。该声明包括适应性设计试验报告和摘要的标准以及示例。ACE检查表包括7个新条目、9个修改条目、6个未更改条目(表1)[31]。
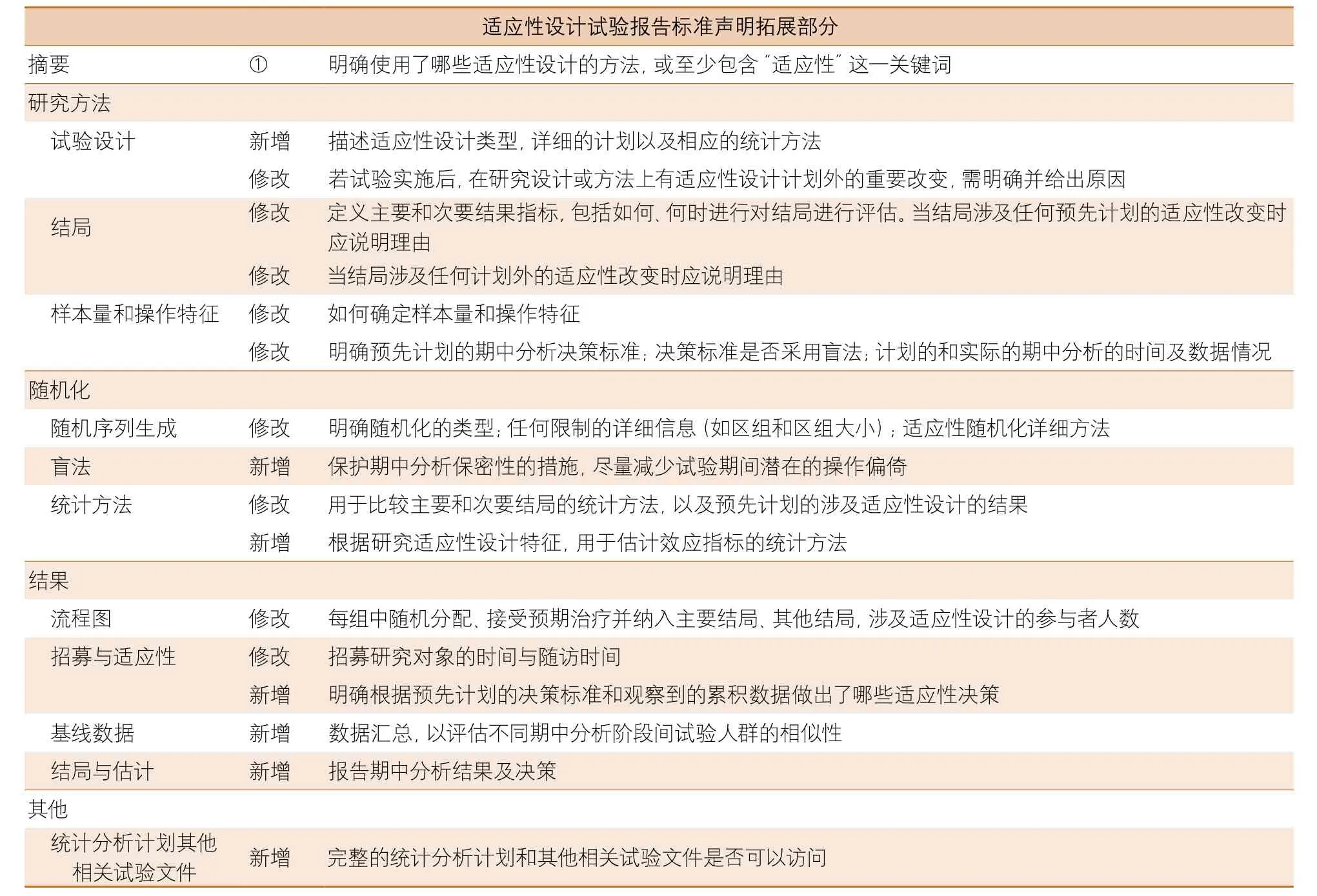
表1 适应性设计试验报告统一标准新增及修改条目

