对比剂过敏患者在无造影下行颈动脉支架置入术1例报道
张亮,贺雄军,黎凯锋,周宏星,胡明,刘亚杰
1 病例介绍
患者男性,56岁,因“头晕半年,颈动脉内膜切除术后3个月”于2021年6月19日就诊于南方医科大学深圳医院。患者近半年来持续头部晕沉感,2021年3月1日在南方医科大学深圳医院就诊,行头颈MRA提示:右侧颈内动脉开口重度狭窄,左侧颈内动脉闭塞(图1A)。2021年3月16日于神经外科行右侧颈内动脉内膜切除术,2021年3月19日患者出现左侧肢体无力,复查彩超提示右侧颈动脉血栓形成,血管内血流消失,当日急诊行颈动脉切开取栓术,术后彩超提示颈动脉血流通畅,术后给予双联抗血小板、强化降脂稳定斑块等维持治疗。2021年3月20日复查头颅MRI+MRA提示:右侧额、顶、颞叶以及半卵圆中心、放射冠、基底节区急性梗死灶,右侧颈内动脉起始部重度狭窄(图1B~E),予以扩容及对症支持治疗症状好转出院,出院时NIHSS 0分。出院后患者仍持续头晕,为求进一步治疗于神经内科就诊。

图1 头颅MRI+MRA检查结果
既往史:2003年在中山大学肿瘤医院诊断为鼻咽癌行放化疗,每年复查鼻咽MRI未见复发。2019年因胸闷在广东省药科大学附属医院就诊,行冠状动脉造影+全脑血管造影示左前降支(left anterior descending branch,LAD)中段可见管壁不整;左回旋支(left circumflex branch,LCX)中段狭窄80%,右冠状动脉(right coronary artery,RCA)近段狭窄30%;左侧颈总动脉完全闭塞,椎动脉未见狭窄;右侧颈内动脉90%狭窄,颈外动脉90%狭窄,颅内动脉未见明显狭窄。术中患者出现过敏性休克(碘海醇注射液),经抢救后转危为安。
入院查体:血压148/92 mmHg(1 mmHg=0.133 kPa),心、肺、腹查体未见异常。神经系统查体:神志清楚,言语流利,声音沙哑,对答切题。双侧瞳孔等大等圆,对光反射灵敏,眼球活动自如,未见眼震;双耳听力下降,双侧额纹及鼻唇沟对称,伸舌居中。四肢肌力5级,肌张力正常,双侧Babinski征阴性,四肢及躯干深浅感觉、共济运动正常。NIHSS 0分,MMSE 23分。
实验室检查:乙肝表面抗原定量(HBsAg)1.590 COI,乙肝e抗体定量(Anti-HBe)0.121 COI,乙肝核心抗体定量(Anti-HBc)0.008 COI;血常规、尿常规、便常规、肝功能、肾功能、凝血功能、糖化血红蛋白、血脂四项未见异常。
辅助检查:
心电图(2021-06-18):窦性心律,大致正常心电图。
颈动脉超声(2021-06-18):双侧颈动脉粥样硬化斑块形成,右侧颈内动脉狭窄80%~90%,左侧颈内动脉闭塞。
头颅MRI+MRA+SWI(2021-06-19):右侧额、顶、颞叶及半卵圆中心、放射冠、基底节区多发软化灶形成;右侧颈内动脉重度狭窄,左侧颈内动脉闭塞。头颅SWI示双侧颞叶及右侧额叶多发微出血灶(图2)。
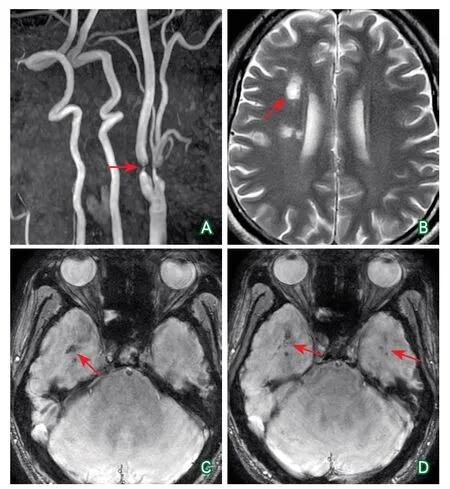
图2 头颈MRI+MRA+SWI检查结果
入院诊断:
右侧颈内动脉重度狭窄(内膜切除术后)
左侧颈内动脉闭塞
脑梗死恢复期
冠心病 冠状动脉中重度狭窄
鼻咽癌(综合放化疗后)
诊疗经过:入院后予以双联抗血小板聚集(阿司匹林100 mg/d,氯吡格雷75 mg/d)、调脂稳定斑块(阿托伐他汀钙20 mg/d)治疗。考虑患者有慢性脑缺血症状,颈动脉内膜切除术(carotid endarterectomy,CEA)后明显再狭窄,经多学科讨论后予以行颈动脉支架置入术(carotid angioplasty and stenting,CAS)。考虑到患者既往存在对比剂过敏性休克,手术过程中使用对比剂风险高,拟在颈动脉超声和DSA联合定位下无造影行CAS,术后通过颈动脉超声和血管内超声评估支架置入效果。2021年6月23日局部麻醉下行右侧颈内动脉支架置入术:术中通过颈动脉超声定位狭窄部位后使用别针进行标记,DSA透视下放置Nav6保护伞于颈动脉高颈段(图3A),顺保护伞导丝进入雅培球囊(5 mm×30 mm),透视下参考别针标记点将球囊覆盖狭窄部位后接压力泵缓慢加压至8 atm,透视下见球囊成形满意(图3B),撤出球囊,顺保护伞导丝进入XACT颈动脉自膨支架(10 mm×40 mm~8 mm×40 mm),在DSA透视下参考别针标记点将支架放置于右侧颈内动脉,确认支架覆盖病变后缓慢释放支架,透视下见支架成形满意,局部残留轻度狭窄(图3C),颈动脉B超显示颈动脉狭窄明显改善(图3D),血管内超声显示支架贴壁良好,支架成形满意(图3E)。患者无新发症状及体征,术后继续予以双联抗血小板、调脂稳定斑块治疗。
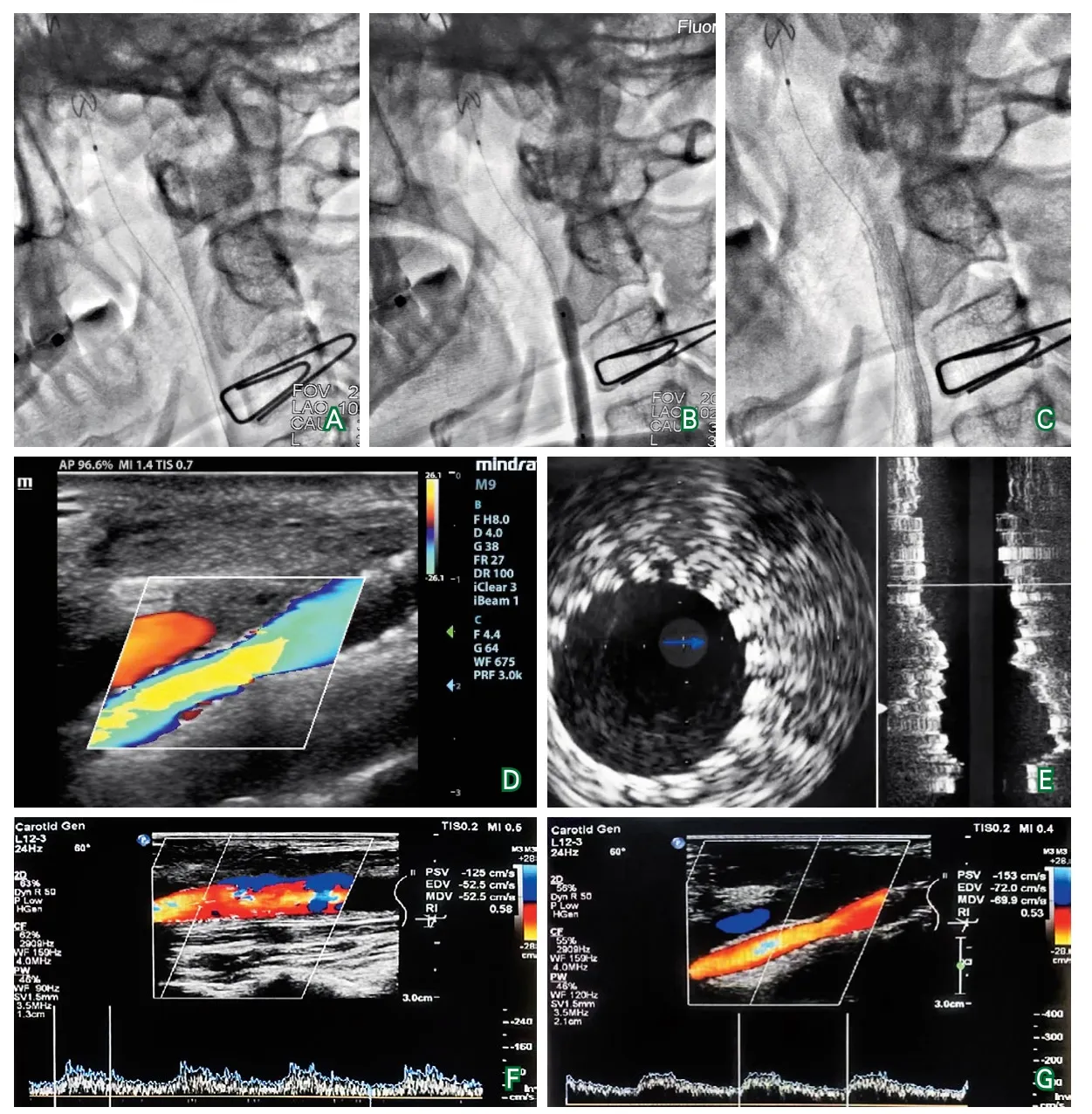
图3 手术过程及随访
随访:2021年9月25日复查颈动脉彩超提示右侧颈总动脉至颈内动脉血流通畅,可见支架强回声,支架内血流速度为125 cm/s(图3F~G)。
2 讨论
随着头颈部恶性肿瘤放疗后生存率的提高,放疗后的颈动脉狭窄需要引起特别关注。目前,放疗引起颈动脉损伤的机制尚不清楚,可能的机制包括电离辐射导致的血管内皮损伤和功能障碍、慢性炎症反应、氧化应激反应等,这些因素共同作用引起颈动脉内中膜增厚,加快颈动脉粥样硬化进展,导致颈动脉管腔狭窄以及脑缺血事件的发生[1-3]。
放疗引起的颈动脉狭窄的治疗包括药物治疗和手术治疗,对于颈动脉重度狭窄(狭窄程度≥70%)患者,首选手术治疗。手术治疗方法包括CAS和CEA。放疗可引起血管壁纤维化及结构破坏,颈部瘢痕组织形成,增加了CEA的难度,同时增加了局部切口的并发症。因此,放射性颈动脉狭窄与颈动脉高分叉、同侧CEA后患者均被认为不适合行CEA[4-5]。但Fokkema等[6]的meta分析显示,533例接受CEA或CAS治疗的放疗后颈动脉狭窄患者,发生脑血管事件的风险均较低,均可作为放疗后颈动脉狭窄血管重建的方法。CEA出现短暂性颅神经损伤的风险较高,CAS出现血管再狭窄和远期脑血管事件风险较高。本例患者在首次治疗选择手术方案时考虑到存在对比剂过敏,CAS风险高,选择了CEA治疗。术后患者出现了脑缺血事件,颈动脉超声提示颈动脉血栓形成,急诊行颈动脉切开血栓取出术。患者术前服用双抗时间已经超过5 d,且血栓弹力图未发现药物抵抗证据,术后复查MRA显示右侧颈内动脉起始部仍存在重度狭窄,不排除患者颈内动脉急性血栓形成与手术操作有关。
对于CEA术后再狭窄的处理,Tu等[7]的一项meta分析显示:CEA术后再狭窄,再次行CEA或CAS均是安全可行的,但再次行CEA会增加心肌梗死及暂时性颅神经损伤风险。本例患者,CEA术后头晕症状无改善,右侧颈内动脉仍存在重度狭窄,药物保守治疗在改善患者脑缺血症状和降低脑缺血事件风险方面均不及手术治疗[8-9]。CEA术后血管狭窄再次行CEA是可行的,但患者放疗后颈部瘢痕形成,血管壁纤维化,CEA又加重了手术区组织的破坏,再次行CEA手术难度较大,且患者合并有冠状动脉狭窄,发生心肌梗死风险高,同时患者本人再次行CEA意愿不强烈。对于放射性颈动脉狭窄内膜切除术后再狭窄的患者,CAS补救是一种理想的方法[10],但本例患者有对比剂过敏休克病史,CAS使用对比剂有发生过敏性休克的风险。医疗团队在充分评估后,认为可在无造影下完成CAS:通过术中颈动脉B超和DSA机器透视联合定位支架位置,通过支架置入术后支架形态、颈动脉B超及血管内超声评估置入支架的位置、形态、贴壁情况以及血管重建效果。按照此方案,成功完成了颈动脉支架置入,支架位置、形态、贴壁良好,血管形态明显改善,手术全程未使用对比剂冒烟和造影。
日本Miyamoto等[11]报道了1例碘过敏,使用钆对比剂行锁骨下动脉支架置入术的病例,但目前尚未发现在无造影下行CAS的报道。CAS术中需要通过造影或冒烟判断病变位置、支架到位情况以及支架术后血管成形情况等,而对于本例碘对比剂过敏患者,尝试借助颈动脉B超联合DSA机器透视来判断病变位置及支架定位,通过颈动脉B超、血管内超声评估血管成形及支架贴壁情况,显示了无造影情况下行CAS是可行的,本病例为碘对比剂过敏或肾功能不全患者的CAS治疗提供了新思路。
目前CAS的应用日益广泛,但对于碘对比剂过敏或者肾功能不全患者,其临床应用受到限制,特别是肾功能不全患者。借助B超、血管内超声等手段,在无造影下完成CAS,可能是一个新的思路和选择。

