去铁胺、辛伐他汀治疗大鼠慢性硬膜下血肿的研究
张士俊,吴焕成,王延民,李宏伟,胡群亮
(天津市北辰医院神经外科,天津 300400)
慢性硬膜下血肿属于一种较为常见的颅内出血性疾病,目前该病主要治疗手段为钻孔引流术,其能延长患者的生存时间,但术后复发率高达5.0%~30.0%[1]。核因子-κB 通过启动和增强κB 位点的活化,使得脑损伤后出现继发性损伤,与炎症反应密切相关。辛伐他汀作为一种内源性胆固醇抑制剂,具有减轻脑水肿、改善微循环等作用[2]。去铁胺作为一种铁螯合剂,对铁离子具有很强的亲和力,能结合铁蛋白或与含铁血黄素结合的铁,减少铁在体内的病理性沉积,还可络合游离的铁,结合铁蛋白或与含铁血黄素结合的铁。此外,去铁胺也可渗透血脑屏障,降低脑出血后继发的神经损伤,在局部脑组织中高浓度蓄积,降低血肿部位铁离子的含量,从而发挥脑保护作用[3]。本研究主要分析去铁胺、辛伐他汀治疗大鼠慢性硬膜下血肿的效果,现报道如下。
1 资料与方法
1.1 研究材料
清洁级6~8 周龄成年雄性Sprague-Dawley(SD)大鼠购自北京维通利华公司,严格按照动物伦理要求进行实验操作。所有SD 大鼠均饲养于清洁无菌级动物实验中心,在标准的12 h 明/暗周期的清洁开放环境中饲养,动物房保持标准化的温度湿度,每笼5 只,供应充足的氧气。去铁胺购自美国sigma 公司,辛伐他汀购自大量TAKARA 公司,Western blot 检测试剂盒、蛋白定量检测试剂盒都购自上海生工公司,二甲苯、无水乙醇、3.0%双氧水购自国药集团。
1.2 方法
大鼠称重后使用10.0%的水合氯醛腹腔注射麻醉(4 ml/kg),将大鼠俯卧位放置于大鼠脑立体定位仪上,保证大鼠的前囟和后囟处于同一稳定的水平面。切开大鼠头部皮肤,暴露前囟和后囟,逐层分离皮下组织直至颅骨表面。固定微量注射器,以前囟为原点,在前囟前0.2 mm、中线右旁3.0 mm 钻孔,硬脑膜下注入Ⅶ型胶原酶1 μl(0.2 U),调整注射速度为0.05 μl/min,注射完毕后留针10 min,无菌骨蜡封闭小孔并进行缝合。造模一周后经影像检查血肿形成,将造模成功的大鼠(n=48)随机平分为三组:模型组、辛伐他汀组、去铁胺组,每组16 只。三组都在造模成功后2 h 经腹腔注射生理盐水、2 mg/kg 辛伐他汀、50 mg/kg 去铁胺各10 μl,之后每12 h 注射1 次,直至相应时间点处死。
1.3 观察指标
①所有大鼠都在治疗第5 d 与第10 d 进行前肢上抬实验与前肢应用协调实验,前者主要比较左侧上肢成功上抬的百分比,后者评分为(右侧-左侧)/总触壁次数×100.0%。②所有大鼠都在治疗第10 d与第15 d 分别处死大鼠,测定血肿体积,断头取脑并固定,利用Image ProPlus 图像分析软件计算血肿体积。③所有大鼠都在治疗第10 d 与第15 d进行静脉取血500 μl,离心后取血清,采用酶联免疫法检测血清IL-6、TNF-α 含量。④取处死大鼠的血肿周围组织,行Western Blot 检测水通道蛋白(aquaporin,AQP)4、血管内皮生长因子(vascular endothelial growthfactor,VEGF)蛋白表达水平,每孔蛋白上样量20 μg,电泳、转膜,室温封闭2 h,然后加入一抗(1 ∶500)4 ℃孵育过夜;洗涤3次后,采用荧光二抗室温摇床孵育1 h,洗涤3 次后将膜置于Odyssey 凝胶图像处理系统进行曝光,计算VEGF 与AQP4 蛋白相对表达水平。
1.4 统计方法
采用SPSS 23.00 统计学软件进行数据分析,计量资料以(±s)表示,组间比较采用t检验,多组件比较采用单因素方差分析;计数资料以[n(%)]表示,采用χ2检验。以P<0.05 表示差异有统计学意义。
2 结果
2.1 各组前肢上抬实验与前肢应用协调实验结果比较
辛伐他汀组、去铁胺组治疗第5 d、第10 d 前肢上抬实验值高于模型组,前肢应用协调实验值低于模型组,且去铁胺组前肢上抬实验值高于辛伐他汀组,前肢应用协调实验值低于辛伐他汀组,差异有统计学意义(P<0.05),见表1。
表1 三组治疗不同时间点前肢上抬实验与前肢应用协调实验结果比较[(±s),%]
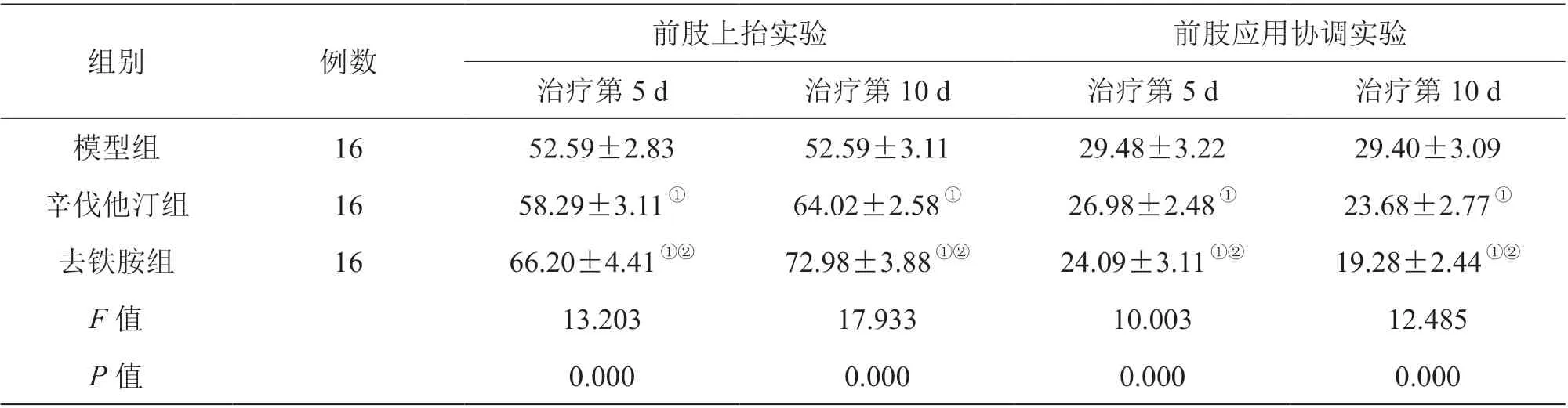
表1 三组治疗不同时间点前肢上抬实验与前肢应用协调实验结果比较[(±s),%]
注:与模型组比较,①P<0.05;与辛伐他汀组比较,②P<0.05
组别 例数 前肢上抬实验 前肢应用协调实验治疗第5 d 治疗第10 d 治疗第5 d 治疗第10 d模型组 16 52.59±2.83 52.59±3.11 29.48±3.22 29.40±3.09辛伐他汀组 16 58.29±3.11① 64.02±2.58① 26.98±2.48① 23.68±2.77①去铁胺组 16 66.20±4.41①② 72.98±3.88①② 24.09±3.11①② 19.28±2.44①②F 值 13.203 17.933 10.003 12.485 P 值 0.000 0.000 0.000 0.000
2.2 各组血肿体积变化比较
辛伐他汀组、去铁胺组治疗第10d、第15d 血肿体积低于模型组,且去铁胺组低于辛伐他汀组(P<0.05),见表2。
表2 三组治疗不同时间点血肿体积变化比较[(±s),μl]

表2 三组治疗不同时间点血肿体积变化比较[(±s),μl]
注:与模型组比较,①P<0.05;与辛伐他汀组比较,②P<0.05
组别 例数 治疗第10 d 治疗第15 d模型组 16 65.33±2.48 65.29±3.11辛伐他汀组 16 55.02±3.22① 45.98±2.58①去铁胺组 16 40.59±5.18①② 34.58±2.86①②F 值 14.863 18.472 P 值 0.000 0.000
2.3 各组血清IL-6、TNF-α 含量变化比较
辛伐他汀组、去铁胺组治疗第10 d、第15 d血清IL-6、TNF-α 含量低于模型组,且去铁胺组低于辛伐他汀组(P<0.05),见表3。
表3 三组治疗不同时间点血清IL-6、TNF-α 含量比较[(±s),pg/ml]
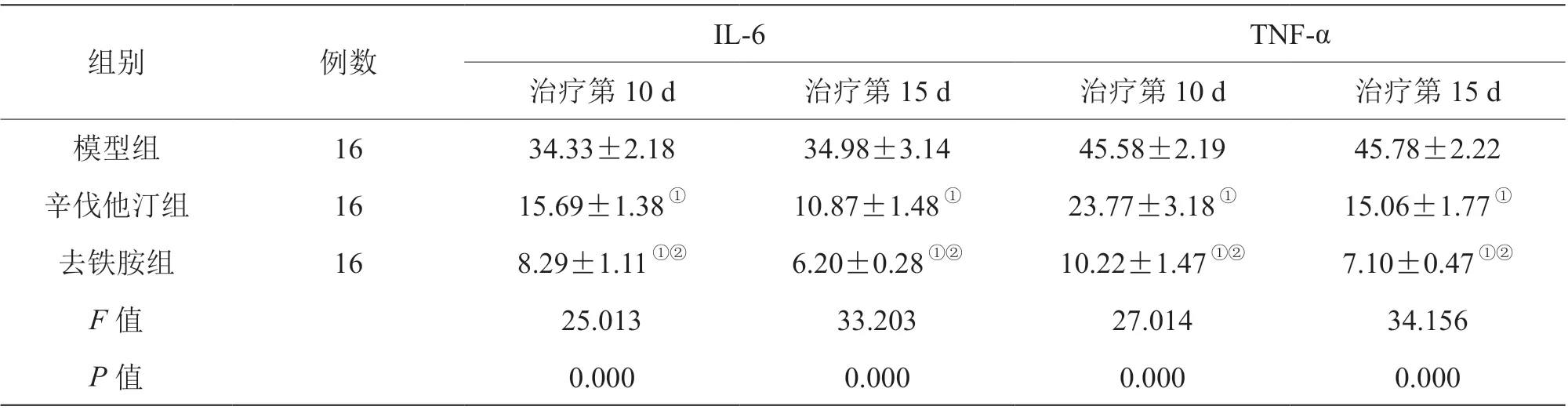
表3 三组治疗不同时间点血清IL-6、TNF-α 含量比较[(±s),pg/ml]
注:与模型组比较,①P<0.05;与辛伐他汀组比较,②P<0.05
组别 例数 IL-6 TNF-α治疗第10 d 治疗第15 d 治疗第10 d 治疗第15 d模型组 16 34.33±2.18 34.98±3.14 45.58±2.19 45.78±2.22辛伐他汀组 16 15.69±1.38① 10.87±1.48① 23.77±3.18① 15.06±1.77①去铁胺组 16 8.29±1.11①② 6.20±0.28①② 10.22±1.47①② 7.10±0.47①②F 值 25.013 33.203 27.014 34.156 P 值 0.000 0.000 0.000 0.000
2.4 各组VEGF 与AQP4 蛋白相对表达水平变化比较
辛伐他汀组、去铁胺组治疗第10 d、第15 d的VEGF 与AQP4 蛋白相对表达水平低于模型组,且去铁胺组低于辛伐他汀组(P<0.05),见表4。
表4 三组治疗不同时间点VEGF 与AQP4 蛋白相对表达水平比较(±s)
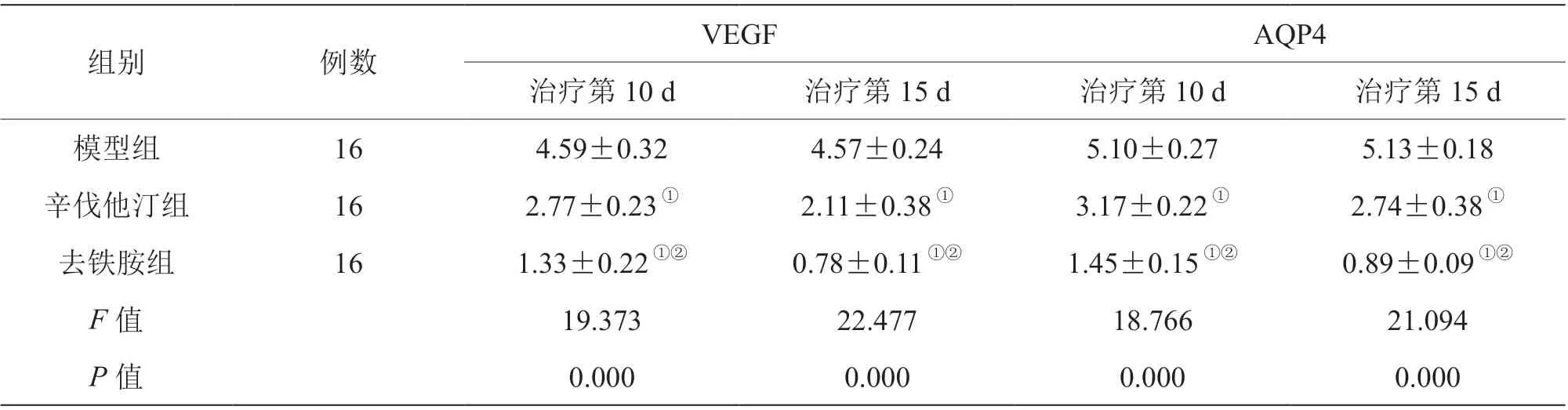
表4 三组治疗不同时间点VEGF 与AQP4 蛋白相对表达水平比较(±s)
注:与模型组比较,①P<0.05;与辛伐他汀组比较,②P<0.05
组别 例数 VEGF AQP4治疗第10 d 治疗第15 d 治疗第10 d 治疗第15 d模型组 16 4.59±0.32 4.57±0.24 5.10±0.27 5.13±0.18辛伐他汀组 16 2.77±0.23① 2.11±0.38① 3.17±0.22① 2.74±0.38①去铁胺组 16 1.33±0.22①② 0.78±0.11①② 1.45±0.15①② 0.89±0.09①②F 值 19.373 22.477 18.766 21.094 P 值 0.000 0.000 0.000 0.000
3 讨论
3.1 去铁胺可降低大鼠的血肿体积
本研究结果显示,辛伐他汀组、去铁胺组治疗第10 d、第15 d 血肿体积低于模型组,且去铁胺组低于辛伐他汀组(P<0.05),表明相对于辛伐他汀,去铁胺治疗大鼠慢性硬膜下血肿能降低血肿体积。分析可知,他汀类药物能降低血低密度脂蛋白胆固醇水平,改善血管内皮功能,抑制血管内皮炎症反应,稳定粥样斑块,被广泛用于心脑血管缺血性事件的一、二级预防。辛伐他汀是脂溶性他汀类药物,血脑屏障通透率高,易在血肿腔及颅内聚集,对血管及炎症的调节作用更强,更有利于血肿吸收及恢复[4]。而去铁胺可通过降低游离铁的羟自由基活性,催化血红素的降解,增加血红素加氧酶-1 的转录,防止羟基自由基的形成,并通过抑制谷氨酸介导的兴奋性毒性来阻止血红蛋白的神经毒性作用,有利于血肿的吸收[5]。
3.2 去铁胺可改善大鼠的神经功能
辛伐他汀组、去铁胺组治疗第5 d、第10 d 前肢上抬实验值高于模型组,前肢应用协调实验值低于模型组,且与去铁胺组前肢上抬实验值高于辛伐他汀组,前肢应用协调实验值低于辛伐他汀组,差异有统计学意义(P<0.05),表明相对于辛伐他汀,去铁胺治疗大鼠慢性硬膜下血肿可改善大鼠的神经功能。慢性硬膜下血肿是一个复杂的过程,包括溶血、炎症因子大量释放、补体级联反应、氧化应激反应、脑血流量改变等。辛伐他汀上调内源性一氧化氮合酶,刺激一氧化氮合成,从而起到舒张血管、抑制平滑肌增生和血小板聚集的作用;抑制超氧化物的合成,阻碍血管平滑肌释放氧自由基,降低氧化应激反应的神经毒性,进而保护神经功能[6]。而去铁胺,一种自然产生的铁螯合剂,参与维持脑铁代谢,且大脑能产生铁蛋白。铁蛋白合成主要通过铁或非铁介导的转录后调节,而且脑内铁蛋白水平上调可能参与神经保护,可减轻慢性硬膜下血肿后与血红蛋白相关的脑水肿,抑制神经元死亡,可防治神经功能缺损和脑萎缩[7]。
3.3 去铁胺可抑制大鼠血清IL-6、TNF-α 的表达
辛伐他汀组、去铁胺组治疗第10 d、第15 d血清IL-6、TNF-α 含量低于模型组,且去铁胺组低于辛伐他汀组(P<0.05),表明相对于辛伐他汀,去铁胺治疗大鼠慢性硬膜下血肿能抑制血清IL-6、TNF-α 的表达。慢性硬膜下血肿可诱发氧化应激反应与细胞毒性级联反应,其中铁超载为导致细胞功能障碍和预后不良的关键因素。促炎细胞因子可通过多种途径参与慢性硬膜下血肿引起的炎症反应,介导神经元坏死、缺失,是机体病理生理变化及继发性炎症损伤的重要环节。慢性硬膜下血肿可引起继发性炎症损伤,促炎因IL-6、TNF-α 在炎症反应中起重要作用,IL-6、TNF-α 的表达调控机制对于制定慢性硬膜下血肿的防治策略具有重要意义[8]。辛伐他汀不仅可通过降血脂途径发挥作用,而且还可通过改善血管内皮细胞功能、消炎等途径,对脑血管疾病发挥一定的防治作用。辛伐他汀可通过抑制NF-κB 通路来降低IL-6、IL-8、TNF-α 表达,同时通过降低白细胞迁移、巨噬细胞浸润等抑制炎症反应,进而缩小脑梗死的体积,减轻炎症损伤。而去铁胺对离子铁具有极高的特异性和亲和力,能与离子铁快速结合形成去铁敏-铁复合物,从而排出体外阻断羟自由基的形成,具有清除脑组织氧自由基和激活缺氧反应基因等作用,可减轻慢性硬膜下血肿模型中相关铁蛋白的表达,减轻脑内铁超载现象,从而可以抑制神经元变性和细胞死亡,更加有效抑制炎症因子的表达[8]。
3.4 去铁胺可抑制大鼠的VEGF 与AQP4 蛋白的表达
辛伐他汀组、去铁胺组治疗第10d、第15d的VEGF 与AQP4 蛋白相对表达水平低于模型组,且去铁胺组低于辛伐他汀组(P<0.05),表明辛伐他汀、去铁胺能够促进神经功能恢复,有效调节患者炎症以及血管生成,促进血肿吸收。慢性硬膜下血肿后脑组织VEGF 表达增加,后者可通过促分裂原活化蛋白激酶途径上调AQP4 水平。AQP4 在神经系统分布广泛,具有多种亚型,在体内水稳态调节中有着重要作用,与血脑屏障功能存在相关性。辛伐他汀可增强相关因子的表达活性,进而促进正常血管的增生以及病理性血管的修复及成熟,进而抑制VEGF 与AQP4 的表达。而去铁胺可通过抑制小胶质细胞的活化和增殖,进一步减少神经炎症,抑制自由基的产生,减轻神经细胞的凋亡,减少铁离子在体内的病理性聚积,避免进一步加重脑损伤,从而有利于抑制VEGF 与AQP4 的表达[9]。
总之,相对于辛伐他汀,去铁胺治疗大鼠慢性硬膜下血肿既能抑制血清IL-6、TNF-α 的表达,也能抑制VEGF 与AQP4 蛋白的表达,从而降低血肿体积,改善神经功能。

