不同分化程度肝细胞癌患者Gd-EOB-DTPA增强MRI检查结果分析
周婧 吴平 许亚春
肝细胞癌(HCC)是临床常见的消化道肿瘤,HCC预后较差,复发率、转移率和致死率均较高[1]。研究显示[2],HCC的复发风险可能受其病理分级的影响,病理分级越高,复发率越高,患者预后越差,生存时间越短。因此准确评估HCC的病理分级对于治疗方案的选择具有指导意义。使用对比剂不仅能提高诊断效率,还有利于提高MRI中HCC病灶检出率,钆塞酸二钠(Gd-EOB-DTPA)是属于第三代钆对比剂,经肝细胞特异性吸收后排入胆道系统[3-4]。研究显示[5],Gd-EOB-DTPA的吸收量可反映癌细胞和正常肝细胞的功能。HCC的分化程度也能影响Gd-EOB-DTPA的吸收量,因此MRI增强扫描的肝胆信号强度也可用于评估HCC患者的细胞功能和病理分级。本研究以78例HCC患者为研究对象,分析不同分化程度患者增强扫描的检查结果,旨在为临床判断HCC病理分级提供一种简单易行、无创的方法。
资料与方法
一、一般资料
研究对象为2018年1月—2021年1月南通大学附属海安医院收治的HCC患者(73例),患者年龄34~73岁,平均(48.29 ± 9.73)岁,男性42例,女性36例,合并肝硬化26例。手术病理结果显示,低分化HCC患者13例,中分化HCC患者40例,高分化HCC患者25例。
二、纳入与排除标准
纳入标准:①年满18岁;②经穿刺活检或手术病理学确诊为HCC;③行增强MRI检查,对比剂为Gd-EOB-DTPA;④病灶直径≥1 cm,单发病灶;⑤患者及其家属对本研究知情同意。
排除标准:①存在系统性疾病;②严重肝肾功能不全;③病理学分级不明确;④对本研究使用对比剂过敏。
三、方法
患者在检查前4~5 h空腹,为减少患者呼吸对检查结果的干扰,可在检查前指导其训练屏气和平静呼吸,以磁共振扫描仪进行扫描,检查时患者取仰卧位,相关序列和参数如下:双回波T1W1序列,重复时间/回波时间 200/4.7 ms;T2W1脂肪抑制序列,重复时间/回波时间 2500/73 ms,三期动态增强扫描,动脉期延迟时间为20 s,门静脉期60 s,平衡期180 s,重复时间/回波时间 3.8/1.8 ms,矩阵256×224,视野38×38 cm,层间距2.5 mm,层厚5 mm,肝胆期图像于对比剂注射20 min后采集,以肝胆容积加速采集(LAVA)采集平扫、动态和肝胆期图像。增强扫描前,将剂量0.1 mL/kg的Gd-EOB-DTPA以1 mL/s的注射速度行肘静脉团注,为保证对比剂完全进入患者体内,对比剂注射结束后,以20 mL生理盐水在相同速率下进行冲洗。
四、观察指标
影像学检查结果:①统计三组病灶类型(动脉供血型、乏供血型和动-静脉供血型);②在平扫和肝胆期图像上肝实质部分各自划出同样大小的感兴趣区(ROI),在病灶范围内划定尽可能大的ROI,其直径为15~20 mm,并且尽量避开伪影干扰、出血和坏死等区域,分别测量正常肝实质信号强度(SILiv)、病灶信号强度(SIles)和右侧脊竖肌信号强度(SImus),计算三组强化率(ER)=|肝胆期SIles-平扫SIles|/平扫SIles×100%,相对信号强度(rSI)=SIles/SImus×100%,以及相对强化率(rER)=|肝胆期SIles-肝胆期SILiv|/|平扫SIles-平扫SILiv|。
以ROC曲线分析ER、rSI、rER鉴别高分化和中低分化病灶的价值。
五、统计学方法

结 果
一、三组影像学检查结果比较
三组病灶类型相比,低分化组动脉供血型占比最高(76.92%,P<0.05);三组ER、rSI、rER值相比,高分化组值高于其他两组,并且中分化组较低分化组高(P<0.05),见表1。高、中、低分化HCC患者增强扫描图像见图1~3。
二、ER、rSI、rER鉴别高分化和中低分化病灶的ROC分析
经ROC分析,ER、rSI、rER鉴别高分化和中低分化的曲线下面积分别为0.970、0.963、0.928,最佳截断值分别为79.490%、40.576%、626.214(P<0.05),见表2。
讨 论
HCC的病理分级是反映肝脏移植或外科手术后疾病复发或患者存活的重要指标[6]。研究显示[7-8],与高分化HCC相比,中低分化HCC的无复发生存期较短,对于低分化HCC患者,手术治疗可能无法使患者获得最佳的无复发生存期,且术后并发症和死亡率也不会明显降低,因此术前对HCC患者的病理分级进行准确评估极为重要。
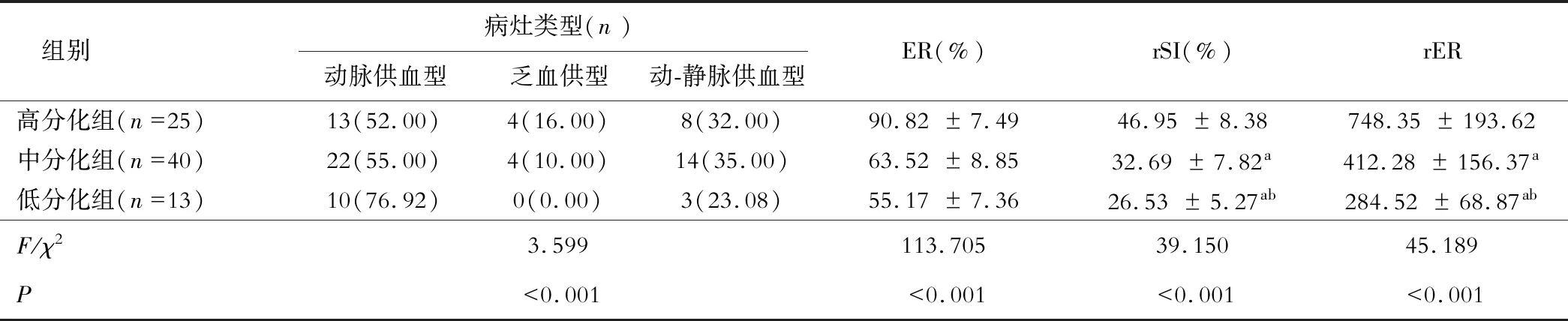
表1 三组影像学检查结果比较
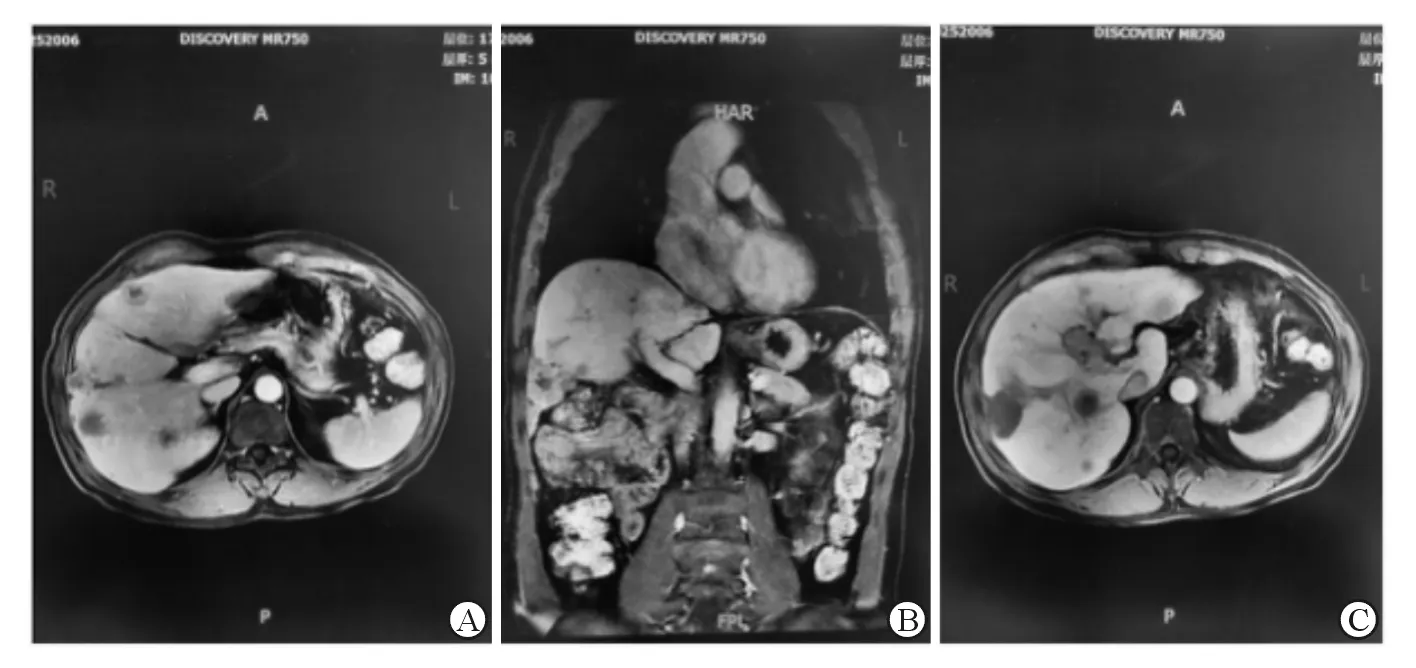
A:动脉期扫描图像;B:门静脉期扫描图像;C:肝胆期图像

A:动脉期图像;B:门静脉期图像;C:肝胆期图像

A:动脉期图像;B:门静脉期图像;C:肝胆期图像
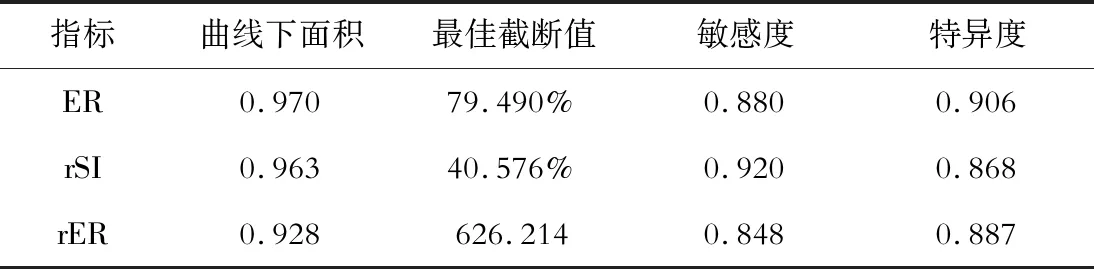
表2 rSI、ER、rER鉴别高分化和中低分化病灶的ROC分析
本研究结果显示,低分化组患者中动脉供血型病灶占比较高。HCC的发生是一个连续、进展的过程,通常与肝硬化密切相关,异型增生结节、早期HCC、再生结节、异型增生结节癌变等都可能发展为进展期HCC[9]。最初HCC结节供血方式为门静脉和肝动脉联合供血,随着HCC病情加重,逐渐变为主要依靠肿瘤动脉供血[10]。肿瘤的分化程度不同可影响MRI的强化特征,通常分化程度较低肿瘤的肿瘤血管更加粗大、密集,而高分化肿瘤的肝内血窦比较丰富[11]。因此进行增强MRI扫描时,低分化肿瘤的强化特征比较明显,强化持续时间较短[12]。本研究低分化组中动脉供血型占比为76.92%,而没有乏血供型病灶,其原因主要为低分化病灶具有比较丰富的新生肿瘤血管,与中高分化病灶相比,低分化病灶的门静脉和正常肝动脉供血较多。
本研究结果显示,三组ER、rSI、rER值相比,高分化组值最高,低分化组值最低。Gd-EOB-DTPA分子首次经过肝脏时,其中包含的亲脂团EOB即可被功能正常的肝细胞摄取,因此T1弛豫时间在正常肝脏组织中较短,在T1WI中表现为高信号。随着转运肽表达水平的降低,由于Gd-EOB-DTPA不能被肝癌细胞摄取,肝癌组织在T1WI中的信号强度无明显升高[13-14]。陈佳等[15]研究不同分化程度的HCC患者的肝胆期信号特征发现,高分化组ER为91.27%、rSI为47.16%、rER为757.55%,高于中、低分化组,其结论与本研究结果一致。
综上,随着HCC分化程度的提高,动脉供血型病灶的占比逐渐降低,ER、rSI、rER可逐渐提高,并且ER、rSI、rER用于鉴别高分化和中低分化病灶具有较高的价值。
利益冲突声明:所有作者均声明不存在利益冲突。

