重组抗IL-36受体单克隆抗体药物的质量控制研究
杜加亮,于传飞,王文波,武 刚,崔永霏,郭璐韵,杨雅岚,俞小娟,李 萌,徐刚领,刘春雨,付志浩,郭 莎,王 兰
(中国食品药品检定研究院单克隆抗体产品室,卫生部生物技术产品检定及标准化重点实验室,国家药品监督管理局生物制品质量研究与评价重点实验室,北京 102629;#共同第一作者;*通讯作者,E-mail:wanglan@nifdc.org.cn)
脓疱型银屑病(pustular psoriasis,PP)包括一系列严重的慢性或复发性炎症性皮肤病,伴有疼痛的中性粒细胞无菌脓疱反复或持续喷发。PP患者可呈现不同的临床表型,两种公认的亚型包括泛发性脓疱型银屑病(generalized pustular psoriasis,GPP)和掌跖脓疱性银屑病(palmoplantar pustular psoriasis,PPP)[1]。银屑病的发病机制尚不完全清楚。遗传、表观遗传和非遗传因素共同参与银屑病的易感性。先天性和适应性免疫系统发挥着关键作用,尤其是CD4和CD8细胞以及IL-23/IL-17免疫轴[2]。最近,在IL-36受体(IL-36R)拮抗剂的编码基因(IL-36RN)中发现的特定突变与一种被称为“IL-36R拮抗剂缺乏症”的严重GPP为特征的自身炎症状况有关[3]。这凸显了IL-36家族细胞因子作为银屑病的关键介质的重要性。IL-36RN突变是在PP患者中最常见的遗传变异(5%~24%)[4]。虽然这种基因型与表型之间的相关性尚无定论,但是在一项针对57名中国PP患者的研究中,在75%GPP患者中存在IL-36RN突变[5]。其他与PP相关的突变基因包括激活半胱天冬酶的募集结构域14(CARD14)、衔接蛋白复合物1亚基sigma 3(AP1S3)、TNFAIP3相互作用蛋白1(TNIP1)和丝氨酸蛋白酶抑制剂家族A成员3(SERPINA 3)[6]。它们都参与了IL-1/IL-36信号通路,进一步强调了这些细胞因子在PP中的相关性。另外,虽然PPP患者中IL-36RN的突变不如GPP中普遍存在,但是PPP也受先天免疫系统支配,与TH1/TH17通路相比,与IL-1和IL-36通路相关的基因和蛋白质的表达增加[7]。
银屑病的治疗虽然取得了很大进展,包括肿瘤坏死因子α抑制剂(阿达木单抗、聚乙二醇化赛妥珠单抗、依那西普、英夫利昔单抗)、IL-17抑制剂(brodalumab, ixekizumab, secukinumab)、IL-12/23抑制剂(乌丝奴单抗)和IL-23抑制剂(guselkumab, risankizumab, tildrakizumab)[8]。但是由于对现有治疗的抗性、疾病复发以及副作用的问题,银屑病的治疗仍然是一个挑战,尤其是针对PP。因此,阻断IL-36R信号传导对于GPP或PPP患者来说是一种有吸引力的靶向治疗方法。伴随着该单抗制品在临床试验中表现出来的疗效[9],将有越来越多的针对该靶点的原研药和生物类似药的研发。因此为了有效地对抗IL-36R单抗进行质量控制,保证其安全性和有效性,本研究依据国内和国际的相关指导要求[10,11],建立抗IL-36R单抗的鉴别、纯度、电荷异质性、聚糖谱和生物学活性等分析方法,针对产品的关键质量属性进行分析和探讨,为抗IL-36R单抗的质量控制提供依据和指导。
1 材料与方法
1.1 抗体和细胞
人源化单克隆抗体(抗IL-36R单抗)及其参比品均为本实验室留样。生物学活性检测用细胞是由卵巢腺癌细胞增加NF-κB反应元件并偶联荧光素酶基因改造而来。当向该细胞添加可溶性IL-36时,与细胞表面的IL-36R结合,后者会激活细胞内的NF-κB信号通路,致使与其偶联的荧光素酶基因表达。
1.2 主要试剂
二硫苏糖醇(DTT)、8.0 mol/L盐酸胍、RPMI 1640培养基、0.25%胰蛋白酶/EDTA、色谱级甲酸和乙腈、嘌呤霉素、Opti-I还原型血清培养基(不含酚红)、非必需氨基酸(NEAA)、1×DPBS、胎牛血清购自美国ThermoFisher Scientific公司;三氟乙酸(TFA)、2-巯基乙醇购自美国Sigma-Aldrich公司;载体两性电解质Pharmalyte 3-10、8-10.5购自加拿大GE Healthcare公司;pI标志物5.85及9.22、1%甲基纤维素溶液、0.5%甲基纤维素溶液均购自美国ProteinSimple公司;质谱级胰蛋白酶、Steady-Glo荧光素酶检测试剂盒购自美国Promega公司;碳酸氢铵溶液、3-吗啉丙磺酸(MOPS)、N-糖苷酶F购自美国New England Biolabs公司,聚糖对氨基苯甲酰胺(2-AB)荧光标记试剂盒购自英国Ludger公司;乙酸铵、L-精氨酸、磷酸氢二钠、SDS-MW试剂盒购自美国Beckman Coulter公司,重组人IL-36抗原购自美国R&D Systems公司。
1.3 抗IL-36R单抗的特异性鉴别试验
采用基于胰蛋白酶酶切和反相高效液相色谱(reverse phase-high performance liquid chromatography,RP-HPLC)技术的肽图法对抗IL-36R单抗进行鉴别分析。用8 mol/L盐酸胍溶液将样品稀释到1.0 mg/ml。加入10 μl 1.0 mol/L DTT溶液并在室温孵育15 min以还原二硫键。加入25 μl 1.0 mol/L碘乙酸溶液并在室温下孵育15 min,然后加入50 μl 1.0 mol/L DTT溶液终止反应以完成SH基团的羧甲基化。使用NAP 10色谱柱进行缓冲液交换,以去除变性和还原试剂。用胰蛋白酶以1 ∶50的比例在室温下孵育4 h,酶切处理后的样品,在95 ℃孵育10 min终止反应。采用Agilent 1260 HPLC系统,Phenomenex Kinetex C18色谱柱分离。检测条件:流动相A为0.1%的TFA水溶液,流动相B为0.1%的TFA乙腈溶液,进行梯度洗脱(0~90 min,2%→45%流动相B;90~91 min,45%→95%流动相B;91~100 min,95%流动相B;100~101 min,95%→2%流动相B;101~115 min,2%流动相B),流速0.5 ml/min,上样体积75 μl,样品室温度4 ℃,柱温45 ℃,检测波长210 nm,检测时间115 min。
1.4 抗IL-36R单抗的纯度分析
采用还原/非还原十二烷基硫酸钠毛细管电泳(capillary electrophoresis-sodium dodecyl sulfonate,CE-SDS)法对抗IL-36R单抗进行纯度分析。用超纯水将样品稀释至10 mg/ml,取10 μl样品加入巯基乙醇10 μl和SDS样品缓冲液100 μl(还原),取20 μl样品加入碘乙酰胺溶液10 μl和SDS样品缓冲液100 μl(非还原),混匀后65 ℃水浴10 min,取80 μl上机分析。采用Beckman PA800 plus毛细管电泳系统和无涂层毛细管(总长度31 cm,有效长度10 cm)检测。检测条件:分离电压为15 kV,毛细管温度25 ℃,样品室温度15 ℃,检测波长214 nm,计算样品的重链+轻链(还原型)及主峰和低分子量物质(非还原型)峰面积百分比。
1.5 抗IL-36R单抗的纯度分析
采用分子排阻(size exclusion,SE)-HPLC法对抗IL-36R单抗进行纯度分析。取浓度为5 mg/ml的样品10 μl,采用Waters e2695高效液相色谱系统配备紫外检测器、TSKgel G3000 SWXL,PEEK色谱柱检测。流动相由200 mmol/L L-精氨酸和100 mmol/L磷酸氢二钠配制而成,pH为6.8,流速为0.5 ml/min,上样量10 μl,进样器温度5 ℃,柱温为室温,在波长280 nm处检测,使用面积归一化法计算单体和高分子量物质(HMWS)的百分比。
1.6 抗IL-36R单抗的电荷异质性分析
采用阳离子交换(cation exchange,CEX)-HPLC法对抗IL-36R单抗进行纯度分析。用流动相A将样品稀释至1 mg/ml,取50 μl上机分析。使用Waters e2695高效液相色谱系统配备紫外检测器和MAbpac SCX-10色谱柱检测。检测条件:流动相A为10 mmol/L MOPS溶液,pH 7.6,流动相B为10 mmol/L MOPS,100 mmol/L KCl溶液,pH 7.6,进行梯度洗脱(0~2 min,15流动相B;2~42 min,15%→70%流动相B;42~43 min,70%→100%流动相B;43~47 min,100%流动相B;47~48 min,100%→15%流动相B;48~57 min,15%流动相B),流速0.8 ml/min,检测波长280 nm,柱温20 ℃,样品室温度5℃。计算样品主峰、酸性峰组和碱性峰组的峰面积百分比。
1.7 抗IL-36R单抗的寡糖含量分析
采用亲水相互作用(hydrophilic interaction,HILIC)-HPLC法对抗IL-36R单抗进行寡糖图谱分析。用纯化水将样品稀释至6.9 μg/ml,取29 μl加入3 μl 10×糖基缓冲液和2 μl N-糖苷酶F,37 ℃孵育8 h。加入5 μl 2-AB试剂混匀后65 ℃孵育2 h。瞬时离心后使用Sep-Pak氨基丙基(NH2)滤芯进行纯化。纯化后样品经真空浓缩干燥后,加入80 μl纯化水复溶待测。采用Waters超高效液相色谱系统配备荧光检测器和Acquity UPLC Glycoprotein BEH Amide色谱柱检测。检测条件:流动相A由50% 0.05 mol/L乙酸铵和50%乙腈配制而成,流动相B为乙腈,进行梯度洗脱(0~0.3 min,56%→50%流动相B;0.3~25.3 min,50%→20%流动相B;25.3~25.31 min,20%流动相B→56%流动相B;25.31~32 min,56%流动相B),流速0.7 ml/min,进样器温度15 ℃,柱温60 ℃,进样量1 μl,激发波长330 nm,发射波长420 nm。计算6个特征性寡糖的峰面积百分比。
1.8 抗IL-36R单抗的生物学活性测定
采用报告基因法测定抗IL-36单抗的生物学活性。取对数生长期的检测用细胞,经0.25%胰蛋白酶/EDTA消化后,用测定培养基(含有1% NEAA的Opti-I还原型血清培养基)调整细胞密度至4×105个/ml,以50 μl/孔加入96孔板,于37 ℃,5% CO2培养过夜;用测定培养基稀释样品和参比品,以60 μg/ml为起始浓度,按照1 ∶2.5的比例依次稀释(共12个稀释度),以25 μl/孔加入对应孔中;再以25 μl/孔加入150 ng/ml的重组人IL-36抗原;37 ℃,5% CO2培养3 h。取平衡至室温的Steady-Glo溶液,以50 μl/孔加入对应孔中,室温避光震荡(550 r/min)孵育1 h,使用荧光酶标仪读板。采用四参数法,以样品和参比品浓度的对数为横坐标,以发光值为纵坐标,计算半效浓度(EC50,μg/μl)。样品相对效价按下列公式计算:
样品相对效价=参比品EC50/样品EC50×100%。
2 结果
2.1 抗IL-36R单抗的肽图鉴别结果
胰蛋白酶酶切结合RP-HPLC法肽图鉴别的代表性图谱见图1。目视观察,样品与参比品的肽图图谱无明显差异,表明该方法可以用作抗IL-36R单抗样品的有效鉴别。

图1 抗IL-36R单抗参比品与样品的肽图分析Figure 1 Peptide mapping of reference and sample of anti-IL-36R mAb
2.2 抗IL-36R单抗的纯度分析结果
非还原型CE-SDS分析表明,抗IL-36R单抗的主峰面积百分比为(98.05±0.17)%,6次实验的RSD值为0.17%;低分子量物质(LMWS)峰面积百分比为(1.72±0.07)%,6次实验的RSD值为4.07%(见图2)。还原型CE-SDS分析表明,抗IL-36R单抗的重链(HC)和轻链(LC)的峰面积百分比之和为(98.33±0.05)%,6次实验的RSD值为0.05%(见图2)。SE-HPLC分析表明,抗IL-36R单抗的主峰峰面积百分比为(99.53±0.01)%,6次实验的RSD值为0.01%;高分子量物质(HMWS)峰面积百分比为(0.43±0.01)%,6次实验的RSD值为2.33%(见图3)。

图2 抗IL-36R单抗非还原CE-SDS和还原CE-SDS纯度分析图谱Figure 2 Chromatograms of purity analysis of anti-IL-36R mAb by non-reduced and reduced CE-SDS

6条不同颜色代表6次重复实验的色谱图图3 抗IL-36R单抗SE-HPLC纯度分析图谱Figure 3 Chromatograms of purity analysis of anti-IL-36R mAb by SE-HPLC
2.3 抗IL-36R单抗的电荷异质性分析结果
CEX-HPLC分析表明,抗IL-36R单抗的主峰面积百分比为(61.47±0.79)%,6次实验的RSD值为1.29%;酸性峰组的峰面积百分比为(35.33±0.72)%,6次实验的RSD值为2.04%;碱性峰组的峰面积百分比为(3.19±0.12)%,6次实验的RSD值为3.76%(见图4)。
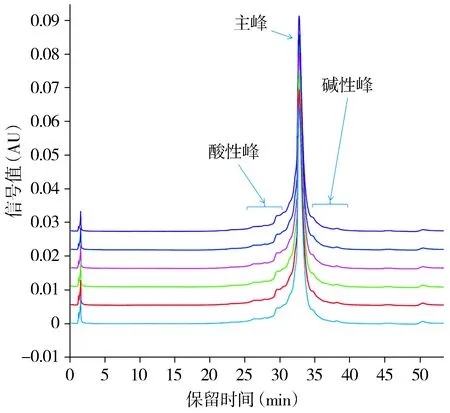
6条不同颜色的线条代表6次重复实验的色谱图图4 抗IL-36R单抗电荷异质性CEX-HPLC分析图谱Figure 4 CEX-HPLC chromatogram of charge heterogeneity of anti-IL-36R mAb
2.4 抗IL-36R单抗的寡糖图谱分析结果
HILIC-UPLC分析表明,抗IL-36R单抗峰1的峰面积百分比为(3.04±0.03)%,6次实验的RSD值为0.99%;峰2的峰面积百分比为(63.68±0.08)%,6次实验的RSD值为0.13%;峰3的峰面积百分比为(2.67±0.01)%,6次实验的RSD值为0.37%;峰4的峰面积百分比为(16.19±0.03)%,6次实验的RSD值为0.19%;峰5的峰面积百分比为(5.91±0.01)%,6次实验的RSD值为0.17%;峰6的峰面积百分比为(2.60±0.01)%,6次实验的RSD值为0.38%(见图5)。
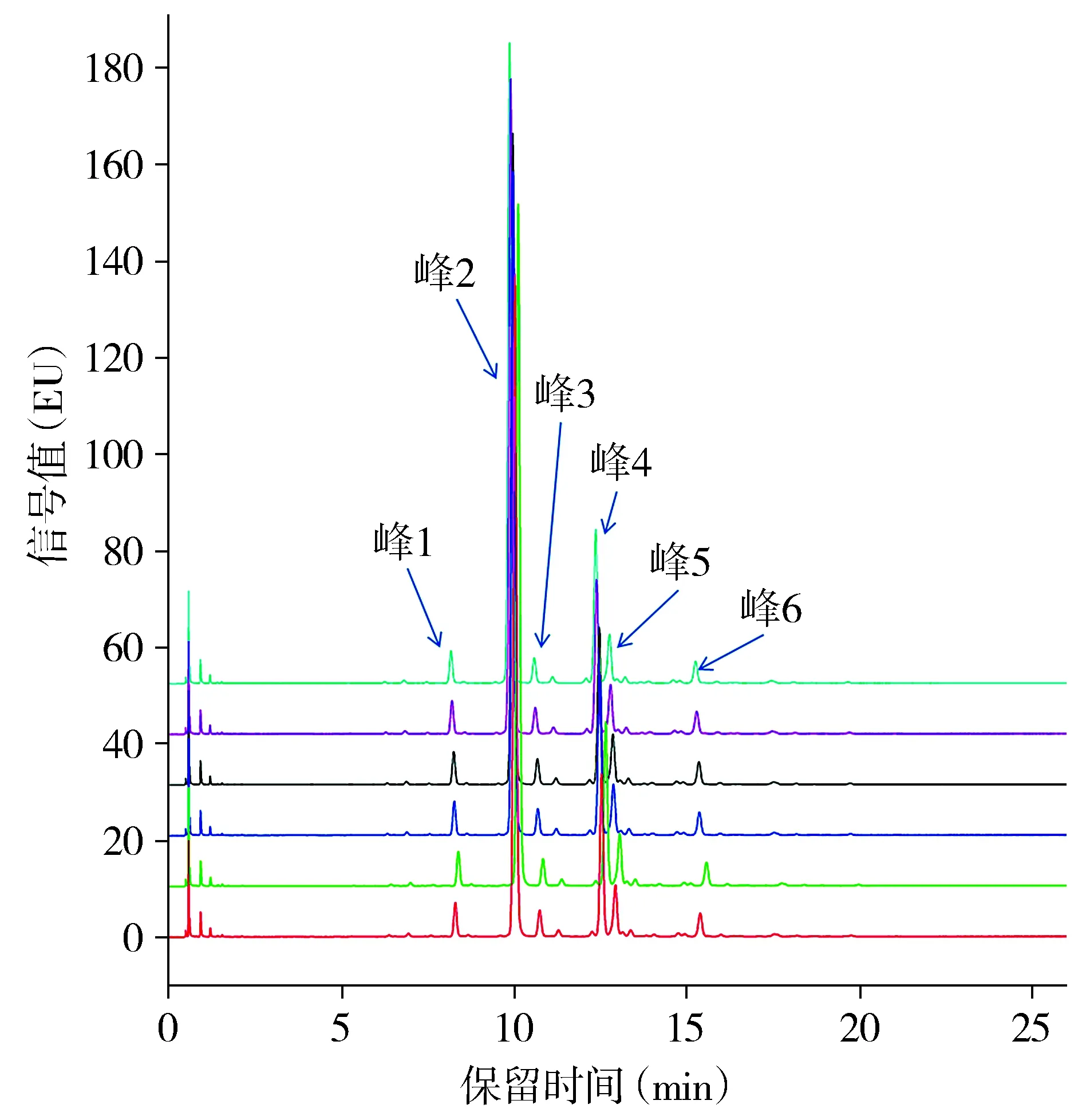
6条不同颜色的线条代表6次重复实验的色谱图图5 抗IL-36R单抗寡糖图谱分析图谱Figure 5 Oligosaccharide map profiling of anti-IL-36R mAb
2.5 抗IL-36R单抗的生物学活性检测结果
参比品和样品生物学测定所得数据均符合四参数方程式:Y=(A-D)/[1+(X/C)B]+D,即在半对数坐标上呈现典型的S型曲线(见图6)。抗IL-36R单抗样品的相对效价为(95.87±6.10)%,6次实验的RSD值为6.36%。
3 讨论
脓疱型银屑病(GPP)是一种不寻常的银屑病亚型,常常给临床治疗带来挑战。目前通常采用基于标准斑块状银屑病的现有疗法。最近,IL-36R抑制剂已经在GPP和PPP治疗显示出一定的疗效。针对GPP的新兴药物提供了快速有效治疗的可能性,其毒性低于现有疗法。对作用于IL-36通路的药物和其他靶向疗法的进一步研究有可能改变GPP患者的未来治疗[12]。本研究中使用的抗IL-36R单抗是IgG1亚类的Fc工程化人源化单克隆抗体,具有针对人IL-36R的κ轻链。重链和轻链的人源化可变区来源于针对IL-36R的小鼠单克隆抗体,并与人源IgG1/κ抗体恒定区重组。通过恒定Fc-结构域的遗传工程,位点234和235处的赖氨酸残基突变为丙氨酸残基。这导致Fc受体和补体结合活性及功能丧失,从而降低了诱导抗体依赖的细胞介导的细胞毒性作用(antibody-dependent cell-mediated cytotoxicity,ADCC)/补体依赖的细胞毒性作用(complement-dependent cytotoxicity,CDC)的风险[13]。

6条曲线上的数据标签代表在每个浓度点的6次重复检测数据图6 抗IL-36R单抗生物学活性测定的剂量反应四参数曲线图Figure 6 Dose-response curves of anti-IL-36R mAb binding activity
抗IL-36R单抗主要依靠受体结合抑制活性发挥生物学效应。抗IL-36R单抗通过结合并阻断细胞表面IL-36R,抑制可溶性IL-36的结合,从而阻止IL-36介导的细胞内NF-κB通路的激活及促炎基因的表达[14]。基于这个作用机理,本研究采用基于细胞的报告基因法来测定抗IL-36R单抗的抑制活性。与本实验室建立的其他基于报告基因的单抗生物学活性检测的原理相似,本实验中所用的报告基因细胞系含有NF-κB响应元件,该元件可调节下游荧光素酶的表达[15-17]。外源性添加的IL-36通过激活NF-κB通路来诱导荧光素酶表达。荧光素酶底物的添加导致形成化学发光产物,可以定量该产物。高浓度的抗IL-36R单抗可阻止IL-36激活IL-36R,从而降低荧光素酶活性,并且这种抑制作用具有剂量依赖性,可以在体外实验中真实地反映该抗体的生物学活性。
抗体药物的纯度检测和控制贯穿于工艺开发的整个生命周期中。本研究分别采用还原型和非还原型CE-SDS以及SE-HPLC两种分析方法对该抗体的纯度进行全面的质量控制[18]。根据不同方法检测原理的不同,在非还原型CE-SDS中,除了对主要物质(主峰)进行控制外,还对不完整抗体(非共价键连接的片段,即低分子量物质)的限度进行了控制。还原型CE-SDS主要控制主要成分(重链和轻链总和)。在某些以Fc效应为主的抗体的质量控制中,重链的糖基化也是考察要素之一[19],而抗IL-36R单抗发挥生物效应主要依靠其受体结合抑制活性,因此未对非糖基化重链进行专门的控制。SE-HPLC则除了对单体主要成分进行控制外,还将以共价和非共价形式结合的聚体进行了有效分离和控制。通过以上几种方法,本研究对抗IL-36R单抗的主要成分、片段和聚体进行了比较系统的分析和全面的质控。
由于不同类型单抗的区别主要在互补决定区(complementarity determining region,CDR),因此基于酶解的特征性肽图指纹图谱是一种有效快速的鉴别手段[20]。本研究采用了胰蛋白酶酶切结合RP-HPLC法对抗IL-36R进行鉴别。在此过程中,通过胰蛋白酶酶解赖氨酸和精氨酸的C端,将其分解成特定的肽段,使用RP-HPLC分离肽段并产生特征性指纹图谱,与对照品的蛋白水解片段进行同一性比较后完成鉴别。
由于蛋白翻译后修饰和降解而产生的电荷异质性属于治疗性抗体的关键质量属性(critical quality attributes,CQA),因此对于抗体药物电荷异质性的分析贯穿于抗体药物的全生命周期。由于造成抗体药物电荷异质性的原因错综复杂,现有的技术手段(IEF、cIEF、icIEF、CEX、RP-HPLC、LC-MS等)不足以高效准确地提供电荷异质性的分析表征。一些新兴的技术手段(如CE-MS联用等)不断出现[21]。但是考虑到仪器成本和实验室的可操作性,本研究选择离子交换色谱CEX-HPLC对不同的组分进行馏分,以便于进一步对不同馏分的鉴别。
糖基化是单抗重要的翻译后修饰之一,通常是在Fc段CH2结构域有1个N糖基化位点[22]。N糖基化修饰类型对单抗生物学功能十分重要,且可灵敏反应生产工艺的稳定性。因此,需先通过质谱的方法确定糖基化的类型,再使用高效液相色谱的方法进行糖基化的分析和质量控制。本文依据该抗IL-36R单抗的寡糖特点,用PNGase F酶促释放寡糖,用2-氨基苯甲酰胺(2-AB)进行标记,采用HILIC柱对标记的寡糖进行分析,并对峰面积排在前6位的寡糖相对含量进行控制。
综上所述,本研究根据现有技术,依据《中国药典》和ICH Q6B的指导原则,针对抗IL-36R单抗的质量控制开展的研究。根据抗IL-36R单抗产品的特性和作用机制,确定了关键质量属性并建立了基于不同原理的质控方法,对我国抗IL-36R单抗药物的研发具有借鉴意义。随着新技术的出现以及对该靶点作用机制更深入的研究,其质控方法也将会随之不断发生变化。

