锌螯合剂多吡啶配体对产金属β-内酰胺酶细菌抗生素耐药性的抑制作用
袁建平,曾云清,陈 敏,王 婷,蒋 宏
(1湖南省妇幼保健院院感科,长沙 410000;2湖南省妇幼保健院新生儿一科;3湖南省妇幼保健院检验科;4湖南省妇幼保健院感染控制科;*通讯作者,E-mail:573144897@qq.com)
近年来,随着抗菌药物的广泛应用,细菌耐药问题已构成全球的重大公共健康威胁[1,2]。我国革兰阴性杆菌耐药形势严峻,β-内酰胺类耐药肠杆菌目细菌增长趋势尤为迅速。研究显示,β-内酰胺类耐药菌感染患者菌血症发生率>30%,其死亡率显著高于β-内酰胺类药物敏感菌感染患者[3]。β-内酰胺类耐药肠杆菌的耐药机制主要为产生金属β-内酰胺酶(metallo-β-lactamase,MBL),可水解几乎所有β-内酰胺类抗生素,目前针对此类细菌感染的治疗药物十分稀缺[4]。因此,开发新型高效低毒的MBL抑制剂用于有效应对β-内酰胺类耐药肠杆菌感染显得尤为重要。MBL是一种锌离子金属酶[5],文献报道多种锌螯合剂如乙二胺四乙酸、N,N,N′,N′-四(2-吡啶甲基)乙二胺[N,N,N′,N′-tetrakis(2-pyridymethyl)ethylenediamine)TPEN]等可作为MBL的锌“剥离剂”,取代MBL催化位点中锌离子(Zn2+)共享的氢氧根离子(OH-),形成三元络合物,恢复β-内酰胺类药物的抗菌活性[6]。此外,锌螯合剂与常规抗生素联合治疗可产生协同作用,降低抗生素对细菌的最低抑菌浓度(minimum inhibitory concentration,MIC)并恢复敏感性[7,8]。鉴于此,本研究基于乙二胺骨架设计并合成多种可形成三元络合物的新型多吡啶配体,研究它们恢复美罗培南(meropenem,MEM)对临床产MBL细菌体外抗菌效应的能力。
1 材料与方法
1.1 仪器与试剂
1.1.1 菌株 收集2020年10月至2021年10月湖南省妇幼保健院住院患者检验科送检β-内酰胺类耐药肠杆菌感染阳性痰液标本35份,并分离3种产MBL临床菌株:产新德里金属β-内酰胺酶1(New Dlehi metallo-β-lactamase-1,NDM-1)肺炎克雷伯菌(LC954/14)[9]、产L1型金属β-内酰胺酶嗜麦芽葡萄球菌(LC669/17)[10]和产VIM型金属β-内酰胺酶(verona integron-encoded metallo-β-lactamase,VIM)梭状芽孢杆菌(LC1341/19)[11]。通过纸片扩散法对分离菌株进行抗菌药敏试验,根据美国临床实验室标准化委员会(Clinical Laboratory and Stardards Institute,CLSI)制定的标准判读结果,筛选对MEM耐药的菌株。用VITEK分析仪进行细菌鉴定。
1.1.2 实验试剂及仪器 实验试剂:1-羟基苯并三唑(HOBt,货号54802)、1-乙基-3(3-二甲氨基丙基)碳二亚胺(EDC,货号:39391)、2-吡啶甲醛(货号:P62003)和TPEN(货号:697168)均购自美国Sigma公司;D-Ala-D-Ala-D-Ala(货号:4004970)购自Bachem公司;小牛胸腺DNA(CtDNA,货号:D8020)购自北京索莱宝公司;MEM(规格:100 mg,批号:30506-200702)购自中国食品药品检定研究院;外周血淋巴细胞(PBL A和B)购自美国ATCC细胞库。
实验仪器:细胞培养箱(美国Thermo公司,型号:3111);超净工作台(苏州净化安泰公司,型号:BS-1300IIA2);光学显微镜(美国OLYMPUS公司,型号:CKX41);培养皿(德国Greiner bio-one公司);ShimadzuAffinity-1型傅里叶红外光谱仪(德国SPECTRO公司,型号:IRAffinity-1),VITEK 2 DENSICHEK比浊仪(法国生物梅里埃公司,型号:21250)。
1.2 目标锌配体的合成
N,N′-二(2-吡啶甲基)-乙二胺[N,N′-di(2-pyridylmethyl)-ethylenediamine,Bispicen]、N,N,N′-三(2-吡啶甲基)-乙二胺[N,N,N′-tris(2-pyridylmethyl)-ethylenediamine,Trispicen]、N,N′-二(2-吡啶甲基)-乙二胺-N′-乙酸[N,N′-di(2-pyridylmethyl)-ethylenediamine-N′-acetic acid,BispicenA]和N,N,N′-三(2-吡啶甲基)-乙二胺-N′-醋酸[N,N,N′-tris(2-pyridylmethyl)-ethylenediamine-N,TrispicenA]的合成方法参考文献报道[12-14],配体结构见图1。

图1 合成多吡啶配体结构Figure 1 Synthetic polypyridine ligand structure
1.2.1 合成Bispicen 将乙二胺(0.60 g,10 mmol)溶于甲醇溶液(10 ml)中,加入吡啶-2-甲醛(2.14 g,20 mmol),室温搅拌5 h。继续加入溶有10 ml硼氢化钠(1.52 g,40 mmol)的甲醇溶液并回流过夜。真空减压蒸发溶剂,用二氯甲烷(150 ml×3)萃取固体,得到白色油状固体Bispicen(1.99 g,8.21 mmol),冷冻干燥得到白色粉末状产物,产率82%。1H NMR(500 MHz,D2O)δ:8.19 d,J=4.6 Hz,2H,H-6 Py),7.58(t,J=7.7 Hz,2H,H-4 Py),7.15(d,J=7.9 Hz,2H,H-3 Py),7.09(dd,J=5.3 Hz,J=7.5 Hz 2H,H-5 Py),3.57(s,4H,CH2Py),2.49(s,4H,CH2NH)。ESI-MS:m/z=243.1[M+H]+,265.2[M+Na]+。
1.2.2 合成Trispicen 将吡啶-2-甲醛(0.66 g,6.15 mmol)溶于20 ml乙醚溶液中,加入Bispicen(1.49 g,6.15 mmol),室温搅拌过夜。过滤白色沉淀物,乙醚洗涤后将其溶解于10 ml含有氰基硼氢化钠(0.096 g)和三氟乙酸(1 ml)的甲醇溶液中,室温搅拌8 h。加入65 ml的氢氧化钠(15%)水溶液,搅拌过夜。真空减压蒸发溶剂,用二氯甲烷(150 ml×3)萃取固体,得到黄色油状固体Trispicen(0.44 g),冷冻干燥得到黄色晶体,产率85%。1H NMR(500 MHz,D2O)δ:8.19(d,J=5.0 Hz,1H,H-6’ Py),8.15(d,J=5.0 Hz,2H,H-6 Py),7.58(t,J=7.7 Hz,1H,H-4’ Py),7.52(t,J=7.7 Hz,2H,H-4 Py),7.16(d,J=7.8 Hz,2H,H-3 Py),7.09(m,4H,H-3′,H-5和H-5′ Py),3.44(s,6H,CH2Py),2.44(t,J=6.1 Hz,2H,CH2N),2.33(t,J=6.1 Hz,2H,CH2N)。ESI-MS:m/z=334.2[M+H]+,356.2[M+Na]+。
1.2.3 合成BispicenA 将溴乙酸叔丁酯(0.42 g,2.15 mmol)溶于5 ml乙腈溶液内,加入Bispicen(0.52 g,2.15 mmol)和碳酸钾(0.50 mg,3.6 mmol)室温回流过夜。过滤碳酸钾,剩余沉淀物用乙腈洗涤。真空减压蒸发溶剂,通过闪蒸气相色谱法(硅胶柱)纯化残渣;以乙酸乙酯/甲醇洗脱剂按体积比(1 ∶0,2 ∶1,3 ∶1)梯度洗脱;并用三氟乙酸(2 ml)搅拌水解丁基酯。12 h后,真空减压蒸发溶剂,用Sephadex DEAE A-25(HCO3-)柱以水为洗脱剂纯化产物;得到白色油状物BispicenA(0.13 g,0.53 mmol),冷冻干燥得到白色晶体,产率20%。1H NMR(500 MHz,D2O)δ=8.48(d,J=5.7 Hz,1H,H-6 Py),8.36(d,J=5.9 Hz,1H,H-6 Py B),8.27(t,J=7.9 Hz,1H,H-4 Py),8.22(t,J=8.0 Hz,1H,H-4 Py B),7.81(d,J=8.0 Hz,1H,H-3 Py B),7.72(t,J=8.0 Hz,1H,H-5 Py),7.63(dd,J=15.0,7.6 Hz,2H,H-5 py和H-3 Py B),4.65(s,2H,CH2Py),4.23(s,2H,CH2Py),3.53(s,2H,CH2CO),3.43(t,J=5.5 Hz,2H,CH2N),3.13(t,J=5.5 Hz,2H,CH2N).ESI-MS:m/z=301.2[M+H]+,323.2[M+Na]+。
1.2.5 合成D-Ala-D-Ala-D-AlaOCH3以三肽D-Ala-D-Ala-D-AlaOCH3(0.1 g,0.43 mmol)为原料,溶于2 ml 甲醇溶液,0 ℃搅拌加入1 ml乙酰氯,合成D-Ala-D-Ala-D-AlaOCH3。4 h后蒸发溶剂,产物溶于水,用闪蒸气相色谱法(DEAE Sephadex A-25)提纯。1H NMR光谱验证新形成的酯上是否存在OCH3基团。1H NMR(500 MHz,D2O)δ:4.25(q,J=7.3 Hz,1H,CH);4.14(q,J=7.2 Hz,1H,CH);3.59(s,3H,OCH3);3.42(q,J=6.9 Hz,1H,CH);1.26(d,J=7.5 Hz,3H,CH3);1.24(d,J=7.4 Hz,3H,CH3);1.14(dd,J=13.9,6.7 Hz,3H,CH3)。
1.2.6 合成N,N,N′-三(2-吡啶甲基)-乙二胺-N′-乙酰-D-丙氨酰-D-丙氨酰-D-丙氨酸甲酯(TrispicenDAla) 将HOBt(0.093 g,6.2 mmol)和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC,0.117 g,6.2 mmol)溶于N,N-二甲基甲酰胺(DMF)溶液中,搅拌加入TrispicenA(0.159 g,4.1 mmol)。15 min后,加入D-Ala-D-Ala-D-AlaOCH3(0.1 g,4.1 mmol)和三乙胺(0.057 ml,4.1 mmol),室温搅拌12 h。使用RP C18色谱柱和水/乙腈线性梯度对反应混合物进行闪蒸气相色谱法纯化。得到的固体在相同条件下再次纯化。冷冻干燥,得到黄色晶体TrispicenDAla(0.02 g,0.55 mmol),产率85%。1HNMR(500 MHz,D2O)δ8.28(d,J=4.8 Hz,2H,H-6 Py),δ7.66(q,J=6.6 Hz,3H,H-4和H-6′ Py),δ7.30(d,J=7.8 Hz,2H,H-3 Py),δ7.22(m,5H,H-4′,H-3′,H-5和H-5′ Py),δ4.24(q,J=7.2 Hz,1H,CH Ala),δ4.13(q,7.1 Hz,1H,CH Ala);4.11(q,J=7.2 Hz,1H,CH Ala),δ3.74(s,2H,CH2CO),δ3.66(s,4H,CH2Py),δ3.63(s,3H,OCH3),δ3.60(s,2H,CH2Py),δ2.55(m,2H,CH2CH2N),δ2.52(m,2H,CH2CH2N),δ1.28(d,J=7.3 Hz,3H,CH3D-Ala),δ1.24(d,J=7.2 Hz,3H,CH3D-Ala),δ1.18(d,J=7.1 Hz,3H,CH3D-Ala)。
1.3 观测指标
1.3.1 分光光度法测定并计算锌配体的稳定常数(K) 在96孔板中加入金属离子和配体混合溶液200 μl,组成比为M(金属离子溶液) ∶L(配合物溶液)=1 ∶1,在340 nm(Zn)波长下测定吸光度。根据稳定性常数K计算公式:K=(1-a)/b·a2,其中a为M浓度;b为L浓度,计算它们的稳定常数对数值(logKML)。
1.3.2 核磁共振氢谱(1H NMR)检测TrispicenA与Zn2+的络合作用 适量配置溴化乙锭(EB,1.0 mmol/L),Ct-DNA(1.0 mmol/L)和TrispicenA(0.2 mmol/L)溶液备用。在10 ml规格比色皿中加入1 ml Tris缓冲液(0.01 mol/L,pH=7.0),利用微量移液枪加入5 μl预先配置好的EB溶液,混合均匀后室温放置2 h。随后分别加入适量TrispicenA和TrispicenDAla溶液并用超纯水稀释至10 ml,使TrispicenA的浓度依次为0,2,4,6 μmol/L。10 min后利用傅里叶红外光谱仪在不同的Zn/TPEN摩尔比下,获取[Zn(TPEN)]2+复合物核磁共振氢谱;用0.1 mol/L ZnCl2滴定TrispicenA溶液(pH=7.4),红外光谱仪绘制滴定后混合溶液光谱,检测TrispicenA与Zn2+的络合作用。
1.3.3 黄酰罗丹明B(SRB)法检测锌配体细胞毒性 采用SRB法测定锌配体抑制外周血淋巴细胞生长活性的半抑制浓度(IC50)。取对数生长期的外周血淋巴细胞(PBL A和B),胰酶消化,调整细胞浓度为3×104个/ml,细胞接种于96孔板,每孔加入180 μl细胞悬液和20 μl待测样品,以20 μl培养基作为阴性对照。培养72 h后,加入50 μl 50%冷三氯醋酸固定细胞,4 ℃放置1 h后,蒸馏水洗涤5次,室温干燥。加入4 mg/ml SRB溶液(100 μl/孔),室温孵育30 min,去上清,1%冰醋酸洗涤5次。加入10 mmol/ml的Tris溶液(200 μl/孔),酶标仪测定570 nm处的吸光度(A),按照细胞生长抑制率(%)=(1-A样品组/A对照组)×100%计算样品对细胞生长的抑制率。IC50值通过SigmaPlot 10.0软件采用非线性曲线拟合的方法计算获得。
1.3.4 标准微量肉汤稀释法检测锌配体MIC 通过标准微量肉汤稀释法检测6种锌配体(TPEN、TrispicenDAla、TrispicenA、BispicenA、Trispicen和Bispicen)对分离菌株的MIC值。各实验菌株接种于水解酪蛋白胨(mueller hinton agar,MH)肉汤,37 ℃孵育8 h。用生理盐水将菌液调至0.5麦氏比浊标准,MH肉汤稀释100倍至含菌量为1.5×105CFU/ml。在无菌96孔聚苯乙烯U型微量板中接种100 μl/孔菌液,第1孔加入不含锌螯合剂的菌液为阳性对照,第2孔加入无菌液培养基为空白对照,第3~12孔加入含有上述锌螯合剂的MH肉汤100 μl/孔,药物终浓度依次为128,64,32,16,8,4,2,1,0.5,0.25 μmol/L,震荡混匀1 min,加盖密封后,置湿盒内37 ℃培养24 h后检测菌液OD600值。以实验孔中无细菌生长的最低浓度为该锌配体的MIC值。
1.3.5 棋盘法联合抑菌实验检测MEM和锌配体之间的协同作用 将分离菌株分别接种到MH肉汤培养基中增菌6 h,使用比浊仪校正菌液浊度至1.5×105CFU/ml。将MEM和6种锌配体用MH肉汤分别配制成1 280 μg/ml母液,再进行10级倍比稀释,浓度依次为128,64,32,16,8,4,2,1,0.5,0.25 μg/ml。每种锌配体和MEM取1 ml两两组合加入96孔板中,按上述方法分别测定单一用药和联合用药的MIC值。协同作用定义为要求2种抗生素联合使用时的MIC比单独使用时减少4倍,并测量分级抑制浓度指数(fractional inhibitory concentration index,FICI)。每个组合的FICI是用以下公式计算的:FICI=FICA+FICB,其中FICA=联合使用药物A的MIC/单独使用药物A的MIC;FICB=联合使用药物B的MIC/单独使用药物B的MIC。FICI的解释如下:协同作用,FICI≤0.5;无差异,0.5
2 结果
2.1 计算合成锌配体的稳定常数
TPEN和Bispicen的稳定常数计算值与实验值非常相似,而BispicenA、Trispicen和TrispicenA稳定常数范围为13.3~15.6,5种配体稳定性均较好(见表1)。

表1 TPEN、Bispicen、BispicenA、Trispicen和TrispicenA的稳定常数Table 1 Stability constants for TPEN, Bispicen, BispicenA, Trispicen, and TrispicenA
2.2 1H NMR研究TrispicenA与Zn2+的络合反应
用ZnCl2溶液滴定pH=7.4的TrispicenA+D2O溶液,结果发现,当加入锌时,代表锌复合物的新信号与自由配体信号一起出现在光谱中(见图2)。在芳香族区域,新的信号出现在8.74,8.08,7.99,7.81 ppm;在脂肪族区域,出现了4.02,3.90,1.10,1.02 ppm的新信号。
2.3 合成锌配体的细胞毒性
TPEN、Trispicen、TrispicenA和Bispicen显示了药理学上的抗增殖活性,IC50范围为(4.91±0.12)μmol/L至(17.8±4.1)μmol/L。而BispicenA和TrispicenDAla的IC50值均大于100 μmol/L,未产生细胞毒性(见表2)。
2.4 合成锌配体的抗菌活性
标准微量肉汤稀释结果显示:TPEN、TrispicenDAla、TrispicenA和BispicenA对3种菌株的MIC值较高,分别为256 mg/L,>256 mg/L,512 mg/L,>512 mg/L。而Trispicen、Bispicen仅在产NDM肺炎克雷伯菌和产VIM梭状芽孢杆菌中观察到较高MIC值,分别为256 mg/L和64 mg/L(见表3)。
2.5 MEM与合成锌配体的协同作用
棋盘法联合抑菌实验结果显示,MEM和TrispicenDAla、TrispicenA、Trispicen、TPEN之间FICI均小于0.5,对所有测试的分离菌株均有协同活性(见表4);而BispicenA-MEM在所有菌株中均无协同作用,Bispicen-MEM仅在产NDM肺炎球菌和产VIM梭状芽孢杆菌中FICI小于0.5,在产L1嗜麦芽葡萄球菌中也无协同作用。
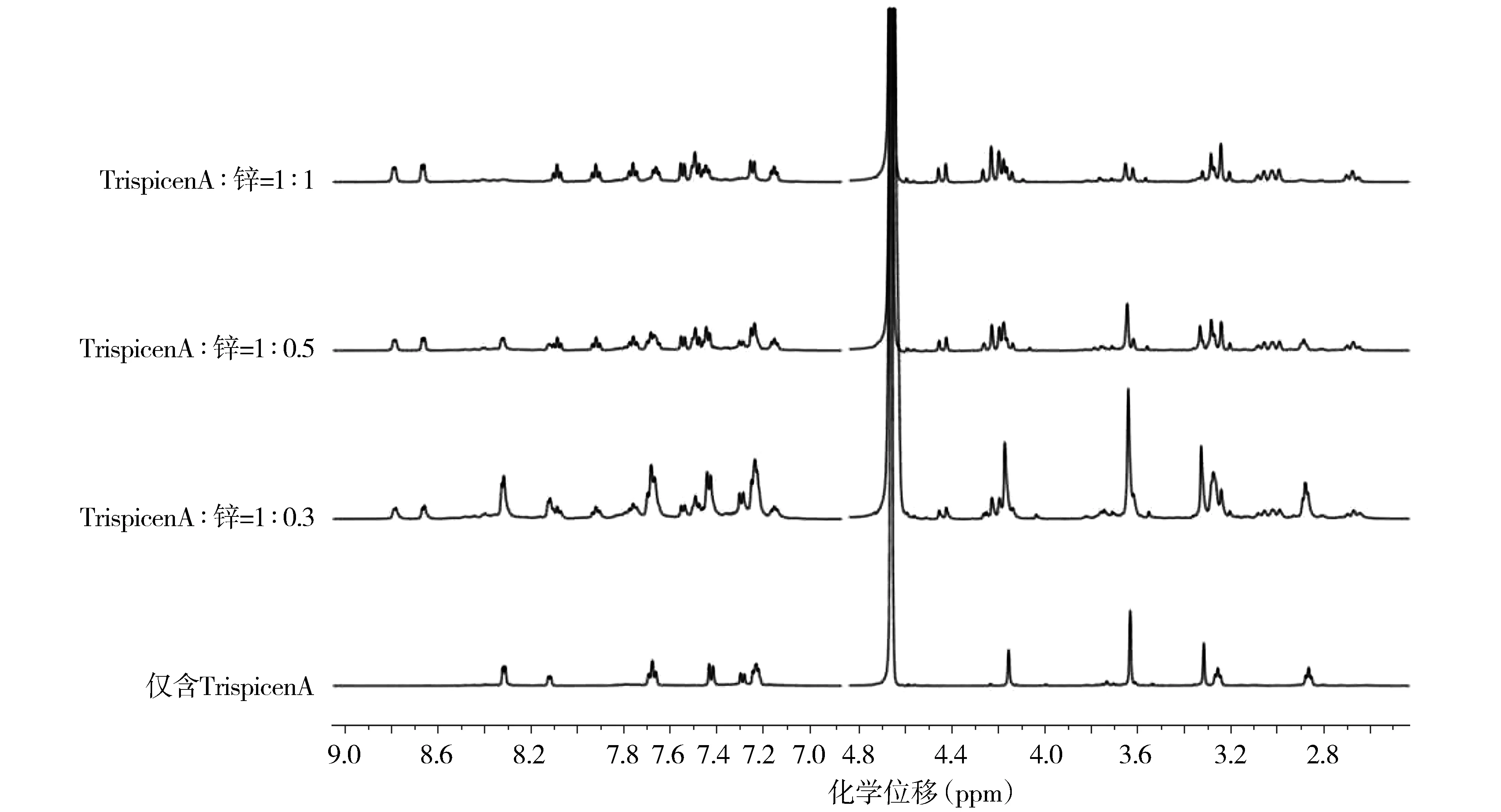
图2 D2O(pH7.4)1H NMR光谱 (500 MHz)Figure 2 D2O (pH 7.4) 1H NMR spectrum (500 MHz)
表2 TPEN、Trispicen、TrispicenA、Bispicen、BispicenA和TrispicenDAla抑制人外周血淋巴细胞的Table 2 IC50 of TPEN, Trispicen, TrispicenA, Bispicen, BispicenA and TrispicenDAla to peripheral blood
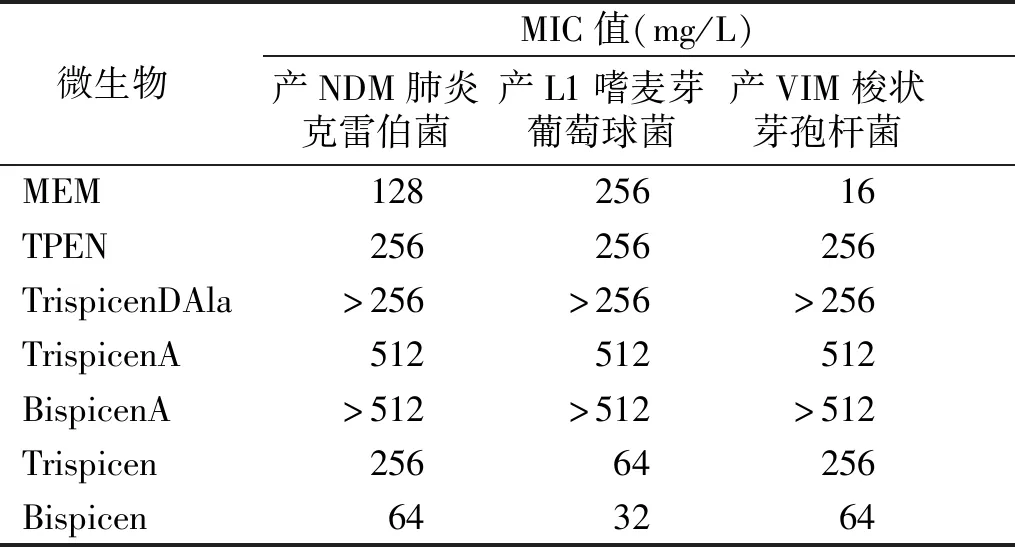
表3 MEM、TPEN、Bispicen、BispicenA、TrispicenDAla、Trispicen和TrispicenA的抗菌活性Table 3 Antibacterial activities of MEM, TPEN, Bispicen, BispicenA, TrispicenDAla, Trispicen and TrispicenA
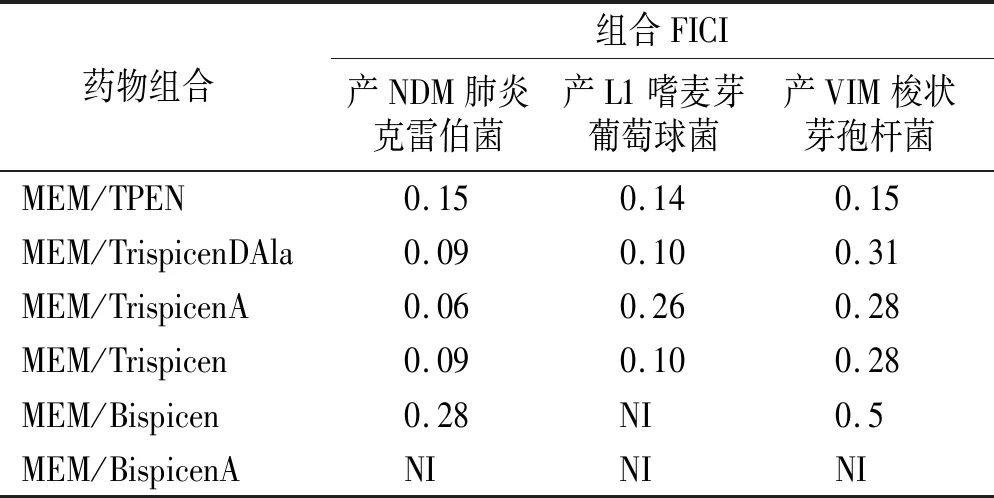
表4 FTPEN、Bispicen、BispicenA、Trispicen、TrispicenDAla和TrispicenA与MEM的协同作用Table 4 Synergistic effect of TPEN, Bispicen, BispicenA, Trispicen, TrispicenDAla and TrispicenA with MEM by FICI
3 讨论
MBL肠杆菌在全球蔓延,这对β-内酰胺类抗生素治疗细菌感染的持续临床效用构成了重大威胁。探索一种能够使MBL失去活性,从而保持β-内酰胺类药物有效性的新药,临床抗炎治疗具有重要的实际意义。常用的对抗MBL介导日益增加耐药性的策略是确定耐MBL的β-内酰胺类药物或MBL抑制剂,进而保护β-内酰胺药物免遭水解[1]。最近的研究表明,Zn2+配体可作为抗生素的佐剂用于临床治疗,恢复β-内酰胺的抗菌活性[15]。参考文献报道[6-8],本研究通过还原胺化反应合成了Bispicen和Trispicen,并使用溴乙酸叔丁酯进行烷基化合成基于乙二胺骨架的多种可形成Zn络合物的新型多齿聚吡啶配体,进一步探讨其在产VIM-1、NDM-1(B1 MBL)和L1(B3 MBL)革兰阴性细菌中的作用。
稳定性常数的调节对于配体的选择非常重要,不稳定配体可与宿主细胞中必需金属蛋白的金属离子发生络合反应[16]。TPEN是一种膜渗透性Zn2+螯合剂,广泛应用于多种生物学领域,它和Bispicen与Zn2+的稳定常数已有报道[17]。本研究中,基于Hancock等[18]成功使用的供体组加性,计算出各种合成锌螯合剂的KZnL值。结果发现,TPEN和Bispicen的KZnL计算值与报道的实验值非常相似[17]。Trispicen的计算常数与Trispicen甲基衍生物的计算常数也基本一致(logKZnL=13.3)[19],这说明本研究的合成方法是可行的。
由于金属的配位作用,络合作用产生信号的偏移,所有的亚甲基质子出现不同的化学位移,减少了配体的构象自由。Bispicen、Trispicen和TPEN已有类似的研究报道[6-8]。本研究通过1H NMR光谱研究TrispicenA与Zn2+的络合反应,结果发现,当加入锌时,代表锌复合物的新信号与自由配体的信号一起出现在光谱中,出现了由吡啶环的质子引起的12个信号。以上结果表明,这些化合物均具有稳定的化学结构。
TPEN在癌细胞中的毒性值已有报道,并认为锌离子螯合是产生细胞毒性的主要机制[20,21]。本研究结果发现,6个合成配体中有4个显示了药理学意义上的抗增殖活性,IC50从(4.91±0.12)μmol/L到(17.8±4.1)μmol/L,且Bispicen显示出比Trispicen和TrispicenA更低的毒性,而BispicenA和TrispicenDAla对受刺激的PBLs没有显示出细胞毒性。这些结果表明,与TPEN或TrispicenA相比,用D-Ala-D-Ala-D-AlaOCH3多肽进行功能化(TrispicenDAla)降低了配体的抗增殖活性,肽残基可能会改变配体的亲油性,并降低其毒性。
在其他含有羧酸基团的配体研究中发现,COOH基团可以改善与MBL活性部位的相互作用[22]。本研究对TrispicenA也用D-Ala-D-Ala-D-AlaOCH3肽进行功能化,目的是提高对细菌的选择性。通过协同作用检测试验,本研究发现MEM和TrispicenDAla、TrispicenA、Trispicen和TPEN对所有测试的分离菌株有协同活性。相反,Bispicen-MEM的组合只对产NDM的肺炎杆菌和产VIM的梭菌有协同作用。这种协同作用表明,配体可以穿过革兰阴性菌细胞壁,进入MBL所在的外周胞质,并抑制MBL的活性。与单独使用MEM相比,MEM在配体存在下的MIC值下降,特别是这些协同作用恢复了MEM的抗菌活性,使MIC值下降8~128倍,显著低于敏感性断点(2 mg/L)。Trispicen和TrispicenA是最有效的配体,与单独使用MEM相比,显示出非常低的MIC值和FICI(<0.1)。Bispicen在产L1嗜麦芽菌中没有显示出任何协同活性,而嗜麦芽菌的细胞膜相对不透水,这可能解释了TrispicenA对嗜麦芽菌的作用较小和Bispicen缺乏协同活性的情况。
在产VIM-1和NDM-1细菌中,本研究没有观察到配体的协同作用对锌复合物稳定常数有很强的依赖性。logKZnL=11.4的Bispicen和logKZnL=13.3的Trispicen可有效恢复MEM活性。与Trispicen相比,TrispicenDAla中的分子D-Ala-D-Ala-D-AlaOCH3对研究菌体的增效作用没有提高。TrispicenDAla对肺炎克雷伯菌的作用与TPEN相似,对其他临床菌株的作用略小,而且TrispicenDAla在人体细胞中是无毒的,这一数据可以为体内实验研究配体的选择提供重要依据。
综上所述,合成的锌螯合剂多吡啶配体Trispi-cenDAla、TrispicenA、Trispicen、Bispicen和TPEN在极低浓度下即可有效恢复美培南的抗菌活性。用D-Ala-DAla-DAlaOCH3多肽进行功能化的Trispicen(TrispicenDAla)可显著降低Trispicen分子的细胞毒性。基于乙二胺骨架的功能化锌螯合剂与β-内酰胺类药物联合使用,可能成为治疗产MBL细菌引起院感的重要手段。

