炎性指标预测食管鳞癌根治性同步放化疗患者生存预后的价值研究
刘子豪, 陆锡燕, 靳晓伟, 江 凡, 吴瑶瑶, 黄栎有
食管癌是临床上常见的恶性肿瘤,鳞状细胞癌是我国食管癌的主要病理类型[1]。随着临床诊疗技术的进步以及早癌筛查的逐渐普及,近年来我国食管癌发病率有所减低[2],但发病率依然位居男性新发肿瘤第5位,死亡率为全性别第4位[3-4]。食管癌具有起病隐匿、发病年龄大、常合并其他疾病等特点,超过半数的食管癌患者在确诊时已失去手术机会[5-6],故根治性同步放化疗成为其治疗的主要方法。然而,放化疗治疗周期较长,患者在治疗过程中亦面临放射性食管炎以及较高的营养风险[7]。炎症反应是临床中影响食管癌根治性放化疗患者治疗进度的主要因素,绝大多数食管癌患者在接受根治性放疗的过程中均需要针对放射性炎症进行积极干预[8]。因此,寻找能反映食管鳞癌患者炎症水平且具有较强诊断效能的预后预测因子,对于改善食管癌患者的预后以及治疗过程中的生存质量具有重要意义[9]。食管癌患者在疾病进展过程中,尤其是接受根治性治疗中,经常出现营养不良以及免疫抑制,继而影响患者的生存质量、治疗进度以及疾病预后。系统免疫炎症指数(systemic immune inflammation index,SII)被报道在多种肿瘤中作为手术患者的预后预测指标[10],而基于血清白蛋白水平和淋巴细胞绝对值的预后营养指数(prognostic nutritional index,PNI),最初是用于评估胃肠道肿瘤患者围术期的免疫营养状况及并发症出现的风险,并与其长期预后相关[11]。而中性粒细胞-淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、血小板-淋巴细胞比值(platelet to lymphocyte ratio,PLR)和淋巴细胞-单核细胞比值(lymphocyte to monocyte ratio,LMR)曾被报道与多种肿瘤的长期预后相关[12-13],而目前有关食管鳞癌放疗前后外周血炎性指标水平变化与放疗不良反应及远期疗效关系的报道较少。因此,本文旨在探究SII、PNI、NLR、PLR和LMR与食管鳞癌临床病理特征的关联性,比较各项炎性指标评估食管鳞癌根治性同步放化疗后患者预后的价值,建立一种结合临床指标及免疫炎性指标的预测模型,为临床中食管鳞癌根治性同步放化疗患者的管理和预后预测提供数据支持。
1 资料与方法
1.1一般资料 回顾性分析2016年1月至2017年12月于徐州医科大学附属宿迁医院肿瘤科行根治性同步放化疗的154例食管癌患者的临床资料。其中男102例,女52例,年龄43~80岁,中位年龄69岁。治疗前上消化道钡餐造影显示病变长度为1.5~15.0 cm,中位病变长度为4.9 cm。病变长度<5 cm者81例,5~7 cm者63例,>7 cm者10例。放疗前胸部增强CT检查发现合并淋巴结转移者85例。本研究经医院医学伦理委员会批准(2021076)。
1.2纳入与排除标准 纳入标准:(1)经病理检查证实为食管鳞状细胞癌,且因患者意愿、其他合并症等原因已无法行手术切除;(2)至少有一个可测量病灶;(3)按2010年国际抗癌联盟(Union for International Cancer Control,UICC)及美国癌症联合会(American Joint Committee on Cancer,AJCC)食管癌临床分期标准[14]为Ⅱb~Ⅳ期;(4)首次接受根治性同步放化疗,并按计划完成治疗过程;(5)年龄≤80岁,美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分[15]≤2分;(6)放疗前1周内血常规及大生化检查结果资料完善;(7)随访资料完整,终点事件及状态明确。排除标准:(1)合并免疫性疾病,如类风湿、系统性红斑狼疮等;(2)治疗前1个月内患有感染性疾病;(3)有远处转移灶。
1.3根治性放疗 (1)定位及靶区勾画:患者取仰卧位,以头颈肩膜热塑模固定,激光灯摆位,西门子SOMATOM Confidence大孔径CT模拟机增强扫描定位,扫描层厚5 mm。采用Varian Eclipse治疗计划系统,加速器型号为Varian Clinac iX。具有高级职称的放疗医师对靶区进行勾画,包括肿瘤区(gross tumor volume,GTV)、临床靶区(clinical target volume,CTV)、计划靶区(planning target volume,PTV)及危及器官(organ at risk,OAR)。均采用调强放疗技术(intensity-modulated radiation therapy,IMRT)。(2)各危及器官限量为:脊髓Dmax≤45 Gy,双肺V20≤30%,心脏V30≤40%,V40≤30%,肝脏V30≤40%,胃V40≤50%,首次治疗及每周均进行3D锥形束CT位置验证。95% PTV总剂量为60~66 Gy,分次剂量1.8~2.25 Gy/次,1次/d,5次/周,治疗5次,休息2 d。整个治疗根据总剂量在6~8周内完成。
1.4同步化疗 根据《中国临床肿瘤学会(CSCO)食管癌诊治指南》[16]开展同步化疗,方案为紫杉醇(扬子江制药)+卡铂(齐鲁制药),顺铂(江苏豪森)+5-FU(山西普德)或卡培他滨(上海罗氏)单药,同步化疗2~6周期。
1.5研究指标及计算方法 所有血液标本均取自患者接受治疗前1周内,血常规检测仪器为SYSMEX XN-2000,生化仪为Beckman Coulter AU-5800,均使用原厂试剂。SII=血小板计数×中性粒细胞计数/淋巴细胞计数;NLR=中性粒细胞计数/淋巴细胞计数;PLR=血小板计数/淋巴细胞计数;LMR=淋巴细胞计数/单核细胞计数;PNI=血清白蛋白+5×外周血淋巴细胞总数。
1.6随访 治疗完成后2年内,每3个月随访1次;之后每6~12个月随访1次。入组患者均获得随访,随访形式为电话、微信平台、门诊等。随访截止日期为2021年12月20日,随访时间为4~60个月,中位随访时间为17.8个月。主要观察指标为总生存期(overall survival,OS)。
1.7统计学方法 应用SPSS20.0统计软件进行数据分析。计数资料以例数(百分率)[n(%)]表示,组间比较采用χ2检验。采用ROC曲线评估SII、NLR、PLR、LMR、PNI预测患者预后的能力。采用Kaplan-Meier法绘制生存曲线,采用log-rank检验比较组间生存预后。采用Cox回归模型分析影响患者预后的因素。采用R软件建立生存期的列线图模型。P<0.05为差异有统计学意义。
2 结果
2.1治疗前炎性指标水平对患者生存预后的预测价值 以生存为结局事件进行ROC曲线分析,结果显示治疗前SII、NLR、PLR、LMR及PNI水平均能有效预测患者的生存预后(P<0.05)。见图1,表1。
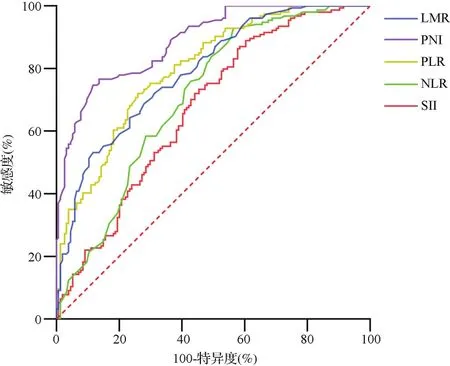
图1 各炎性指标预测患者生存预后的ROC曲线分析结果图

表1 各炎性指标预测患者生存预后的ROC曲线分析结果
2.2炎性指标水平与食管癌根治性放化疗患者预后的关联性分析结果 以ROC曲线分析所得截断值进行分组,绘制Kaplan-Meier生存曲线。结果显示,SII≤794.8组的生存预后显著优于SII>794.8组(P<0.05);NLR≤3.25组的生存预后显著优于NLR>3.25组(P<0.05);PLR≤125.65组的生存预后显著优于PLR>125.65组(P<0.05)。但LMR>4.65组与≤4.65组,以及PNI>46.05组与≤46.05组的生存预后比较差异均无统计学意义(P>0.05)。见图2。

图2 不同层级炎性指标水平患者的生存曲线图
2.3影响食管癌根治性放化疗患者OS的Cox回归分析结果 单因素Cox回归分析结果显示,ECOG评分、T分期、TNM分期、淋巴结转移,以及SII、NLR、PLR水平与食管癌根治性放化疗患者的生存预后具有关联性(P<0.05)。进一步多因素Cox回归分析结果显示,以ECOG评分为0分作参照,ECOG评分为1~2分是影响患者生存预后的独立危险因素(P<0.05);以T分期为T1~T2作参照,T3~T4是影响患者生存预后的独立危险因素(P<0.05);以无淋巴结转移为参照,有淋巴结转移是影响患者生存预后的独立危险因素(P<0.05);以SII≤794.8为参照,SII>794.8是影响患者生存预后的独立危险因素(P<0.05)。见表2。

表2 影响食管癌根治性放化疗患者OS的单因素及多因素分析结果
2.4SII≤794.8组与SII>794.8组临床病理指标比较 SII>794.8组有淋巴结转移的人数比例大于SII≤794.8组,差异有统计学意义(P<0.05)。两组在年龄、性别、吸烟、饮酒、ECOG评分、T分期、TNM分期方面比较差异无统计学意义(P>0.05)。见表3。

续表2

表3 SII≤794.8组与SII>794.8组临床病理指标比较[n(%)]
2.5食管癌根治性放化疗患者生存预后的预测模型
以多因素Cox回归分析筛选出的4项独立影响因素:ECOG评分、T分期、N分期和SII建立预测模型,并绘制列线图。见图3。此模型的C-index为0.796(95%CI:0.757~0.871),提示此模型具有良好区分度。该模型的校正曲线中,预测曲线(彩色)和理想曲线(黑色)具有良好拟合度,提示该模型具有良好精确度。见图4。

图3 预测患者生存预后的列线图

彩色校准曲线是实际风险和预测风险的对比。曲线越接近对角线,提示预测效果越好,虚线对应于10%的误差幅度
3 讨论
3.1近年来,有多项研究提示炎性指标与多种肿瘤的侵袭性及预后相关。Deng等[17]报道了NLR和PLR在胃癌患者中与T分期、侵袭深度和淋巴结转移密切相关。在一项关于肝细胞癌的研究中,PNI<45的患者更有可能出现门静脉血栓,并与更严重的Child-Turcotte-Pugh分级相关[18]。Hong等[19]报道了较高的SII与肝细胞癌患者的预后具有关联。此外,也有多项研究表明,SII等炎性指标有作为肺癌、肝癌、前列腺癌、黑素瘤等多种肿瘤预后预测指标的潜力[20-21]。而在食管癌领域,有报道显示,SII与食管鳞癌根治性切除术患者的预后具有显著关联[22]。
3.2在本研究中,笔者评估了多种炎性指标对于食管癌根治性放化疗患者预后的预测能力,结果显示治疗前SII、NLR、PLR、LMR及PNI水平均能有效预测患者的生存预后。且进一步经多因素Cox回归分析结果显示,SII是影响食管癌根治性放化疗患者生存预后的独立因素。与SII≤794.8组相比,SII>794.8组有着更高的T分期、更差的ECOG评分以及更高的淋巴结转移率,生存预后更差。另外,NLR、PLR、ECOG评分、T分期、淋巴结转移也与患者的生存预后有关,这与相关研究的结果相似[23-26]。在本研究中,SII表现出相较于其他免疫炎性指标更强的预测预后的能力,究其原因,可能是组成SII的各项指标为人体血细胞中的主要成分,且血小板计数、中性粒细胞计数和淋巴细胞计数可随着病情、机体状态变化而发生显著改变,其他因素包括感染、淋巴结转移和营养状况也均能较为明显地影响SII数值,而这些因素对于食管癌根治性放化疗患者的治疗效果、生存质量均有着一定的影响[27-28]。
3.3SII是一个数值范围变化较大且敏感的指标,与血小板计数、中性粒细胞计数和淋巴细胞计数有关。血小板数目增多可以诱导肿瘤微血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达[29-30],刺激肿瘤内部血管生长,促进肿瘤增殖。血小板的黏附和聚集亦可促进花生四烯酸的代谢,产生血栓素A2,释放二磷酸腺苷(adenosine diphosphate,ADP)、5-羟色胺,从而收缩局部血管,在肿瘤附近及内部形成局部缺氧环境,继而激活低氧诱导因子(hypoxia-inducible factor,HIF)信号通路,加速肿瘤的生长,提高肿瘤的侵袭性,促使肿瘤发生转移[30]。有报道称中性粒细胞可高度表达VEGF、白细胞介素-1β、基质金属蛋白酶14(matrix metalloproteinase-14,MMP-14)等多种促血管生成因子,可促进肿瘤局部血管生成[31]。中性粒细胞亦可通过积压染色质纤维网形成中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs),直接促进肿瘤增殖、侵袭和转移。而中性粒细胞表面的整合素可与循环肿瘤细胞(circulating tumor cells,CTCs)表面的细胞间黏附分子1(inter-cellular adhesion molecule 1,ICAM-1)结合,其结合物水平与患者预后显著相关[32]。中性粒细胞已被证实在肿瘤微环境中可抑制DC细胞、巨噬细胞、NK细胞等先天免疫细胞,从而促进肿瘤免疫逃逸[33]。淋巴细胞为人体固有免疫的基础之一,目前有大量证据表明肿瘤浸润性淋巴细胞(tumor-infiltrating lymphocytes,TILs)对于肿瘤微环境发挥着举足轻重的作用,最终影响肿瘤的发展[34]。因此,SII可在一定程度上反映机体的免疫水平和肿瘤相关炎症反应的平衡状态,治疗前高SII可能提示着机体抗肿瘤免疫低下及炎症反应严重的状态,预示患者预后不良。
综上所述,SII可预测食管鳞癌根治性同步放化疗患者的生存预后,提示患者的免疫抑制及炎症激活状态。对于治疗前高SII患者,其预后可能较差,临床上可考虑予以及时干预,改善预后。但本研究为单中心研究,样本量较小,且未能动态检测SII在治疗前、中、后的变化,结果、结论尚需进一步验证。

